Тема 4
ОПТИЧЕСКИЕ МЕТОДЫ.
АБСОРБЦИОННЫЙ АНАЛИЗ.
ФОТОКОЛОРИМЕТРИЧЕСКИЙ МЕТОД.
Студент должен уметь выстроить калибровочный график для фотоколориметрического и спектрофотометрического определения количества различных ионов, и определить количество этих ионов.
Каждое вещество поглощает (или отражает) определенное количество света. Величина поглощения (или отражения) света определяется природой анализируемого вещества и его концентрацией в растворе. Вследствие этого возможно качественное и количественное определение элементного (или молекулярного) состава вещества методом абсорбционной спектроскопии. Абсорбционный анализ подразделяют на молекулярную и атомную спектрофотометрию.
Спектрофотометрия изучает поглощение анализируемым веществом света с определенной длиной волны, т.е. монохроматического излучения. Такие измерения выполняют с помощью спектрофотометров. Они снабжены оптической системой (монохроматором), дающей узкий монохроматический поток световой энергии для выполнения анализа.
У веществ в зависимости от их природы наиболее ярко выраженные полосы поглощения располагаются в разных областях спектра: в ультрафиолетовой (длина волн 200-400 нм), видимой (400-700 нм) и в инфракрасной (800-25000 нм).
Соответственно этому, абсорбционные спектральные определения различных веществ проводят в ультрафиолетовой, видимой и в инфракрасной областях спектра. Для каждой из этих областей подбирают соответствующее оборудование и соответствующий источник излучения.
Качественный анализ вещества проводят для идентификации веществ путем снятия спектра данного вещества.
Количественное определение концентрации вещества проводят для установления численной, т.е. молярной концентрации вещества в объекте исследования. Затем численную в определенном объеме концентрацию вещества пересчитывают на массовую концентрацию.
Колориметрия является наиболее простым методом оптического абсорбционного анализа, основанным на измерении поглощения света окрашенными растворами. Метод отличается достаточно высокой чувствительностью.
Определяемый компонент переводят в окрашенное соединение и по интенсивности окраски хромофора в растворе судят о количестве компонента. Сравнивают окраску этого раствора с окраской стандартного раствора, концентрация определяемого элемента в котором точно известна.
Происходит измерение поглощения анализируемым веществом света не строго монохроматического излучения. Измерения выполняют на приборах, называемых фотоколориметрами.
Для измерения абсорбционности (оптической плотности) растворов в диапазоне длин волн 315-980 нм, выделяемых 11 светофильтрами, применяют фотоэлектроколориметр КФК-2 (рис. 6).
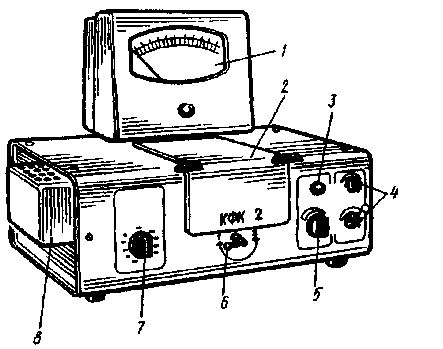
Рис. 6. Внешний вид фотоколориметра КФК-2:
1 - микроамперметр; 2 - кюветная камера; 3 - тумблер включения прибора; 4 - рукоятка чувствительности «грубо» и «точно»; 5 - переключатель фотоприемников; 6 - ручка смены кювет; 7 - ручка переключения длин волн; 8 - источник освещения.
Как правило, концентрацию искомых веществ в растворах определяют при помощи построения градуировочных графиков или расчетов.
Измерение оптической плотности эталонных и анализируемых растворов проводят с одним и тем же светофильтром, в одной кювете, с одним нулевым раствором и из мерных колб одинаковых объемов. В случае замены светофильтра, объема колб или кювет измерения проводят заново и вычерчивают новый график.
На шкалах прибора рядом с равномерной шкалой пропускания нанесена и логарифмическая шкала оптических плотностей (поглощения). При необходимости показания прибора по шкале пропускания (Т) пересчитывают на поглощение по формуле
D = 2 - lgТ.
При прохождении потока излучения через частично поглощающую среду интенсивность прошедшего потока (I) отличается от интенсивности падающего (I0). Величину lgI0/I называют оптической плотностью и обозначают D или А. Она характеризует поглощательную способность вещества. Согласно закону Бугера Ламберта Бера,
D = e l C,
где D - оптическая плотность раствора;
e - молярный коэффициент поглощения вещества;
l - толщина слоя раствора, поглощающего свет, см;
С - концентрация вещества, поглощающего свет, моль/л.
Поглощение раствора аналитической формы измеряют относительно дистиллированной воды или относительно раствора сравнения, поглощение которого принимают за оптический нуль. Если используют раствор сравнения, то он содержит все вещества, за исключением определяемого.
Порядок работы на приборе КФК-2. Перед выполнением измерений прибор включают в сеть и прогревают 20 мин. Без кювет прибор устанавливают на электрический нуль, т.е. тумблерами светопоглощения (пропускания), находящимися справа, стрелку гальванометра подводят к нулю.
Подбирают рабочую кювету. Если раствор имеет интенсивную окраску, то для работы используют кювету с небольшой рабочей длиной кюветы (1-3 мм), слабоокрашенные растворы измеряют при рабочей длине кюветы до 50 мм. В первую кювету до риски наливают исследуемый раствор. Во вторую идентичную кювету наливают дистиллированную воду и используют как раствор сравнения. Обе кюветы помещают в кюветодержатель параллельно друг другу.
Выбор светофильтра. На передней панели фотоколориметра слева находится барабан с указанием длин волн. Оптическую плотность кюветы с раствором сравнения (водой) выводят на ноль. Поочередно, начиная с 315 нм и заканчивая максимальной длиной волны, т.е. со всеми светофильтрами, проводят измерение оптической плотности исследуемого максимально окрашенного раствора. Результаты записывают в таблицу:
|
Длина волны, нм |
Процент пропускания, Т |
Оптическая плотность, D |
|
|
|
|
Для дальнейшей работы выбирают светофильтр, соответствующий наибольшему значению поглощения исследуемого раствора.
Определение концентрации раствора. При определении концентраций веществ в растворах и при построении калибровочного графика количество реагентов в мерных колбах должно быть одинаковым. Если производят разведение раствора, то его учитывают при перерасчете концентрации вещества на 1000 мл. Условия исследований будут считаться подобранными правильно в том случае, если измеренная оптическая плотность будет находиться в пределах 0,4-0,5.
Поместив кювету сравнения в кюветодержатель и регулируя усиление фототока винтом с пометкой «грубо», стрелку показывающего прибора устанавливают на отметку 100%-го пропускания, соответствующего оптическому нулю в данной системе.
Затем в световой пучок вместо кюветы сравнения рукояткой устанавливают кювету с фотометрируемым раствором. В этом случае световой поток уменьшится в соответствии с законом Бугера - Ламберта - Бера. Стрелка показывающего прибора остановится на отметке, соответствующей пропусканию исследуемого раствора. Этот показатель записывают, но важно также записать показатель поглощения. Для этого используют следующую форму:
|
Номер образца |
Процент пропускания, Т |
Оптическая плотность, D |
|
1 и т.д. |
|
|
Построение калибровочного графика. Наиболее широко применяемый способ определения концентраций веществ - графический. Для построения калибровочного графика сначала готовят серию растворов с известными концентрациями (С). Измеряют оптическую плотность каждого раствора (D) относительно первого, второго или третьего растворов, выводя оптическую плотность этих трех растворов на оптический ноль. Часто в качестве контроля используют все ингредиенты реакции без определяемого вещества или просто дистиллированную воду. В первом случае один из контролей используют для дифференциального фотоколориметрирования растворов с очень низкой концентрацией.
Калибровочный график вычерчивают на миллиметровой бумаге, откладывая по оси ординат величину оптической плотности эталонных растворов, а на оси абсцисс-концентрацию этих растворов.
Если контролем служила вода или все ингредиенты реакции без определяемого вещества, то прямую проводят от начала координат. Затем последующие точки идут через точки пересечения перпендикуляров, отложенных на оси абсцисс и на оси ординат полученных значений. Теоретически все точки должны лежать на прямой. Однако вследствие неизбежных ошибок ряд точек не попадает на нее и отклоняется от прямой в ту или другую сторону. В этом случае калибровочную линию проводят, расположив линейку между точками, так, чтобы она проходила по возможности ближе к большинству нанесенных на график точек (рис. 7).
Часто калибровочный график называют калибровочной кривой.
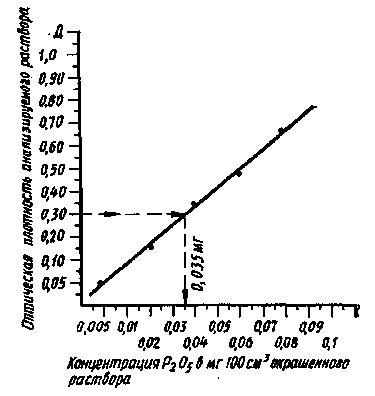
Рис. 7. Калибровочный график для фотоэлектроколориметрических измерений
(для определения содержания фосфора в растениях)
На каждом графике должно быть указано, для какого элемента или его соединения он составлен, с каким светофильтром и в какой кювете (длина рабочей грани). Также указывают, с каким нулевым раствором проведены измерения оптической плотности, на какой объем рассчитана концентрация эталонного раствора, т.е. указывают объем мерных колб серии эталонных растворов - 100, 50 или 25 мл.
Расчет концентрации вещества в анализируемом растворе осуществляют несколькими способами.
Определение концентрации вещества в анализируемом растворе по калибровочному графику проводят следующим образом. Измерив оптическую плотность анализируемого раствора, находят на оси ординат точку, соответствующую данному значению оптической плотности. Проводят от нее линию, параллельную оси абсцисс до пересечения с калибровочной линией, и опускают из этой точки перпендикуляр на ось абсцисс (см. рис. 7). По точке пересечения перпендикуляра с осью абсцисс отмечают концентрацию определяемого вещества в данном растворе и пересчитывают ее обычно на 100 или 1000 г навески или на 1 л раствора.
Калибровочным графиком можно пользоваться долго, периодически проверяя его по трем-четырем эталонным растворам.
Пользуясь объединенным законом поглощения, концентрацию вещества в растворе можно рассчитать по формуле Бугера - Ламберта - Бера:
![]()
где D - оптическая плотность раствора;
ελ - индивидуальный коэффициент поглощения света веществом;
l - ширина кюветы, см;
Сх - концентрация вещества, моль/л.
Расчетный метод. Поскольку оптическая плотность растворов, измеренная в одинаковых кюветах, прямо пропорциональна их концентрации, концентрацию испытуемого раствора Сх можно вычислить по величине оптической плотности близкого по окраске эталонного раствора.
Расчет ведут по формуле
![]()
где Dх - оптическая плотность определяемого раствора;
Сэ - концентрация эталонного вещества в растворе, моль/л или г;
Dэ - оптическая плотность эталонного раствора;
Часто этим методом пользуются, когда требуется какая-либо проверка.
Метод добавок. Сначала измеряют оптическую плотность Ах раствора с неизвестной концентрацией (Сх), а затем в тех же условиях оптическую плотность A1 того же раствора с добавкой некоторого известного количества определяемого вещества С1. Значит, во втором растворе концентрация определяемого вещества равна Сх+C1, а оптическая плотность этого раствора складывается из Ах и оптической плотности добавки.
Метод добавок можно использовать в графическом варианте (рис. 8).
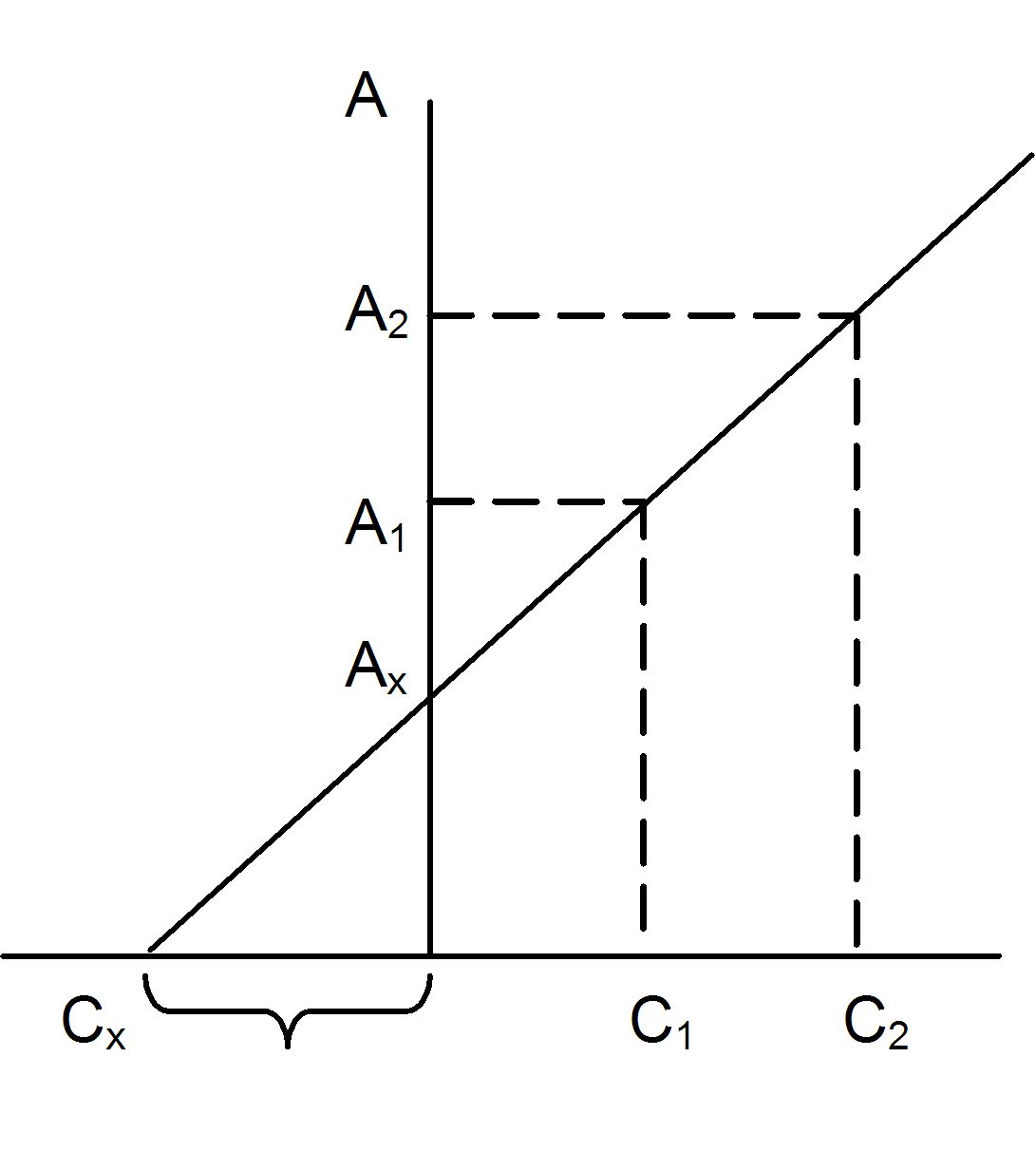
Рис. 8. Определение концентрации методом добавок
По оси концентраций откладывают добавленное количество стандартного раствора. Значения А1 и Ах, при которых добавка равна 0, откладывают по оси ординат. Соединяют обе точки и продолжают до пересечения с осью концентраций. Отсекаемый отрезок является определяемой концентрацией Сх. Готовят еще один раствор, содержащий добавку Сz, измеряют его оптическую плотность А2 и проводят прямую через три точки.
Погрешность будет наименьшей, если первая добавка близка к определяемому количеству, а вторая в 2 раза больше первой. Такие добавки должны обеспечить угол наклона прямой, близкий к 45°.
Табличный метод. Вместо калибровочного графика часто пользуются градуировочными таблицами. Такими таблицами особенно удобно определять концентрацию вещества, когда амплитуда колебания концентрации в растворе небольшая.
Табличный метод состоит в том, что по данным, полученным при измерении оптической плотности, составляются таблицы, в которых указано, какое количество определяемого вещества в процентах, миллиграммах или миллиграмм - эквивалентах соответствует той или иной величине оптической плотности раствора данного вещества.
|
- Работа 4.1. Фотометрическое определение содержания меди (II) в растворе - Работа 4.2. Фотометрическое определение количества ионов аммония и аммиака - Работа 4.3. Микрометод, или ускоренный метод определения общего азота - Работа 4.4. Фотометрическое определение количества фосфатов - Работа 4.5. Определение нитратов качественными реакциями - Работа 4.6. Определение нитратов в растениях и воде фотометрическим методом - Работа 4.7. Определение нитратов в почве фотометрическим методом - Работа 4.8. Определение нитритов по Гриссу фотометрическим методом - Работа 4.9. Определение нитратов в воде методом фотоколориметрии с салициловой кислотой - Работа 4.10. Определение содержания хлорофилла в листьях фотометрическим методом - Работа 4.11. Определение диоксида азота в атмосфере (в окружающем воздухе) |