Работа 4.2
Фотометрическое определение количества ионов аммония и аммиака
Приборы, оборудование и реактивы: фотоколориметр, кюветы на 10 мм, мерные колбы на 50 и 100 мл, пипетки, бюретки, мерные пробирки, раствор сульфата аммония (NH4)2SO4 с концентрацией 0,004 мг/мл азота (прил. 8.3), раствор сегнетовой соли (прил. 8.4), реактив Несслера (прил. 8.5).
Принцип метода. Ионы аммония в воде или растворе в свободном состоянии не существуют. Соли аммония бесцветны. Для анализа их вводят в реакцию с реактивом Несслера. Реактив Несслера – раствор двойной соли йодистой ртути и йодистого калия. С ионами аммония в едком калии этот реактив дает красно - бурый осадок йодистого меркураммония:
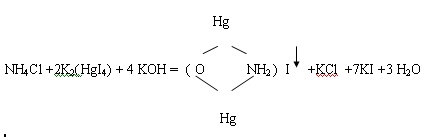
или
(NH4)2SO4 + 4K2(HgI4) + 8KOH = 2(ОHg2NH2)I + K2SO4 + 14KI + 6H2O.
Качественное определение солей аммония и аммиака. Чтобы убедиться в наличии аммиака, в прозрачную пробирку наливают 10 мл исследуемой воды или раствора, прибавляют 2-3 капли реактива Несслера. При наличии в воде аммиака (ионов аммония) или его солей вода окрашивается в оранжевый или красно-бурый цвет. Количественно аммоний и аммонийный азот определяют фотометрическим методом.
Ход анализа.
Приготовление рабочего стандартного раствора. Сначала нужно рассчитать навеску и из нее приготовить 1 л раствора сульфата аммония с концентрацией 0,004 мг/мл азота. Расчет навески и приготовление раствора проводят по аналогии с примером 3 в работе 13.2 из темы 13. Навеска сульфата аммония марки х.ч. должна быть равна 0,0188 г.
Калибровочный график. Для приготовления серии стандартных растворов необходимо рассчитать в молях на литр и в миллиграммах на миллилитр предельные максимальную и минимальную концентрации.
По закону Бугера Ламберта Бера коэффициент ε (ОHg2NH2)I при
λ 400-450 нм = 62 ·103; Mr (N)=14; Mr (ОHg2NH2)I = 560.
Вычислить объемы рабочего раствора для приготовления пяти стандартных растворов объемом по 50 мл с концентрацией в пределах 0,0004- 0,002 мг/мл азота.
Необходимо составить и заполнить следующую форму:
|
Номер стандартного раствора |
Объем рабочего раствора, мл |
Концентрация стандартного раствора, мг/мл азота |
Абсорбция стандартного раствора, D |
В мерные колбочки на 50 мл внесите пипеткой или из бюретки вычисленные объемы рабочего раствора (5, 10, 15, 20, 25 мл). Рассчитываем количество азота на 1 л: 0,004 умножаем на аликвоту, делим на 50 мл и умножаем на 1000 мл. Полученные растворы содержат 0,4; 0,8; 1,2; 1,6; 2,0 мг/л азота. Соблюдая строгую последовательность, прилейте воды до 45 мл, затем добавьте по 1 мл сегнетовой соли и по 2 мл реактива Несслера. Доведите объем водой до метки, перемешайте. Приготовьте раствор - фон так же, как и стандартные растворы, но без добавления рабочего раствора.
Выбор светофильтра. Проведите фотометрирование стандартного раствора с наибольшей концентрацией со всеми светофильтрами поочередно. Для выполнения анализа возьмите тот светофильтр (λ 425 нм), которому соответствует наибольшая абсорбция (оптическая плотность).
Калибровочный график. Через 10 мин при λ 425 нм измерьте оптическую плотность всех стандартных растворов. По полученным данным постройте калибровочный график в координатах: оптическая плотность раствора – концентрация азота.
Определение концентрации анализируемого раствора (АР). Возьмите водопроводную воду или приготовьте АР. аналогично приготовлению стандартных растворов. Определите абсорбцию и по графику найдите концентрацию азота в АР.
Концентрацию азота находят по формуле
С = А · 1000 / V,
где С - концентрация азота, мг/л;
А - концентрация азота по графику, мг N;
V - объем пробы, взятой для анализа, мл.
Контрольные вопросы
1. Объясните принцип фотометрического определения ионов аммония.
2. Как построить калибровочный график для определения ионов аммония?
3. Как рассчитать концентрацию ионов аммония на 1 л?