Тема 8
ХРОМАТОГРАФИЯ.
ХРОМАТОГРАФИЧЕСКИЕ ХАРАКТЕРИСТИКИ.
ХРОМАТОГРАФИЧЕСКИЙ АНАЛИЗ
Студент должен знать сущность хроматографического процесса, блок-схемы хроматографов, параметры идентификации веществ и расчет их количества; уметь рассчитать эффективность хроматографической колонки по параметрам пика и по объему удерживания.
Хроматография - метод разделения, обнаружения и определения веществ, основанный на различии их поведения в системе из двух несмешивающихся фаз - подвижной и неподвижной.
Поскольку хроматографические процессы зависят от природы и концентрации веществ, хроматография является важным методом идентификации и определения веществ. Хроматографию используют для разделения сложных смесей веществ (нефть, лекарственные препараты, вещества растительного происхождения, кровь, пестициды и их метаболиты).
В хроматографическом процессе сочетаются термодинамический (установление равновесия между фазами) и кинетический (движение компонентов с разной скоростью) аспекты.
По способу хроматографирования различают колоночную и плоскостную хроматографию. В колоночном варианте разделение проводят в колонке, в плоскостном варианте - на бумаге или в тонком слое сорбента.
Сущность хроматографии. Хроматографический процесс заключается в перемещении подвижной фазы, содержащей компоненты разделяемой смеси, относительно неподвижной. Подвижной фазой может быть жидкость (раствор анализируемой смеси веществ) или газ (смесь газов или паров веществ), неподвижной фазой - твердое вещество или жидкость, адсорбированная на твердом веществе, которое называют носителем. При движении подвижной фазы вдоль неподвижной компоненты смеси сорбируются на неподвижной фазе. Каждый компонент сорбируется в соответствии со сродством к материалу неподвижной фазы. Неподвижную фазу называют сорбентом. Молекулы вещества с сорбента переходят в подвижную фазу и вместе с ней продвигаются дальше и затем наоборот. Чем сильнее вещество сорбируется на неподвижной фазе, тем медленнее его продвижение с подвижной фазой. Одни компоненты задерживаются в начале пути, другие продвигаются дальше. В результате на выходе из колонки сначала появляется наименее сорбируемое вещество, затем другие в порядке возрастания сорбируемости. Фиксируя аналитический сигнал на выходе получают хроматограмму, состоящую из ряда пиков, каждый из которых соответствует отдельным компонентам смеси. По оси абсцисс откладывают время, а по оси ординат - концентрацию веществ либо величину, связанную с ней (например, электропроводимость или оптическую плотность).
Хроматографические характеристики. Из всех видов хроматографии наибольшее значение имеет колоночная хроматография. Рассмотрим основные характеристики метода.
Коэффициент емкости. Эта характеристика показывает, насколько сильно вещество А удерживается сорбентом:
![]() ,
,
где k - коэффициент емкости;
nподв и nнеподв - число молей вещества А соответственно в подвижной и неподвижной фазах.
Коэффициент распределения. Равновесие, устанавливающееся при распределении вещества А между подвижной и неподвижной фазами, описывают коэффициентом распределения D:
![]() ,
,
где Снеподв и Сподв - концентрации вещества А в неподвижной и подвижной фазах.
Для каждого вида хроматографии коэффициент распределения имеет свое название: в распределительной и ионообменной - коэффициент распределения, в адсорбционной - коэффициент адсорбции, в гель-фильтрационной - коэффициент проницаемости.
Коэффициент разделения. Пусть разделяются два вещества А и В, степень разделения выражается коэффициентом разделения α, рассчитанным по формулам
![]()
где kА и kВ - коэффициенты емкости;
DA и DВ - коэффициенты распределения веществ А и В.
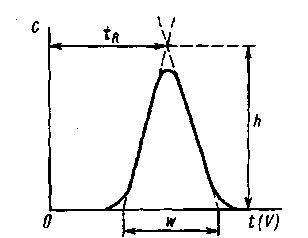
Характеристики пиков. Каждый пик на хроматограмме характеризуют шириной, высотой, формой и временем удерживания (рис. 39, 40). Время удерживания tR отсчитывают от момента ввода смеси в колонку до появления на выходе из колонки максимума пика. С параметром tR связан параметр,называемый индексом удерживания R:
![]()
где tm - время прохождения (мертвое время) растворителя или неудерживаемого вещества через ту же колонку. Для каждого вещества характерно свое значение R, поэтому время и индекс удерживания могут служить для идентификации веществ.
Для характеристики пика используют также параметр, называемый удерживаемым объемом V:
V = tRF,
где F - скорость, с которой продвигается определенный объем потока.
Обычно на практике используют исправленное время удерживания (t'R) и исправленный объем удерживания (V'R). Эти параметры учитывают время прохождения через колонку неудерживаемого компонента, в частности растворителя:
t'R = t R - tm, V' R = VR - Vm.
Каждый пик характеризуется своей шириной w. Ширина равна основанию треугольника, образованного касательными к левой и правой ветвям пика (см. рис. 39).
Высота пика (h) определяется от его основания до пересечения правой и левой ветвей пика.
|
|
Рис. 39. Характеристики хроматографического пика
|
|
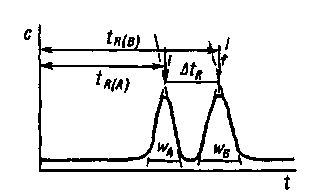
Рис. 40. Определение разрешения пиков веществ А и В
Разрешение пиков. Полнота разделения и правильность определения зависят от того, насколько отделены пики друг от друга, желательно, чтобы они не перекрывались, в то же время расстояние между ними не должно быть очень большим, так как это неоправданно замедляет анализ. Для характеристики разделения пиков служит величина, называемая разрешением Rs:
![]()
или, если WA = WB (см. рис. 40):
![]()
На рис. 41 приведены пики веществ А и В при разном разрешении.
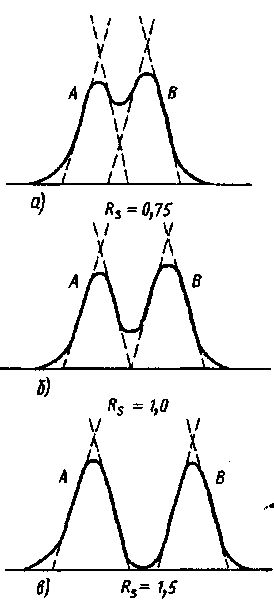
Рис. 41. Два пика с разным разрешением
При Rs=0,75 разделения практически не произошло (см. рис. 41, а); при Rs=l,0 разделение частичное (см. рис. 41, б); лишь при Rs=l,5 (рис. 41, в) можно считать, что оба вещества разделены полностью. Значение Rs=1,5 является оптимальным только для симметричных пиков, если пики асимметричны (имеют фронт или хвост), оптимальное значение Rs будет больше.
Теория хроматографии. Для объяснения явлений, происходящих при хроматографировании, для расчета длины колонок, положения и формы пиков, для выбора оптимальных условий процессов существуют два подхода - теория теоретических тарелок и кинетическая теория.
Теоретическая тарелка - это абстрактная величина, ее можно представить в виде узкого слоя колонки, в котором достигается равновесие между подвижной и неподвижной фазами. Чем больше таких равновесий, тем эффективнее разделение. Число теоретических тарелок, таким образом, может служить мерой эффективности колонки. Обычно для эффективности колонки используют высоту, эквивалентную теоретической тарелке Н. Эта величина связана с длиной колонки L и числом теоретических тарелок N:
![]()
Чем меньше Н, тем эффективнее колонка.
Кинетическая теория основана на скорости миграции вещества. Любая молекула вещества при движении вдоль колонки находится то в неподвижной, то в подвижной фазах, т.е. то движется по колонке, то останавливается. Таким образом, процесс хроматографирования является ступенчатым. От соотношения времени, проводимого молекулой в обеих фазах, зависит ее скорость продвижения по колонке.
Эффективность колонки в кинетической теории связывают с кинетическим параметром - временем удерживания tR:
![]()
 .
.
Пример. Рассчитайте число теоретических тарелок и Н колонки длиной 40,2 см, если на хроматограмме максимум пика соединения А появился через 15 мин после введения образца и ширина пика 24,2 см.
Для этого находят
![]()
С позиций кинетической теории вполне объяснима форма пика в виде гауссовой кривой. Хроматограмма отражает статистическое поведение множества молекул, а не индивидуальной молекулы. Из-за случайного стечения обстоятельств одни молекулы могут продвигаться с несколько большими, другие – с меньшими скоростями. Поэтому наблюдаются отклонения от среднего значения скорости движения в ту и другую сторону, что и выражается кривой распределения. Форма пика отражает поведение усредненной молекулы. Как и любую гауссову кривую, пик можно охарактеризовать стандартным отклонением от среднего (σ = w/4).
На практике пики не всегда симметричны (рис. 42). По ряду причин возможно размывание пика перед максимумом (размывание фронта) либо после максимума (появление «хвоста»). Форма пика связана с характером изотермы сорбции, т.е. зависимостью концентрации вещества в подвижной фазе от его концентрации в неподвижной фазе при равновесии.
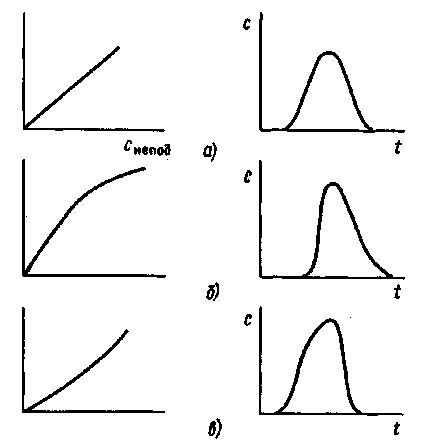
Рис. 42. Связь формы пика и характера изотермы сорбции:
а - изотерма линейна - пик симметричен; б - изотерма выпуклая - пик размыт со стороны фронта; в - изотерма вогнута - пик имеет «хвост»
Для получения симметричного пика изотерма должна быть прямой линией (см. рис. 42, а). Если изотерма выпуклая, наблюдается размывание перед фронтом (см. рис. 42, б), если вогнутая - появляется «хвост» (рис. 42, в).
На продвижение частицы влияет ряд факторов, искажающих форму пика и снижающих эффективность колонки, а именно: структура неподвижной фазы (размеры гранул, их однородность, плотность и равномерность заполнения колонки); скорость установления равновесия сорбция -десорбция (массообмен); диффузия молекул из зоны большей концентрации в зону меньшей концентрации. Влияние этих факторов на эффективность колонки учитывается уравнением Ван-Деемтера:
![]()
где v - скорость потока;
А - константа, связанная со структурой неподвижной фазы;
В - константа, связанная со скоростью потока и с коэффициентом диффузии в подвижной фазе;
С - константа, отражающая скорость массообмена.
Существует оптимальная скорость потока, при которой Н минимальна (рис. 43).

Рис. 43. Графическое представление уравнения Ван-Деемтера
Хроматографический анализ. При хроматографировании происходит разделение веществ. Далее разделенные вещества можно идентифицировать и количественно определить. При этом используют два приема:
1) собирают фракции после хроматографирования и анализируют их каким-либо методом количественного анализа;
2) вводят непрерывное автоматическое детектирование, используя подходящие детекторы для измерения аналитического сигнала от выходящих из колонки компонентов и самописцы для регистрации этого сигнала.
В результате получают хроматограмму, расшифровка которой и составляет основу хроматографического анализа. Положение пика на хроматограмме используют для качественного анализа, высоту или площадь пика - для количественного анализа.
Параметры этих двух показателей и являются критериями качественного и количественного анализа.
Качественный анализ. Важнейшие характеристики хроматографии - время удерживания tR и связанный с ней удерживаемый объем - отражают природу веществ, их способность к сорбции на материале неподвижной фазы и, следовательно, при постоянстве условий хроматографирования являются средством идентификации веществ. Для данной колонки с определенными скоростью потока и температурой время удерживания каждого соединения постоянно. Для идентификации вещества по хроматограмме обычно используют стандартные образцы или чистые вещества. Сравнивают время удерживания неизвестного компонента tx с временем удерживания tст известных веществ. Более надежна идентификация по относительному времени удерживания:
![]()
При этом в колонку сначала вводят известное вещество (например, пентан в газовой хроматографии) и измеряют его tR, а затем tx относительно tR этого стандарта.
Хроматограммы позволяют оценить степень чистоты многих соединений, в частности растворителей: появление дополнительных пиков (помимо основного) указывает на загрязнение.
Количественный анализ. В основе этого анализа лежит зависимость высоты пика h и его площади s от количества вещества. Для узких пиков предпочтительнее измерение h, для широких размытых - s. Площадь пика измеряют разными способами, например графически (площадь треугольника, см. рис. 39) или планиметром. В современных хроматографах имеется специальное устройство (электрический или электронный интегратор), измеряющее площадь пиков.
Для определения концентрации обычно используют метод градуировочного графика: строят графики зависимости h (s) от концентрации (С) для каждого компонента смеси.
|
- Работа 8.1. Колоночная хроматография. Качественный и количественный анализ веществ газовой хроматографией - Работа 8.2. Плоскостная хроматография. Качественный и количественный анализ веществ бумажной и тонкослойной хроматографией - Работа 8.3. Двумерная хроматография - Работа 8.4. Хроматография красителей из фломастеров методом бумажной хроматографии - Работа 8.5. Хроматография красителей фломастеров на тонком слое адсорбента - Работа 8.6. Двумерная хроматография красителя из фломастера - Работа 8.7. Определение аминокислот методом бумажной хроматографии - Работа 8.8. Определение остаточных количеств пестицидов: ДДТ и его метаболитов, альфа - ГХЦГ и гамма – ГХЦГ методом хроматографии - Работа 8.9. Определение ДДТ, ГПХ и гамма - ГХЦГ в почве, сахарной свекле и картофеле методом тонкослойной хроматографии - Работа 8.10. Количественное определение дикамбы (банвела-Д, дианата) в растениях и в почве методом хроматографии в тонком слое - Работа 8.11. Количественное определение 2,4-Д в растениях методом хроматографии в тонком слое - Работа 8.12. Модельный опыт по экстрагированию, концентрированию, разделению веществ для хроматографии |