Работа 8.7
Определение аминокислот методом бумажной хроматографии
Приборы и реактивы: сушильный шкаф, пульверизатор, штатив, пробирки, хроматографическая бумага, нитки, раствор фенола, раствор нингидрина 0,1-0,2%-й, гидролизат белка, спирт, раствор аминокислот для хроматографического анализа. Готовят растворы, состоящие из трех различных аминокислот, по следующей прописи:
Смесь 1: в 10 мл дистиллированной воды растворяют 60 мг глютаминовой кислоты, 40 мг аланина и 50 мг лейцина.
Смесь 2: в 10 мл дистиллированной воды растворяют 60 мг глютаминовой кислоты, 40 мг гликокола и 40 мг аланина.
Смесь 3: в 10 мл дистиллированной воды растворяют 60 мг аспарагиновой кислоты, 40 мг серина и 40 мг лейцина.
Смесь 4: в 10 мл дистиллированной воды растворяют 60 мг аспарагиновой кислоты, 40 мг гликокола и 60 мг лейцина.
Метод распределительной хроматографии заключается в том, что каплю смеси аминокислот, например гидролизата белка, наносят на полоску фильтровальной бумаги, конец которой опускают в подходящий органический растворитель. Растворитель поглощается полоской фильтровальной бумаги и увлекает за собой нанесенные на бумагу аминокислоты. Скорость перемещения аминокислот на бумаге зависит от химического строения аминокислот и от их способности растворяться в подвижном и неподвижном растворителе. В качестве подвижного растворителя употребляют, например, водонасыщенный фенол (или амиловый спирт, н-бутиловый спирт и др.). Неподвижным растворителем является вода, пары которой, имеющиеся в воздухе, насыщают фильтровальную бумагу. Внешне бумага остается сухой. Чем меньше растворимость аминокислот в воде и чем больше их растворимость в феноле, тем быстрее они движутся вслед за фронтом органического растворителя.
Положение аминокислот на бумаге можно обнаружить при помощи цветной реакции с нингидрином. Реакцию производят путем опрыскивания из пульверизатора высушенной полоски бумаги 0,1-0,2%-м спиртовым раствором нингидрина с последующим нагреванием ее в сушильном шкафу. Отдельные аминокислоты обнаруживаются в виде пятен, окрашенных в голубой, фиолетовый или оранжевый цвет (в зависимости от химической структуры аминокислоты). Скорость перемещения отдельных аминокислот может быть выражена посредством коэффициента распределения (Rf).
Коэффициент распределения это отношение расстояния (мм) от места нанесения аминокислоты до середины ее пятна (а) к расстоянию от места нанесения аминокислоты до фронта растворителя (в) Rf = а/в (рис. 49).
Коэффициент распределения является характерной величиной для каждой аминокислоты и постоянен при данных условиях опыта (растворитель, температура, сорт бумаги и др.).
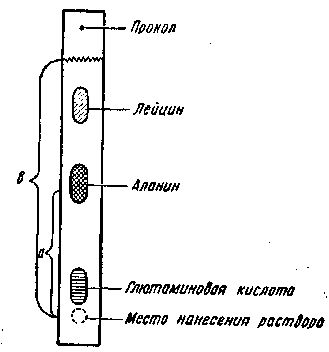
Рис. 49. Хроматограмма аминокислот
Ход работы. Вырезают полоску фильтровальной бумаги длиной 12-15 см, шириной 1,5 см. Через верхний конец полоски протягивают нитку длиной 15-20 см и завязывают ее узелком. На нижнем конце полоски на расстоянии 1 см от края наносят карандашом кружок диаметром 3-4 мм.
В середину кружка при помощи капилляра наносят маленькую каплю исследуемого раствора смеси аминокислот (например, смесь глютаминовой кислоты, аланина и лейцина) (рис. 50).
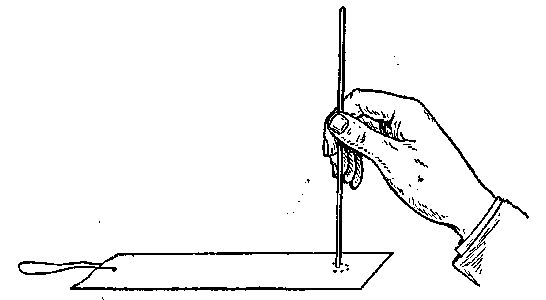
Рис. 50. Нанесение раствора аминокислот на хроматограмму
Место, где была нанесена капля раствора, подсушивают на воздухе.
На дно пробирки длиной 18-20 см, диаметром 2-2,5 см осторожно, не смачивая стенок, наливают из пипетки 15-20 капель фенола, насыщенного водой. Приготовленную бумажную полоску, придерживая за нитку, опускают в пробирку с водонасыщенным фенолом так, чтобы она погрузилась в жидкость на 2-3 мм (рис. 51). Полоска должна висеть вертикально не касаясь стенок.
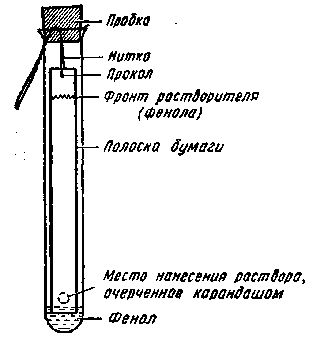
Рис. 51. Упрощенный прибор для распределительной хроматографии
Пробирку закрывают пробкой, ставят в штатив и помещают в термостат при температуре 35-40°С на 1,2-2 ч. За это время фронт растворителя поднимается на 10-12 см. По истечении указанного времени полоску вынимают из пробирки (за нитку) и подвешивают в вертикальном положении на 10-15 мин в сушильном шкафу, нагретом до 50-100 °С.
После испарения фенола (т.е. через 10-15 мин) бумажную полоску вынимают из сушильного шкафа. Ее подвешивают на штатив, опрыскивают из пульверизатора 0,1-0,2%-м раствором нингидрина и вновь помещают в сушильный шкаф при температуре 100-110°С на 5-6 мин. В местах, где присутствуют аминокислоты, появляются синие или фиолетовые пятна.
Бумажную полоску кладут на стеклянную пластинку (2010 см) и при помощи линейки измеряют расстояния (см. рис. 49):
1) от места нанесения капли раствора до середины каждого пятна (а);
2) от места нанесения капли раствора до фронта растворителя (б).
Вычисляют коэффициент распределения для глютаминовой кислоты (первое пятно), аланина (второе пятно) и лейцина (третье пятно).
Можно по стандартам аминокислот выстроить калибровочный график. Вырезают и ножницами мелко измельчают бумагу с пятнами стандартов на хроматограмме. Так же поступают с образцами. Растворяют пятна в мерных колбах. Фотометрируют растворы отдельно с пятнами стандартов и образцов аминокислот. Рассчитывают количество аминокислот.