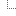4.2.1. Мониторинг и прогноз почвенных, или корне-клубневых, вредных организмов
Под фитосанитарным мониторингом почвы следует понимать последовательную диагностику и контроль численности популяций вредных организмов (фитопатогенов, фитофагов, сорных растений) в почве полей хозяйств с целью принятия решений по их оздоровлению. |
Периодичность мониторинга определяется длительностью выживания покоящихся пропагул (фитопатогены), фаз развития (фитофаги), семян и подземных органов в почве (сорные растения). Все вредные организмы этой экологической группы имеют признаки жизненного цикла К- и Кr-стратегов. Для составления многолетнего прогноза фитосанитарного состояния почв мониторинг проводится не реже одного раза за ротацию севооборота, а для составления долгосрочного (сезонного) прогноза – в конце вегетации предыдущего года или перед посевом – текущего. Во всех случаях важна исходная до посева численность вредных организмов в расчете на 1г почвы, 1 м2 или 1 га поля. Методики учета численности почвенных фитопатогенов, фитофагов и многолетних сорных растений в агроэкосистемах приведены в дальнейшем изложении главы.
Длительный мониторинг фитопатологического состояния почв на примере их заселенности возбудителем обыкновенной (гельминтоспориозной) корневой гнили под яровую пшеницу показал, что между численностью возбудителя в почве и многолетней динамикой болезни существует тесная прямая связь: r=0,955±0,027 (рис. 18). Коэффициент детерминации свидетельствует о том, что многолетняя динамика болезни на 91,2 % зависит от заселенности почвы B. sorokiniana.
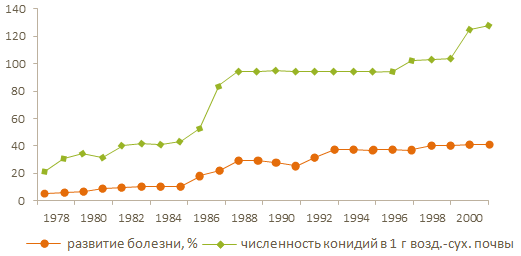
Рис. 18. Многолетняя динамика корневых гнилей и заселенности почв Bipolaris sorokiniana в лесостепи Западной Сибири
Засушливые условия в различные периоды вегетации, характерные для Сибири, являются стресс-фактором, стимулирующим ЭП корневых гнилей.
Наиболее вредоносной оказалась июньско-июльская засуха: развитие корневой гнили при заселенности почв возбудителем выше ПВ возросло за вегетацию в 4,5 раз, превысив аналогичный показатель по оптимальному фону увлажнения к концу вегетации на 36,5 % и снизив вегетативную массу растений и озерненность колоса на 36,1 и 42,6 % соответственно. Общая зерновая продуктивность растений снизилась на 54,0 % по сравнению с оптимальным фоном увлажнения.
Корневые гнили негативно влияли на формирование всех элементов структуры урожая (густоту продуктивного стеблестоя, число зерен в колосе и массу 1000 зерен) в результате нарушения азотного, фосфорного, углеводного обмена веществ в растении, ухудшая качество зерна яровой пшеницы. Особенно резко ухудшалась сила муки при росте разжижения теста.
Для предотвращения эпифитотий обыкновенной корневой гнили необходимо снижать инфекционный потенциал возбудителя в почве ниже порога вредоносности (20 конидий/г почвы применительно к выщелоченному чернозему).
Кроме B. sorokiniana, корневые гнили и увядание растений сельскохозяйственных культур вызывают грибы рода Verticillium, Rhizoctonia, Fusarium и др. Особенно широко распространены виды рода Fusarium, которые являются продуцентами микотоксинов, индуцирующих трахеомикозное увядание сельскохозяйственных культур. Вероятность проявления различных типов фузариозов на территории РФ видно на рис. 19.
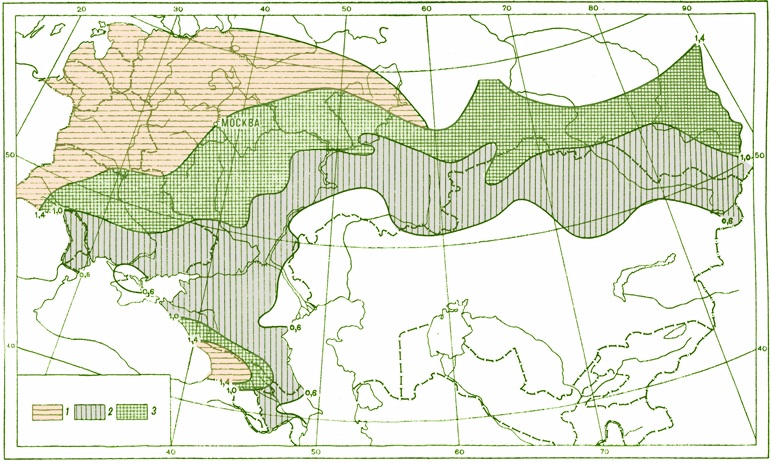
Рис. 19. Вероятность проявления различных типов фузариозных болезней зернобобовых культур (по М.Ю. Степановой)
1 – преобладание корневой гнили; 2 – преобладание увядания растений; 3 – проявление обоих типов болезней. На изолиниях даны значения ГТК
Многочисленные методы выделения грибных возбудителей из почвы можно разделить на две группы – методы промывки на ситах и методы приманок и ловчих растений. При определении зараженности почвенных проб возбудителями болезней необходимо учитывать срок отбора проб (вегетационный период), глубину отбора (корнеобитаемый слой), вид и сорт возделываемой культуры.
Метод промывки почвы на ситах основан на создании промывающего эффекта при турбулентном движении воды, добавленной к определенному объему почвы. В простейшем случае этого эффекта можно достичь встряхиванием вручную почвенной пробы в закрытом сосуде с водой и пропускания полученной суспензии через сито. Имея соответствующее оборудование, можно промывать почвенную пробу струей воды при одновременном встряхивании. Промывную воду затем исследуют на наличие спор возбудителей, а остаток на сите – на наличие покоящихся структур грибов (склероции видов Rhizoctonia, Sclerotinia, Typhula, Botrytis и др.). Частицы почвы на нижнем, самом мелком сите пригодны для выделения мицелия. Исследование промывной воды проводят разными путями: под микроскопом, применяя метод разлива в чашки Петри или готовя ряд последовательных разведений с дальнейшей идентификацией развившихся на питательной среде культур.
Для выделения мицелия частицы почвы раскладывают на поверхность питательной среды в чашках Петри. При этом рекомендуется использовать селективные среды, соответствующие требованиям исследуемого гриба, и добавлять вещества, тормозящие рост бактерий, например хлорамфеникол, тетрациклин, пенициллин, пенициллин и др. Чтобы по возможности уменьшить загрязнение бактериями, рекомендуют промыть частицы почвы водой с ауреомицином (50 мл/л), высушить на стерильной фильтровальной бумаге и лишь затем поместить на агар. Для быстрорастущих грибов, в частности для представителей рода Rhizoctonia, пригодны питательные среды, мало- или не содержащие питательных веществ типа «голодный агар» (2 %-ный водный агар с добавлением антибиотиков). Следует иметь в виду, что некоторые почвенные грибы, например Gaeumannomyces graminis, можно выделить почти исключительно из органических частиц почвы.
Для выделения почвенных фитопатогенов применяют разные методы: прямой подсчет пропагул (спор, склероциев) в почве (Bipolaris sorokiniana, Verticillium dahlial, Rhizoctonia solani, Botrytis cinerea, Sclerotinia sclerotiorum и др.) и косвенные методы – индикаторных растений (Agrobacterium tumefaciens), высев почв на селективные среды (виды р. Fusarium). Широко распространенным методом является определение фитопатологического состояния почвы в условиях теплиц или вегетационных опытов в лаборатории. В этом случае индикаторными растениями служат восприимчивые сорта или культуры. Так, для оценки заселенности почв Aphanomyces cochlioides – возбудителя корнееда сахарной свеклы выращивают в течение 30 дней всходы из здоровых (стерильных) семян сахарной свеклы и с учетом поражения их корнеедом определяют уровень инфекционного потенциала возбудителя в почве. Сходный метод используют для оценки заселенности почв Verticillium albo-atrum – возбудителя трахеомикозного увядания картофеля, земляники, зернобобовых и др. культур.
Метод флотации конидий возбудителя гельминтоспориозной корневой гнили яровой пшеницы, ячменя и др. зерновых культур широко используется в практике сельского хозяйства для составления фитопатологических почвенных картограмм с целью оздоровления почв (рис. 20). Метод основан на использовании различных градиентов плотности для отделения сравнительно крупных спор от частиц почвы. Почву с добавлением вазелинового или вело-машинного масла, к которому иногда примешивают хлопковую синь в качестве красителя, суспендируют в воде или 0,1 %-ном растворе пирофосфата калия. Всплывающий флотатор со спорами при необходимости очищают от загрязнений путем центрифугирования и исследуют под микроскопом.
Рис. 20. Фитопатологическая почвенная картограмма (ФПК) заселенности возбудителем гельминтоспориозной корневой гнили
Условные обозначения фитосанитарного состояния полей:
 – свободные от возбудителя;
– свободные от возбудителя;
 – заселены возбудителем ниже ПВ (менее 15–20 конидий/г почвы);
– заселены возбудителем ниже ПВ (менее 15–20 конидий/г почвы);
 – заселены возбудителем выше ПВ (21–100 конидий/г почвы);
– заселены возбудителем выше ПВ (21–100 конидий/г почвы);
 – заселены возбудителем выше ПВ в высокой степени (выше 100 конидий/г почвы);
– заселены возбудителем выше ПВ в высокой степени (выше 100 конидий/г почвы);
Для определения степени заселенности почв фитопатогенами используют также метод приманки. Части растений (естественная приманка) или какой-либо питательный субстрат (искусственная приманка) помещают на некоторое время в почву. После заселения почвенными грибами приманки служат исходным материалом для изоляции. Этот метод имеет определенные недостатки: во-первых, кроме патогенных, выделяются и непатогенные грибы; во-вторых, приманки заселяются в основном родами и видами с высокой сапротрофной конкурентной способностью (Rhizoctonia, Fusarium). Для обнаружения медленно растущих или узкоспециализированных возбудителей, например Pseudocercosporella herpotrichoides, Plasmodiophora brassicae и Synchytrium endobioticum, метод приманок непригоден. Этих возбудителей удается обнаружить только при возделывании ловчих (индикаторных) растений.
В качестве естественных приманок пригодны стебли гречихи – для Rhizoctonia solani, кусочки картофеля и огурца – для видов Pythium, незрелые яблоки – для Phytophthora cactorum. Искусственной приманкой могут служить перфорированные стеклянные пробирки, заполненные питательной средой, или пластинки размером 20 х 30 см с 60–70 лунками диаметром 0,5 и глубиной 1,0 см, заполненными агаром и покрытыми перфорированной клейкой пленкой. Для этого же пригодны диски фильтровальной бумаги или куски поролона, пропитанные питательным раствором и помещенные в перфорированную оболочку. Возбудителей выделяют на питательный субстрат в пробирках или чашках Петри.
Узкоспециализированные формы патогенов можно обнаружить методом возделывания ловчих растений. Иногда при этом удается определить отдельных возбудителей, в частности спороносящих на ловчем растении. Во всяком случае, таким способом выделить возбудителя болезни проще, чем из почвы. Недостатками по сравнению с другими методами является, как правило, значительно большая затрата времени, обусловленная длительностью периода от высева семян или высадки растений до появления симптомов, а также зависимость поражения от окружающих условий, особенно от погоды и восприимчивости ловчих растений. Наиболее известный пример ловчего растения – белая горчица (Sinapis alba) для обнаружения в почве Plasmodiophora brassicae.
Неотъемлемой частью фитосанитарного мониторинга почвы служит определение ее фитотоксичности, которая обусловлена биотическими факторами (фитопатогены, почвенная биота, семена сорных растений) и абиотическими (разложение растительных остатков, остатки пестицидов, тяжелых металлов и др.). Для определения фитотоксичности почвы в нашей стране и за рубежом широко используется метод биотеста. Этот метод основан на высеве здоровых (стерильных) семян растений-индикаторов в лабораторных или полевых условиях. Срок выращивания их от 12 до 30 дней.
В качестве биотеста используют всходы из семян редиса различных сортов: Красный с белым кончиком, Рубин, Заря, Бело-розовый, Вариант. Семена редиса отличаются от семян других культур, которые также используются для биотеста (пшеница, рожь, овес, ячмень, кукуруза, горох), высокой энергией прорастания и повышенной чувствительностью к токсичным веществам.
Метод отличается простотой, высокой производительностью, быстротой определения и дает возможность проведения массовых анализов почвы.
Показателем суммарной токсичности является уменьшение длины корней проростков редиса по отношению к контролю, выраженному в процентах. Токсичность считается достоверной при снижении длины корней в опытном образце почвы на 20 % и более.
В качестве контроля берут почву определяемого типа с целинных и залежных участков, где в процессе эволюции сложилось равновесие в биоценозах полезных и вредных видов и где антропогенное влияние, связанное с применением пестицидов, внесением тяжелых металлов ограничено или отсутствует.
Параллельно с фитотоксичностью почвы, определяют при необходимости ее супрессивность и общую биологическую активность.
Фитофагов, обитающих в почве, учитывают методом раскопок на площадках. В зависимости от особенностей биоэкологи вида или фазы его развития применяют мелкие (до 10 см), средние (0–20 см) и глубокие (40 см и более) раскопки. При этом учитывают не только фитофагов, жизненный цикл которых адаптирован преимущественно к почве (проволочники, личинки пластинчатоусых жуков, медведки и др.), но и фитофагов из экологической группы наземно-воздушных, или листо-стеблевых. В последнем случае почва служит главным образом местом перезимовки фитофагов в фазе куколок, кубышек, коконов, и эти фазы, как правило, находятся в верхних слоях почвы (кубышки саранчовых, коконы лугового мотылька, гороховой плодожорки, куколки минирующих молей, плодовых мух и др.). В случае учета почвенных вредных организмов глубина раскопок составляет не менее глубины пахотного горизонта. Раскопки проводят в теплый период (июнь-август) при достаточной влажности почвы, когда фитофаги держатся в верхних слоях почвы и еще не начата их миграция в более глубокие слои. В противном случае глубина раскопки увеличивается до 40 см. Для обнаружения личинок свекловичных долгоносиков глубина раскопок достигает 65 см – 1 м.
Размер раскапываемых площадок 0,5 м2 (25 х 20 см) или 0,25 м2 (50 х 50 см). Количество площадок при массовом мониторинге почвенных фитофагов составляет 4–6 на каждом поле. При этом на поле должен быть один предшественник, единая система применения удобрений и обработки почвы, один сорт. Если поле разбито на участки по тем или иным причинам, учеты проводят на каждом участке, отступая 20 м от его края.
Выборку насекомых производят вручную с помощью переборки почвы на брезенте (палатке), или просеивания (если сухая почва) или промывания. Найденных насекомых помещают в банки с крепким раствором поваренной соли.
Численность фитофагов рассчитывают на 1 м2 и сравнивают с показателями ЭПВ по каждой культуре (см. последующие главы). Так, до посадки картофеля численность проволочников (ЭПВ) не должна превышать 5–10 экз./м2, а личинок пластинчатоусых жуков (майский, июньский хрущ) – 3–5 личинок/м2.
Характерной особенностью многолетних сорняков (бодяк полевой, вьюнок полевой, пырей ползучий и др.) является пространственное распределение их куртинами с огромным накоплением в почве органов вегетативного размножения. Учет сорняков с тонкими корневищами (пырей ползучий, свинорой, тысячелистник обыкновенный и др.) проводят на площадках размером 0,25 м2; с толстыми корневищами (бодяк полевой, осот полевой, гумай и др.) – 0,5 м2. При равномерном засорении поля или участка достаточно 8–10 площадок в различных местах. Каждую площадку окапывают канавкой на глубину 35 см, затем подрезают пласт, осторожно вынимают его, и помещают на брезентовую палатку или полиэтиленовую пленку. Почву разминают руками, выбирают подземные вегетативные органы сорняков, распределяя их на молодые (белые), старые (желтые) и отмершие (коричневые), а затем рассчитывают общее количество на 1 м2. Учет надземной массы сорняков проводят отдельно.
При распределении многолетних сорняков по полю куртинами, надо нанести их площади на картограмму полей севооборота с целью локального применения способов (механического, химического) их уничтожения. Степень покрытия полей многолетними сорняками не должна превышать 5 %.
Решающая роль в прогнозе численности многолетних сорняков принадлежит определению сроков их появления на каждом поле.
Особенно благоприятные условия для массового размножения многолетних сорняков (бодяка полевого, осота полевого, вьюнка полевого) складываются при выпадении обильных осадков во второй половине лета и осенью. Еще до уборки урожая зерновых культур в агроэценозах происходит формирование молодых органов вегетативного размножения – горизонтальных и вертикальных корней. После уборки (в конце августа и сентябре) происходит интенсивное накопление запасных питательных веществ. В этот период общая масса подземных органов (корней, корнеотпрысков) удваивается, а содержание в них запасных веществ увеличивается в 2–3 раза. Семенное поколение корнеотпрысковых сорняков до уборки урожая развито слабо, особенно в густых посевах зерновых культур и кукурузы. После уборки всходы из семян также интенсивно наращивают вегетативную массу, их корневая система быстро увеличивается в длину и толщину. Это один из самых благоприятных периодов борьбы с многолетними сорняками, которая должна проводиться по результатам ранней их диагностики. При углублении корневой системы, например, осота желтого, более 1,5 м борьба с многолетними сорняками требует значительно больше затрат и менее эффективна.
|
По результатам мониторинга численности подземных и надземных побегов, корней и корнеотпрысков, их численности на 1 м2 и общей засоренности поля, производится сравнение с ЭПВ и планируется система ИЗР. |
Экономические пороги вредоносности многолетних сорняков, в отличие от малолетних, определяют по количеству не растений, а побегов (плетей) на 1 м2: пырея ползучего 3–6, осота полевого 2–4, бодяка щетинистого 1–3, вьюнка полевого 5–8.
При разработке систем ИЗР с сорняками, как правило, нет различий между порогами вредоносности и порогами борьбы, так как после определения засоренности уже не происходит больших изменений плотности. Поэтому пороги борьбы соответствуют порогам вредоносности. Основой их является «отрицательный прогноз», то есть та засоренность (плотность сорняков или степень покрытия), ниже которой не ожидается экономического вреда. Для определения порога вредоносности требуется, как и при определении таких порогов для болезней и вредителей, знание соотношения между засоренностью и снижением урожайности (биологический порог вредоносности или ПВ). На примере лисохвоста полевого (Alopecurus myosuroides) и озимой пшеницы такое соотношение показано на рис. 21.
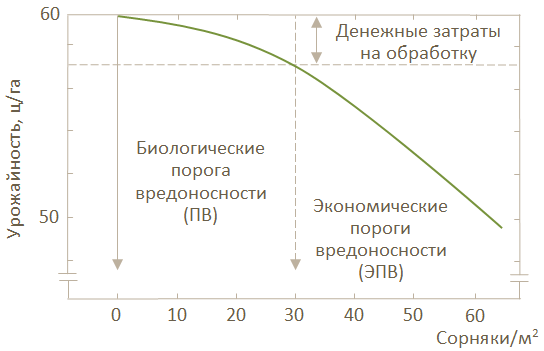
Рис. 21. Соотношение между засоренностью посевов лисохвостом полевым и снижением урожайности озимой пшеницы
Биологический порог вредоносности (ПВ) по всем экологическим группам вредных организмов ниже, чем ЭПВ. Он более стабилен, не зависит от конъюнктуры рынка, а поэтому более надежен для принятия решений о необходимости разработки и применения систем ИЗР.
 Экологические основы интегрированной защиты растений: учебник
Экологические основы интегрированной защиты растений: учебник

 ЭКОЛОГИЧЕСКИЕ ОСНОВЫ ИНТЕГРИРОВАННОЙ ЗАЩИТЫ РАСТЕНИЙ
ЭКОЛОГИЧЕСКИЕ ОСНОВЫ ИНТЕГРИРОВАННОЙ ЗАЩИТЫ РАСТЕНИЙ

 ГЛАВА 1. ПОНЯТИЕ О СИСТЕМАХ ИНТЕГРИРОВАННОЙ ЗАЩИТЫ РАСТЕНИЙ
ГЛАВА 1. ПОНЯТИЕ О СИСТЕМАХ ИНТЕГРИРОВАННОЙ ЗАЩИТЫ РАСТЕНИЙ