Тема 3
ТИТРИМЕТРИЧЕСКИЙ (ОБЪЕМНЫЙ) МЕТОД АНАЛИЗА
Студент должен знать, как установить момент эквивалентности при взаимодействии растворов веществ; количественно определить азот при использовании метода Кьельдаля; уметь определить количество хлоридов методом осадительного титрования.
Сущность титриметрического анализа заключается в установлении момента эквивалентности при взаимодействии растворов веществ. Момент эквивалентности может быть зафиксирован визуально или инструментально, с введением индикатора или без него. При концентрациях реагирующих веществ, близких к точке эквивалентности, индикатор изменяет свою окраску.
В титриметрическом анализе используют растворы-титранты, титр которых точно известен.
Методы окисления – восстановления основаны на окислительно-восстановительных реакциях (перманганатометрия, йодометрия, хроматометрия). Точка эквивалентности определяется по изменению окраски либо самого раствора, либо редокс - индикатора.
При кислотно-основном титровании, определив объем (Vт) реагента титранта известной концентрации (Ст), рассчитывают концентрацию определяемого компонента (Сх) в определенном объеме (Vх) по формуле
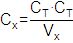
Методом осадительного титрования определяют элемент, который, взаимодействуя с титрованным раствором, может осаждаться в виде малорастворимого соединения.
При титрометрии играет роль и произведение растворимости образующегося вещества.
При этом изменяются свойства среды, что позволяет установить точку эквивалентности.
Методом комплексообразования определяют катионы и анионы, которые обладают способностью образовывать малодиссоциированные комплексные ионы.
Если 10,0 мл 0,1н. раствора хлорида натрия титровать 0,1н. раствором нитрата серебра, то до начала титрования концентрация хлорид-ионов в растворе равна общей концентрации хлорида натрия, т.е. 0,1 моль/л или [ Cl-] = 10–1.
Обозначив логарифм концентрации (или активности) определяемых хлорид-ионов через р - функцию, можно написать:
РCl = -lg[ Cl-] = -lg10–1 = 1.
Когда к титруемому раствору хлорида натрия будет прибавлено 9,00 мл раствора нитрата серебра и 90% хлорид-ионов будут осаждены, концентрация их в растворе уменьшится в 10 раз и станет равна 1·10–2 моль/л, а РCl будет равна 2.
Поскольку ПР AgCl = 10–10, концентрация ионов серебра при этом составит:
[Ag+] = 10–10/ [ Cl-] = 10–10/ 10–2 = 10–8 моль/л,
или
РAg = -lg[Ag+] = -lg 10–8 = 8.
Аналогично вычисляют все остальные точки для построения кривой титрования.
В точке эквивалентности РCl = РAg ~ 5 (табл. 5).
Таблица 5
Изменение РCl и Р Ag при титровании 10,00 мл 0,1н. раствора хлорида натрия 0,1н.
раствором нитрата серебра
|
Прибавлено раствора AgNO3, мл |
[ Cl-] |
[Ag+] |
РCl |
РAg |
|
0 |
10-1 |
- |
1 |
- |
|
9,00 |
10-2 |
10-8 |
2 |
8 |
|
9,90 |
10-3 |
10-7 |
3 |
7 |
|
9,99 |
10-4 |
10-6 |
4 |
6 |
|
10,00 (точка экв.) |
10-5 |
10-5 |
5 |
5 } скачок |
|
10,01 |
10-6 |
10-4 |
6 |
4 |
|
10,10 |
10-7 |
10-3 |
7 |
3 |
|
11,00 |
10-8 |
10-2 |
8 |
2 |
|
20,00 |
10-9 |
10-1 |
9 |
1 |
При РAg от 6 до 4 возможно фиксирование конечной точки аргентометрического титрования с помощью индикатора. Интервал скачка при аргентометрическом титровании зависит от концентрации растворов и от произведения растворимости осадка. Чем меньше величина ПР получающегося в результате титрования соединения, тем шире интервал скачка на кривой титрования и тем легче фиксировать конечную точку титрования с помощью индикатора.
Наиболее распространено аргентометрическое определение хлора по методу Мора. Сущность его состоит в прямом титровании вытяжки или воды раствором нитрата серебра с индикатором хроматом калия до побурения белого осадка.
Индикатор в методе Мора – раствор K2CrO4, который дает с нитратом серебра красный осадок хромата серебра Ag2CrO4, но растворимость осадка (0,65·10–4 моль/л) гораздо больше растворимости хлорида серебра (1,25·10–5 моль/л). Поэтому при титровании раствором нитрата серебра в присутствии хромата калия красный осадок хромата серебра появляется лишь после добавления избытка ионов Ag+, когда все хлорид–ионы уже осаждены.
|
- Работа 3.1. Определение количества хлоридов методом осадительного титрования - Работа 3.2. Определение общей (титруемой) кислотности плодов и овощей - Работа 3.3. Определение содержания 2,4 - дихлорфеноксиуксусной кислоты в препарате гербицида - Работа 3.4. Определение азота в органических веществах по Кьельдалю |