Работа 3.4
Определение азота в органических веществах по Кьельдалю
Оборудование и реактивы: колбы Кьельдаля, промывалка, алонж, колба, воронка, каплеуловитель, холодильник, колба для отгонки аммиака, приемник, нагреватель для отгонки аммиака, концентрированная серная кислота (пл. 1,84 г/см3), сульфат меди CuSO4, сульфат калия K2SО4, 0,1н. раствор серной кислоты, метиловый оранжевый (или метиловый красный), 0,1н. раствор гидроксида натрия (или калия).
Принцип метода. Метод основан на количественном определении аммония, образующегося при озолении органического вещества в серно-кислой среде. Образующийся при этом оксид углерода (IV) улетучивается, а азот переходит в сульфат аммония (NH4)2SО4. Аммонийную соль разлагают щелочью при нагревании:
(NH4)2SО4 + 2NaOH = Na2SO4 + 2NH3↑ + 2H2О.
Аммиак отгоняют в приемник, где он поглощается определенным объемом титрованного раствора серной кислоты:
2NH3 + H2SO4 = (NH4)2SО4.
Остаток непрореагировавшей серной кислоты оттитровывают раствором гидроксида натрия (или калия) в присутствии метилового оранжевого (или метилового красного). По количеству связанной аммиаком серной кислоты вычисляют содержание азота.
Ход определения. Точную навеску воздушно - сухого растительного материала (от 0,5 до 2,0 г) переносят в колбу Кьельдаля вместимостью 250 мл для сжигания. Приливают 20-25 мл концентрированной серной кислоты, стараясь смыть приставшие к стенкам колбы частицы. Добавляют туда же 1 г сульфата меди CuSO4, играющего роль катализатора, и 5 г сульфата калия K2SО4 для повышения температуры кипения и ускорения процесса окисления.
Колбу закрывают воронкой и помещают на газовую горелку или электрический нагреватель. Органические вещества сжигают сначала при слабой температуре. Когда вспучивание жидкости прекратится, усиливают нагревание и доводят содержимое колбы до кипения. Колбу все время держат в наклонном положении, чтобы пары серной кислоты конденсировались и кислота стекала вниз (рис. 3).
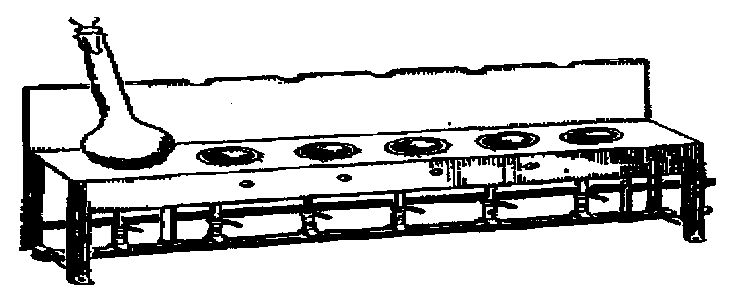
Рис. 3. Сжигание органического вещества в колбе Кьельдаля
Когда окраска раствора из темно-бурой перейдет в прозрачно-голубую (без желто-зеленого оттенка), кипячение прекращают. Дают раствору остыть, добавляют немного воды, взбалтывают и переливают жидкость в отгоночную колбу прибора для отгонки аммиака. В зависимости от возможности отгоночные приборы могут отличаться модификационно (рис. 4, 5).
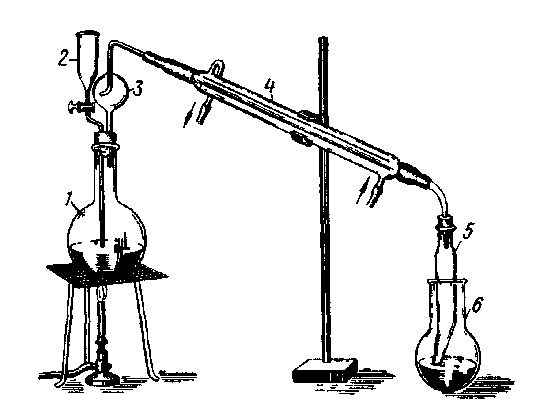
Рис. 4. Прибор для отгонки аммиака:
1 - колба для отгонки аммиака; 2 - воронка; 3 - каплеуловитель; 4 - холодильник; 5 - алонж; 6 - приемник
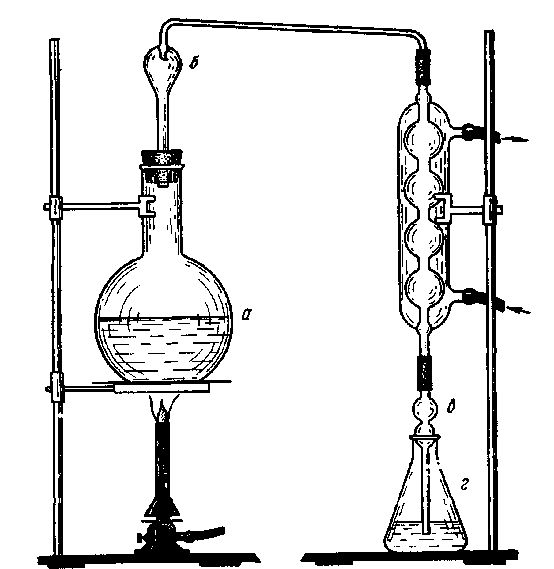
Рис. 5. Прибор для отгонки аммиака:
а - отгонная колба; б - каплеуловитель; в - алонж; г - приемник.
С помощью промывалки ополаскивают колбу Кьельдаля 3-4 раза небольшими порциями воды, каждый раз сливая воду в отгонную колбу прибора, т.е. либо в колбу (1), либо в колбу α, в зависимости от модификации прибора.
Затем присоединяют отгонную колбу к холодильнику через каплеуловитель и, пользуясь воронкой, приливают 100 мл раствора с массовой долей гидроксида натрия (или калия) 50% для вытеснения аммиака из соли.
В приемник прибора отмеривают 40-50 мл 0,1н. раствора серной кислоты, прибавляют 2-3 капли метилового оранжевого (или метилового красного). Конец алонжа должен быть погружен в титрованный раствор серной кислоты.
Постепенно нагревая колбу, отгоняют аммиак. Отогнав не менее 2/3 первоначального объема жидкости, конец алонжа вынимают из раствора серной кислоты, обмывают дистиллированной водой над приемником и делают пробу на полноту отгонки аммиака. Для этого каплю жидкости, вытекающей из холодильника, наносят на красную лакмусовую бумажку. Если она не посинеет, отгонку прекращают.
Остаток несвязанной серной кислоты оттитровывают в приемнике 0,1 н. раствором гидроксида натрия (или калия) до перехода розовой окраски метилового оранжевого (или метилового красного) в желтую.
Массовую долю (%) азота в воздушно-сухом материале вычисляют по формуле
![]()
где V (H2SQ4) - объем 0,1 н. раствора H2SO4, взятый для поглощения NН3, мл;
V (NaOH) - объем 0,1н. раствора NaOH (или КОН), пошедший на обратное титрование Н2SО4, мл;
m - навеска воздушно-сухого материала, г;
0,014 - коэффициент для пересчета H2SO4 на азот.