
3.2. Стандартизация биопрепаратов и оценка их качества
Все биопрепараты для защиты растений должны быть стандартизованы, т.е. иметь вполне определенные показатели качества.
Основные показатели стандартизации зависят как от активности исходного штамма, так и от препаративной формы биопестицидов. Препаративная форма тесно связана с технологией применения биопрепаратов и со сроком их хранения.
Для создания оптимальной препаративной формы микробиологических пестицидов необходимо решить ряд проблем, обеспечивающих:
1) стабильность препарата при хранении и применении;
2) прилипаемость к поверхности растений и растекаемость;
3) защиту от УФ-излучения;
4) активирование микроорганизма-продуцента.
Проблема стабильности микробиологических препаратов актуальна, например, из-за необходимости накопления резервных запасов биопрепаратов. Предложена молекулярно-биологическая концепция быстрой утраты активности биопрепаратами. Суть ее в том, что в процессе хранения происходит взаимодействие кислорода воздуха с компонентами поверхностных макромолекул. Взаимодействие биологических систем с кислородом наиболее полно описывается через механизм свободно-радикального окисления макромолекул. Так, для бактериальных препаратов поверхность спор и кристаллов представляют белки и полисахариды. Поэтому механизм их взаимодействия с кислородом подчиняется основным законам свободно-радикального процесса, идущего через образование осколков молекул - свободных радикалов. Характерной чертой такого процесса является возможность управлять им с помощью инициаторов или ингибиторов свободных радикалов. Накопление свободных радикалов вредно влияет на жизнедеятельность организмов. В связи с этим было показано, что снижение активности бактериальных препаратов объясняется образованием свободных радикалов. Этот процесс тормозится при введении антиоксидантов в малых концентрациях. В реальных условиях хранения препараты, смешанные с антиоксидантами, значительно меньше снижали свою активность, чем контрольные. Этот подход оказался перспективным в отношении бактериальных, вирусных и грибных препаратов.
Главная причина инактивации препаратов в полевых условиях - разрушительное действие УФ-излучения. Защитный экранирующий эффект на микроорганизмы оказывают активированный уголь, окись титана, яичный альбумин и т.д. В этих целях перспективно также микроинкапсулирование. Инкапсулированные препараты очень устойчивы к облучению. Кроме того, значительно увеличивается удерживаемость препарата на поверхности растения за счет адгезионных свойств оболочки.
Концепция использования антиоксидантов в биопрепаратах оказалась плодотворной и в решении вопроса защиты патогена от УФ-облучения. Показано, что бактериальные и вирусные препараты, содержащие антиоксиданты, хорошо противостоят УФ-облучению.
Наконец, одним из компонентов препаративной формы желательно иметь такой, который бы способствовал наилучшему проявлению инсектицидной активности патогена. Это возможно при знании механизмов взаимодействия макро- и микроорганизмов. Например, при разработке препарата ЛЕСТ каолин как наполнитель первой препаративной формы лепидоцида был полностью заменен на водорастворимый компонент, способствующий усилению инсектицидности эндотоксина. Это обеспечило снижение нормы расхода препарата. Против непарного шелкопряда норма расхода ЛЕСТ вдвое меньше, чем лепидоцида, который был взят как стандарт.
Естественно, что любой новый ингредиент должен быть не токсичным как для патогена, так и для окружающей среды.
Стандартизация. Стандартизация биопрепаратов проводится по числу спор, включений, метаболитов и по биологической активности. Последний показатель более значим. При этом надо иметь в виду, что биологическая активность биопрепаратов отличается от активности штаммов-продуцентов, поскольку в препаративные формы включены различные ингредиенты.
Количество жизнеспособных спор в 1 г препарата определяют методом посева на питательные среды с последующим подсчетом выросших колоний. Для посева используют разведение препарата, обеспечивающее рост не более 300 и не менее 50 колоний в одной чашке Петри. Разведение определяют делением предполагаемого титра на 300 и 50. Выросшие колонии подсчитывают при открытой чашке Петри. Титр препарата определяют по формуле:
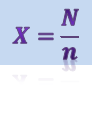
где N - среднеарифметическое число колоний из двух серий параллельных разведений;
n - максимальное разведение.
Содержание β-эндотоксина также можно измерить по УФ-спектрам при длине волны, равной 280 нм, или иммуноферментным анализом.
Полиэдры или гранулы подсчитывают в камере Горяева в световом микроскопе, но гранулы предпочтительнее считать на сеточке в электронном микроскопе из-за их мелких размеров. Подсчет вирионов осуществляют в электронном микроскопе.
Количество антибиотика или БАВ в препаратах против болезней растений определяют хроматографией или цветными реакциями с последующим фотометрированием.
Как уже отмечалось, самый главный показатель в стандартизации и оценке качества биопрепарата - его биологическая активность. Биологическая активность измеряется реакцией тест-объекта на действие биоинсектицида. В качестве тест-объектов могут использоваться насекомые либо фитопатогены.
Для определения биологической активности препаратов с целью сравнения используются стандарты, т.е. образцы микроорганизма-продуцента или биопрепарата, отвечающие всем необходимым условиям и требованиям. Требования к стандартам описаны в пособии по биопрепаратам.
При использовании стандартов биологическая активность испытуемого образца (препарата) выражается в ЛК50 (средней летальной концентрации) или в других единицах.
Важнейшей частью проблемы стандартизации биопрепаратов является выбор тест-объектов. Для бактериальных энтомопатогенных препаратов необходимые требования к тест-объектам следующие:
1) тест-объекты не должны быть карантинными вредителями;
2) должны легко разводиться в лабораториях;
3) регулярно восполняться при сборах в природе.
Тест-объекты разводят на искусственных питательных средах.
В последние годы предложен ряд косвенных методов оценки качества энтомопатогенных препаратов БТ. К ним относятся, например, методы определения инсектицидности по активности ферментов (эстеразы, альдолазы, АТФазы) и др.
Эстеразы считаются наиболее реактивной группой ферментов, которые показывают значительное отклонение активности от нормы при введении насекомым токсинов БТ. Уже в первые часы после введения токсина наблюдается изменение активности ферментов, что является особенно важным для создания экспресс-метода. Способ, предложенный сотрудниками ВНИИ прикладной микробиологии, позволяет сократить время до 5 часов, однако он применим только в отношении тест-объекта - гусениц большой пчелиной огневки, в кишечнике которых сосредоточено 95,8% всей эстеразной активности. Установлена прямо пропорциональная зависимость между ЛК50 и эстеразной активностью. Искомую величину ЛК50 находят на калибровочном графике, начальную скорость реакции взаимодействия субстрата и фермента измеряют на флуориметре. По оси ординат откладывают интенсивность флуоресценции, по оси абцисс - время реакции. Активность определяют по калибровочной кривой соответствия ЛК50 начальной скорости эстеразной реакции.
Подобные способы предложены и для оценки энтомоцидности препаратов по активности Mg-зависимой АТФазы или S-трансферазы кишечников гусениц. Они не требуют большого количества насекомых.
Грибные препараты, как и бактериальные, оценивают по числу жизнеспособных спор и биологической активности. Для оценки изолятов гриба L.lecanii по отношению к трем видам тлей: персиковой, бахчевой и цитрусовой - предложен метод отдельного листа. Обработанных конидиями тлей помещают на отдельные листья растений, которые располагают на поверхности 1%-го водного агара для инкубации патогена. При этом обработку тли проводят погружением или опрыскиванием суспензией конидий. Учитывают процент погибших насекомых. Для стандартизации боверина тест-объектами служат капустная белянка, пчелиная огневка, колорадский жук, комнатная муха. Для пириформина - гороховая, бахчевая, оранжерейная тли, обыкновенный паутинный клещ. Для вертициллина - бахчевая тля, белокрылка, гороховая тля, пчелиная огневка.
Разные группы препаратов, характеризующихся различным путем заражения и характером действия, нельзя оценивать по одному стандарту. |
Для препарата микоафидин-Т, состоящего преимущественно из токсина энтомофторового гриба, применяют экспресс-анализ, занимающий около 2 ч. Для этого кружок фильтровальной бумаги пропитывают суспензией препарата, высаживают на него тлю в чашки Петри и определяют гибель этого тест-объекта через 2 ч.
Тест-объект для бактороденцида - лабораторные или здоровые дикие мыши массой 16-20 г, прошедшие карантин в течение 14 суток. Каждую мышь помещают в отдельную стерильную банку с крышкой из металлической сетки и скармливают ей по 0,5 г бактороденцида зернового или 0,3 г аминокостного, смешанного с мукой. Контрольных мышей (5 особей) кормят тестом из муки. Грызунов содержат в банках в течение 18 ч. Затем опытных мышей (10 особей) помещают в террариум и следят за их гибелью в течение 14 суток. Препарат считается биологически активным, если за это время гибнет не менее 90% особей.
Процент гибели мышей (Х) высчитывают по формуле:
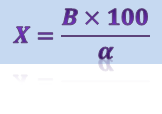
где В - количество погибших;
α - количество зараженных особей.
Стандартизацию биопрепаратов против болезней растений проводят по оценке антагонистических или антибиотических свойств штамма-продуцента на тест-объекте (фитопатогенном микроорганизме).
Количественную оценку антибиотической активности биопрепарата можно проводить, например, методом диффузии в агар с использованием лунок. В одну лунку вносится суспензия патогена, в другую - биопрепарата. Количественная оценка проводится по радиусу зоны ингибирования роста фитопатогена. Количество антибиотика можно определить также инструментальными методами анализа (спектрометрия, хроматография), как упоминалось выше.

