|
2.2.
Разведение насекомых и клещей как объектов биотехнологии в защите растений Биологические методы защиты растений от вредных насекомых
требуют разработки способов накопления либо фитофагов, либо энтомофагов, что
относится к технической энтомологии. Рассмотрим практическое применение принципов технической
энтомологии. Для подавления вредных насекомых в открытом и защищенном грунте
используют выпуски искусственно разводимых энтомофагов. Уровни их культивирования
могут быть лабораторными, лабораторно-полевыми или массовыми (промышленными).
Разведение осуществляется в технобиоценозе на
естественном или искусственном корме. ИПС, как правило, полусинтетические.
Стартовую колонию выбирают преимущественно в зоне пессимума. Биотехнология разведения энтомофагов
своей продукцией имеет работающую культуру. Разведение насекомых основано на принципе триотрофа (кормовое
растение -
фитофаг (консумент 1-го порядка) - энтомофаг (консумент
2-го порядка) (рис. 2.3).
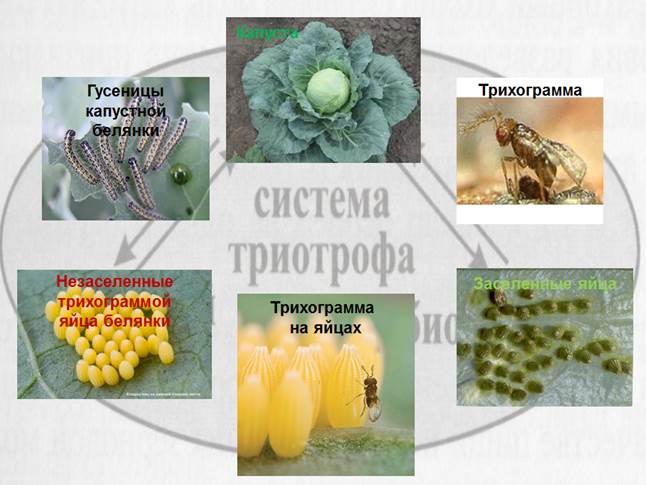
Рисунок 2.3. Система триотрофа Методики разведения насекомых Трихограмма (рис.
2.4).В нашей стране, как и во всем мире, для выпуска в открытом грунте чаще
всего применяют яйцееда — трихограмму. Поэтому для
данного энтомофага хорошо изучены условия его массового производства. В
отношении трихограммы разработан интегрированный
показатель целевого назначения культуры.
Рисунок 2.4. Трихограмма Предложен обобщенный критерий качества трихограммы,
включающий следующие частные показатели: процент отрождения
имаго, половой индекс, плодовитость и поисковую способность. Экспериментально
найдена линейная зависимость между ожидаемой биологической эффективностью
энтомофага Е и его обобщенным критерием
качества Д:
На культуры трихограммы
обычно составляют паспорт, включающий: 1) обозначение штамма
культуры вида трихограммы, например, Тrichogramma evanescens West. (Hymenoptera: Trichogrammatidae); 2) происхождение культуры; 3) лабораторный хозяин (зерновая моль, капустная совка и т.д.); 4) условия разведения и биологические
признаки паразита (трихограммы), включающие
температуру, влажность, освещенность, аэрацию, длительность развития, тип
паразита (эндо-, эктопаразит и т.д.), число особей на одного паразита,
процент самок в популяции и т.д. Трихограмму (T. evanescens), как консумента 2-го порядка, разводят в производственных
биолабораториях или
на биофабриках, в качестве пищи используют яйца
зерновой моли (ситотроги). Ситотрога
- это консумент 1-го порядка. Кормовой субстрат - зерно. Наиболее
трудоемкие процессы производства трихограммы
механизированы. Механизированная линия
обеспечивает получение около 2 млрд особей паразита
за сезон, что хватает на разовый выпуск примерно на 30-40 тыс. га. Для эффективного подавления массового размножения вредителя
большое значение имеет качество разводимой трихограммы,
которое зависит как от исходной культуры, так и от строгого соблюдения режима
микроклимата при разведении, качества яиц зерновой моли, числа поколений паразита,
пассируемого через них. Для обогащения генофонда исходной популяции и получения эффекта
гетерозиса рекомендуется проводить следующие мероприятия: ● сбор
в природе большого числа (не менее 1500) яиц насекомых, паразитированных
трихограммой (стартовая
колония); ●
накопление трихограммы на маточном участке (0,5-1
га), расположенном на территории биофабрики. Этот
участок ежегодно засевают сельскохозяйственными культурами с различными
сроками созревания, которые искусственно заселяют фитофагами из отряда чешуекрылых и трихограммой. По
периметру участок засевают нектароносами (например, горчицей); ● сбор
с маточного участка кладок яиц, заселенных трихограммой,
в августе-сентябре, выведение паразита, проведение двух осенних пассажей
через яйца хозяев из расчета 1 самка на 10 яиц и введение трихограммы
в диапаузу для длительного хранения; ●
реактивация диапазирующей трихограммы
(выведение из диапаузы) и групповое скрещивание; ●
массовое разведение трихограммы с таким расчетом,
чтобы в яйцах зерновой моли проходило не более 3-4 поколений трихограммы. Работа по обновлению и накоплению маточного материала должна
сопровождаться таксономическим контролем видовой принадлежности трихограммы и оценкой ее качества. Для повышения
плодовитости и продолжительности жизни исходной популяции трихограммы
ее следует подкармливать медом или 20%-м сахарным сиропом. Сначала разводят фитофага. Зерновую моль как
субстрат питания трихограммы разводят следующим
образом: обеззараживают зерно ячменя термическим (в автоклавах) или
химическим (фумигация метилбромидом) способами.
Влажное термическое обеззараживание предпочтительнее, так как зерно
размягчается, что благоприятствует внедрению и развитию гусениц фитофага.
Такое обеззараживание можно провести путем погружения зерна в горячую воду
при 90-95°С на 1 мин. Предварительно в воду
добавляют марганцово-кислый калий (1 г на 10 л воды), чтобы предотвратить
появление плесени. Обеззараженное зерно рассыпают в кюветы слоем не более 4 см и в
течение 1-2 дней доводят до оптимальной (16%) влажности, поддерживая ее в
течение всего периода развития зерновой моли. Влажность зерна определяют
влагомером. Для заселения зерна используют яйца зерновой моли, отложенные
бабочками на 2-3-й
день жизни, причем возраст всей партии не должен отличаться более чем на
сутки. Яйца помещают в термостат при 23-25°С и
относительной влажности воздуха 85% на 4-5 суток. Подготовленные таким
образом яйца рассыпают тонким слоем на поверхности зерна из расчета 1 г яиц
на 1 кг зерна. Выходящие из яиц гусеницы зерновой моли (ситотроги)
внедряются в зерно. Этот процесс завершается за 4-5 суток. После этого зерно
перемешивают и поддерживают температуру 20±2°С и
влажность 80±5%. Ожидают, когда пройдет цикл развития ситотроги
до бабочки. Через 2-3 дня после начала лета первых бабочек зерно пересыпают
в кассеты, устанавливая их в боксы. В одном боксе размещают 10 кассет по
13-15 кг зерна. Массовый лет бабочек начинается через 3-5 дней после загрузки
кассет и продолжается в течение 15-18 дней. Выходящие из зерна бабочки через
перфорацию кассет проникают в бокс 3
(рис. 2.5), скапливаются в его конической части и через открываемый клапан
попадают в общий насекомопровод
4. Отсюда они воздушным потоком переносятся в молеприемник
6.
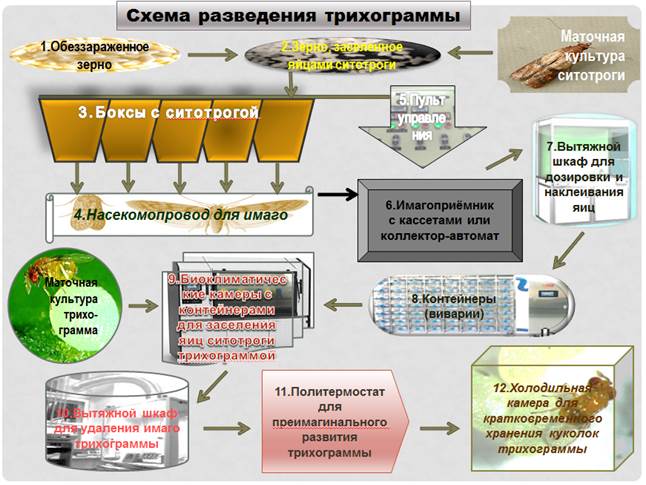
Рисунок 2.5. Схема разведения трихограммы: 1 - обеззараженное зерно; 2 - зерно, заселенное яйцами ситотроги; 3 - боксы с ситотрогой; 4 - насекомопровод; 5 - пульт управления; 6 - имагоприемник с кассетами или коллектор-автомат; 7 - вытяжной шкаф для дозировки и наклеивания яиц; 8 - контейнеры (виварии); 9 - биоклиматические камеры с
контейнерами для заселения яиц ситотроги трихограммой; 10 Вытяжной шкаф для удаления
имаго трихограммы; 11 - политермостат для преимагинального развития трихограммы;
12 - холодильная камера для кратковременного хранения куколок трихограммы. Бабочек собирают один раз в сутки, дозатором расфасовывают в
вытяжном шкафу 7 в малые контейнеры и
помещают на 4-5 суток в ячеистый термостат для откладки яиц. Собранные яйца
очищают от примесей, расфасовывают в бумажные пакеты и хранят. Средний выход
яиц зерновой моли на биофабриках составляет
600 г со 100 кг зерна при длительности цикла сбора бабочек и яиц с одной
партии заселенного зерна 34-45 дней и степени заселения зерна около 75%. Кратковременное хранение яиц зерновой моли при 1-3°С и влажности 85-90% для партии, предназначенной к
воспроизводству, - не
более 3-4 суток, для заселения трихограммой - не более 10 суток. Для
долгосрочного хранения, необходимого при круглогодичной работе, разработан
способ глубокого охлаждения яиц при температуре жидкого азота (-196°С). После
6-12 месяцев хранения яйца размораживают в воде (44-45°С), высушивают и
используют. Заселение яиц фитофага трихограммой.
Пластины помещают в контейнеры (8), которые затем ставят в климокамеры (9) для заселения яиц трихограммой.
Заселение проводят из расчета 1 самка паразита на 20 яиц ситотроги.
После заселения яиц паразитом виварии с пластинами ставят в вытяжной шкаф для
удаления имаго трихограммы (10), а затем помещают
политермостат (11) для преимагигального развития
энтомофага (до почернения яиц фитофага, что соответствует фазе предкуколки паразита). После почернения яиц, их
расфасовывают в пакеты для реализации или в кассеты для хранения (12).
Обычно в 1 г содержится 80 тыс. яиц, паразитированных
трихограммой (80%-е заселение). Следует иметь в виду, что обобщенный критерий качества трихограммы при разведении на яйцах капустной совки
вдвое выше, чем при разведении на яйцах мельничной огневки. Поэтому для маломасштабного
разведения в лабораторных условиях лучше выбирать в качестве хозяина
капустную совку. В последнее время наблюдается также переход на разведение трихограммы с использованием в качестве субстрата
искусственных яиц -
питательной среды, заключенной в гелеобразную растворимую оболочку.
Примером лабораторно-полевой культуры может
служить гербифаг - муха-фитомиза (Phytomyza orobanchia,
Diptera: Agromysidae),
которую используют для борьбы с сорняком заразихой. Муха-фитомиза.
Самки откладывают яйца на раскрывшиеся цветки заразихи. Личинки питаются
завязями и незрелыми семенами. Часть личинок окукливается непосредственно в
семенных коробочках, другие продвигаются вниз по стеблю и питаются в минах,
окукливаясь под эпидермисом в создаваемой ими колыбели. Продолжительность
развития одной генерации 20-36 дней, в том числе яйца - 1-2 дня, личинки - 14-20, куколки - 5-14 дней. В
европейской части страны за сезон развивается 2-3 поколения. Плодовитость
самки до 200 яиц. Дальность разлета мух за трое суток - 2,5-3 км. К концу июля и в августе значительная часть личинок
концентрируется в стеблях и мясистых тканях подземной части заразихи,
проделывая неправильной формы ходы, заполненные бурой трухой, и уходит в
диапаузу. Фитомизе свойственны обычная зимняя и
многолетняя диапаузы. Личинки фитомизы уничтожают или
повреждают семена и угнетают развитие заразихи. Нередко повреждение
эпидермиса стеблей приводит к развитию гриба из рода Fusarium, причиняющего вред
заразихе во второй половине лета, особенно во влажные годы. Методика разведения и применения фитомизы в борьбе с заразихой предусматривает три
способа: сбор в естественных условиях, накопление в поле, искусственное
разведение в теплице (Бронштейн, 1970). Сбор в естественных условиях проводят осенью, до
подготовки полей к вспашке. Стебли с диапаузирующими
куколками фитомизы собирают вместе с подземной
частью, не отряхивая от земли, складывают под навесом, подсушивают и помещают
в бумажные мешки. Зимой мешки хранят в хорошо проветриваемом помещении при
6-7°С и относительной влажности воздуха 65%. Мешки
укладывают на стеллажи или подвешивают. Накопление в поле проводят на маточниках,
закладываемых на небольших участках, наиболее сильно заселенных заразихой.
Маточник заселяют фитомизой, количество которой должно в 4-5 раз превышать обычную норму выпуска. Для
привлечения и подкормки взрослых мух здесь же развешивают флажки из
полиэтиленовой пленки, с одной стороны окрашенные в
желтый, голубой, фиолетовый и белый цвета, с другой - покрытые 20%-м
раствором сахара или меда. С одного полевого участка площадью 0,03 га можно
получить фитомизу, которой будет достаточно для
выпуска на 1 тыс. га плантаций овощебахчевых культур. Искусственное разведение фитомизы в
теплицах проводят на заразихе. Зацветающую заразиху
заселяют фитомизой, полученной из заранее собранных
в природе куколок. Куколок содержат в пробирках при температуре 23-25°С, вышедших мух подкармливают сахарным сиропом и
выпускают в теплицу. В теплице площадью 100 м2 за один оборот можно вырастить 200
растений томатов и около 2 тыс. цветоносов заразихи, на которых развивается
до 400 тыс. особей фитомизы.
|