
2.1. Принципы технической энтомологии
В технической энтомологии популяции насекомых делят на три группы: природные, искусственные и культурные. Основной критерий деления - степень автономности.
Природные популяции - это полностью автономные популяции, которые могут неограниченно долго существовать без регуляции со стороны человека.
Культурные популяции - это полностью неавтономные популяции, которые потеряли связь с исходными природными популяциями.
Искусственные популяции - это полуавтономные популяции, их существование поддерживается регуляторной деятельностью человека. Длительное существование ограниченных искусственных популяций поддерживается в ряде случаев периодическим пополнением их генофонда за счет природных популяций.
Наиболее значимы для биотехнологии в защите растений искусственные популяции. |
Уровни культивирования искусственных популяций
1. Полевая культура - это искусственная популяция, воспроизводство которой осуществляется в полевых условиях. Например, разведение пчел-листорезов и шмелей для опыления культурных растений, медоносных пчел.
2. Лабораторно-полевая культура - это искусственная популяция, которая проходит в лаборатории часть жизненного цикла. Так, в фитомизариях осуществляется накопление гербифага фитомизы, собранного в поле.
3. Лабораторная культура - это искусственная популяция, завершившая не менее одного полного цикла генерации в искусственных условиях. Лабораторное разведение освоено для многих видов насекомых (капустная совка, луговой мотылек, пчелиная огневка и др.)
4. На основе лабораторных культур создаются промышленные массовые культуры. Примером массового производства насекомых является автоматизированное разведение яйцееда трихограммы, которое осуществляется на специальных биофабриках.
В современной экологии жизненной системой называется система, состоящая из рассматриваемой популяции и ее эффективной среды. Для искусственной популяции насекомых жизненной системой является технобиоценоз.
Схема культивирования насекомых (Злотин, 1989) включает 6 этапов:
1. Выбор исходного материала.
2. Введение биоматериала в культуру.
3. Оптимизация культивирования, типизация и стандартизация.
4. Придание культуре заданных свойств.
5. Закладка маточной (племенной) культуры.
6. Создание и массовое производство культур.
Этап 1. Выбор исходного биологического материала
Исходный материал, как правило, получают из природы. Если природные сборы невозможны, то насекомых берут из инсектария. Но при этом следует помнить, что нет двух одинаковых технобиоценозов, поэтому повторная адаптация может отрицательно сказаться на качестве культуры.
Важным моментом на первом этапе является основание стартовой колонии. |
Начальный размер стартовой колонии зависит от типа создаваемой культуры. Например, для трихограммы собирают не менее тысячи яиц насекомых, зараженных яйцеедом. Необходимо отличать фактическую численность стартовой колонии от эффективной. Эффективная численность вносит реальный вклад в репродукцию колонии и может быть меньше фактической (собранной).
При выборе исходного материала учитывают характер ареала. В данном случае собирают данные о зонах оптимума и пессимума, где популяции имеют разную устойчивость к факторам окружающей среды. В пессимуме условия жесткие, и населяющие виды более жизнеспособны. Учитывают также фазу динамики численности природной популяции. Стартовые колонии отбираются из жизнеспособных популяций в очагах их нарастающей численности.
В зависимости от вида насекомых исходным материалом могут служить собранные в природе диапаузирующие гусеницы, куколки, яйца. Так, для закладки стартовой культуры яблонной плодожорки удобнее использовать диапаузирующих гусениц, для капустной совки - бабочек, отловленных с помощью светоловушек, для непарного шелкопряда - яйцекладки в войлоке. При равных возможностях лучшей стадией для закладки колонии являются яйца, так как при этом обеспечивается наиболее простое обеззараживание материала.
Чтобы определить фазу увеличения численности насекомых в природе, можно пользоваться методами оценки состояния популяции, во-первых, по изменчивости окраски насекомых и, во-вторых, по соотношению полов. Так, потемнение окраски часто указывает на вспышку роста численности. Увеличение числа самок также свидетельствует о тенденции к увеличению численности популяции.
Определение пола возможно на различных стадиях развития и зависит от вида насекомого. |
На стадии имаго легко различить самок и самцов у видов с ярко выраженным половым диморфизмом (саранчовые, непарный шелкопряд, капустная белянка и др.) (рис. 2.1).

 ♂
♂
 ♀
♀
Рисунок 2.1. Капустная белянка (самец и самка)
У других видов (капустная совка) устанавливать соотношение полов удобнее по куколкам. У этого вида самцы от самок легко различаются по расположению половой и анальной щелей. Анальная щель у обоих полов размещается на 10-м сегменте брюшка, а половая щель у самцов на 9-м, у самок - на 8-м сегменте. Между этими двумя щелями у самцов хорошо заметна одна граница (бороздка) между 9-м и 10-м сегментами, у самок - две границы: между 8-м и 9-м и 9-м и 10-м. Половая щель самца хорошо видна из-за двух выпуклостей по бокам щели (рис. 2.2).
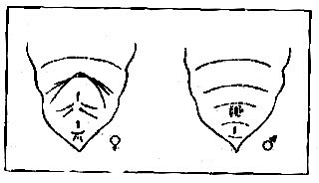
Рисунок 2.2. Расположение половой и анальной щелей
у куколок капустной совки
У некоторых видов не представляется возможным определить пол по внешним признакам, поэтому прибегают к вскрытию имаго: самцов и самок различают по наличию семенников или яичников (например, жуки-щелкуны).
Для отбора в стартовой колонии здоровых особей осуществляют карантин и патологический контроль. Проводят анализ зараженности популяции энтомофагами и паразитами на всех стадиях развития хозяина. Анализируют на заболеваемость вирозами, бактериозами, микозами. Больных особей выбраковывают. Организуют маточники резерватов для пополнения культуры.
Этап 2. Введение биоматериала в технобиоценоз и создание исходной популяции
(обеспечение чистоты культуры)
После отбора исходного материала приступают к освобождению от паразитов всех порядков. Исходный материал разделяют на несколько колоний, которые удобно периодически осматривать, удаляя больных и нетипичных особей, а также энтомофагов. Эта работа обычно завершается в течение двух поколений. В это время необходима профилактика эпизоотий и соблюдение персоналом санитарно-гигиенических норм. Оборудование, повторно используемое для разведения насекомых, следует автоклавировать или обрабатывать дезинфектантом. Металлические садки и лотки опускают на несколько минут в кипящую воду, затем под сильную струю воды.
Этап 3. Оптимизация культивирования по основным параметрам содержания.
Типизация и стандартизация культур
После комплектования стартовой колонии замыкают жизненный цикл вида в условиях лаборатории. Возникает лабораторная культура насекомых. Далее необходимо воспроизводство в оптимальных условиях. В технической энтомологии существует такой термин, как «норма реакции» популяции на оптимальные условия существования, отражающий естественные пределы изменчивости признаков популяции (по статистическим данным). Исходя из статистических данных, характеризующих популяцию, из которой взят исходный материал, и данных, полученных в результате учетов в период адаптации насекомых при создании культуры, можно судить о степени пригодности условий технобиоценоза и о завершении процесса адаптации. О завершении адаптации судят по показателям культуры, которые стабилизируются на значениях, близких к таковым у исходных популяций.
Под стандартизацией культуры насекомых понимают достижение насекомыми определенных, стабильно сохраняющихся биологических и этологических признаков в оптимальных условиях технобиоценоза. В первых лабораторных генерациях при резком изменении условий развитие насекомых обычно растянуто во времени, смертность личинок высокая, а плодовитость имаго низкая. По мере адаптации к условиям технобиоценоза биологические показатели стабилизируются (у капустной совки к пятой генерации, у яблонной плодожорки - к шестой).
Для поиска зоны оптимума используют математическое моделирование. В качестве признаков, включаемых в стандарт (ГОСТ) фигурируют следующие:
- средняя масса яйца;
- отрождение личинок (%);
- жизнеспособность (%);
- дружность развития;
- средняя масса куколки;
- средняя масса имаго;
- количество откладываемых яиц;
- соотношение полов;
- допустимое количество больных.
Типизация культур. Тип культуры задается в зависимости от практической цели. Есть два пути создания культур - генетический с формированием стандартных генетических линий и экологический с созданием культур, стандартных по биологическим показателям. В пределах этих направлений могут быть выделены два основных типа культур: работающие и сырьевые.
Работающая культура - это тип культуры, предназначенный для выполнения определенной функции, причем при выпуске в природу. Для достижения этой цели создаются условия культивирования, максимально приближенные к естественным. Такие культуры сохраняют следы связей с исходным биоценозом. К работающим культурам относятся культуры энтомофагов, агентов генетической борьбы и насекомых - опылителей растений.
Сырьевая культура - это тип культуры, предназначенный для производства сырья и продуктов питания. Такая культура существует непрерывно в искусственных условиях. Здесь преследуется цель получения экотипа с максимумом заданных свойств, поэтому может происходить полная потеря связи с исходным биоценозом. К типу сырьевых культур относят культуры для наработки энтомопатогенов, БАВ, зоогумуса.
Помимо этих двух основных типов существуют экспериментальные культуры. Они предназначены для исследовательских работ. Сюда относятся две категории культур: тест-культуры и гнотобионты.
Тест-культуры предназначены для оценки качества биопрепаратов против вредителей и других агентов.
Гнотобионтная культура - стерильная культура насекомых, освобожденная от любых микроорганизмов. Предназначена для изучения взаимоотношений микро- и макроорганизмов.
Наконец, при всех случаях культивирования поддерживаются маточные (племенные) культуры, для маточных культур важно сохранить высокие показатели жизнеспособности на всех стадиях жизненного цикла. Стандартизация культур обычно завершается составлением паспорта. В паспорте отмечают обозначение и происхождение культуры, условия разведения и все критерии стандартизации. При переходе к массовому (промышленному) разведению паспорт заменяется на технические условия.
Этап 4. Придание культуре заданных стабильно наследуемых признаков
Основные принципы селекции насекомых совпадают с таковыми для всех животных и растений. Есть и существенные отличия: относительно короткий период жизни насекомых, позволяющий получить несколько поколений в год, и высокая репродуктивная способность самок.
Для селекции на жизнеспособность и продуктивность применяют:
♦ скрещивание гетерогенных родителей из популяций, воспитывающихся в разных климатических условиях;
♦ отбор по чувствительности имаго самцов к половому феромону;
♦ отбор по устойчивости к болезням и т.д.
Селекция на бездиапаузность. Для скрещивания используют самок-доноров без диапаузы (из жарких стран) и самцов местных популяций с диапаузой. В потомстве контролируют наследование признака бездиапаузного развития.
Этап 5. Закладка маточной (племенной) культуры
для длительного воспроизводства насекомых с заданными свойствами
Основная задача этого этапа - сохранение и улучшение заданных свойств в культуре на протяжении длительного времени.
Существуют два направления разведения насекомых: внутрипопуляционное (внутрипородное) и межпопуляционное (межпородное), или гибридизация. Наиболее распространенный способ внутрипородного разведения - линейное.
Межпородное разведение применяют в селекции для создания новых пород и для промышленной гибридизации. Потомство, полученное при межпородном разведении, называют гибридным. Гибридизация перспективна при массовом разведении.
Этап 6. Массовое производство культур насекомых с заданными свойствами
Массовое производство культур подразделяется на несколько последовательных процессов: массовое получение яиц, их обработка ⇒ получение личинок, их выращивание ⇒ сбор куколок ⇒ получение имаго.
Процесс массового производства насекомых можно признать отработанным только тогда, когда заданный уровень воспроизводимости результатов обеспечивается по определенному регламенту при обслуживании техническим (неспециализированным) персоналом. Задача специалистов сводится к наблюдению за качеством продукции и управлению производством. При массовом производстве желательно максимально использовать средства механизации и автоматизации, что позволяет экономить время и средства.
Обязательны санитарно-профилактические мероприятия. Они предусматривают санитарную (путем мытья) и механическую чистку. Для этого используют 0,5-1%-й теплый раствор каустической соды или 1-2%-й раствор кальцинированной соды. После тщательной очистки следует дезинфекция. Обычно обрабатывают смесью хлорной извести и формалина (2 кг+3 л) на 100 м3 помещения.
На всех этапах разведения насекомых существует контроль качества культуры. Он включает проверку соответствия требованиям стандарта, а также санитарно-патологический контроль. Контроль осуществляют визуально или биофизическими методами. Генетическую структуру популяции анализируют по электрофоретическим спектрам белков - энзим-электрофорезу, исходя из положения «один ген - один фермент», в сравнении со спектрами исходной популяции.
Повышения жизнеспособности и продуктивности насекомых можно добиться путем создания оптимальных условий их содержания |
![]() Какие же факторы влияют на культуру насекомых? Рассмотрим основные абиотические и биотические факторы в условиях технобиоценоза.
Какие же факторы влияют на культуру насекомых? Рассмотрим основные абиотические и биотические факторы в условиях технобиоценоза.
Температура и влажность. В связи с пойкилотермностью насекомых температура их тела в очень большой степени зависит от температуры окружающей среды. Поэтому среда определяет интенсивность обмена веществ насекомых, темпы онтогенеза, продолжительность жизни и плодовитость, количество генераций, интенсивность питания, размеры тела. Действие температуры неотделимо от влияния влажности.
Свет. В природе свет оказывает прямое, а также косвенное влияние на плодовитость, число генераций, диапаузу насекомых. Косвенное влияние проявляется через кормовое растение (фотосинтез). В условиях искусственного разведения действие света ограничивается прямым влиянием. Главное здесь - сохранить фотопериод.
Ветер (аэрация). В природе ветер влияет на расселение. В инсектариях искусственно создаваемая аэрация может благоприятно влиять на газообмен, улучшать санитарные условия. Но иногда это приводит к высушиванию корма и яиц насекомых.
Выбор пищевых сред (биотический фактор). Среды подразделяются на естественные и искусственные, а искусственные в свою очередь на синтетические и полусинтетические. Удешевление массового разведения насекомых невозможно без применения дешевых искусственных питательных сред (ИПС). Набор основных питательных веществ хорошо разработан. Это азотистые соединения (белки и аминокислоты), углеводы, витамины и минеральные соли. Специфика диет конкретных видов заключается в соотношении разных питательных веществ в корме и в степени гидролиза главных компонентов. На средах одного состава можно выращивать определенные группы насекомых, имеющих сходные требования к качеству корма. Это не только насекомые одного семейства (например, совки отряда чешуекрылых), но и входящие в один отряд, например, луговой мотылек (сем. Огневки) и непарный шелкопряд (сем. Шелкопряды). Этот факт очень важен, так как позволяет унифицировать ИПС. При унификации сред их специфичность может восполняться фагостимуляторами, т.е. пищевыми аттрактантами. Пищевые аттрактанты выполняют роль экологических сигналов, помогающих насекомым определить источник пищи, которая гарантирует их успешное развитие и размножение.
Улучшению биологических показателей насекомых-фитофагов способствует включение в среды кормового растения. Для капустной белянки и капустной совки - это порошок из листьев капусты, для лугового мотылька - порошок из листьев лебеды, для колорадского жука порошок из листьев картофеля и т.д. Для выращивания непарного шелкопряда составлены полусинтетические питательные среды, включающие естественные компоненты корма, например, проросшие желуди. Использование естественных пищевых компонентов значительно удешевляет и упрощает способ приготовления питательных сред.
На искусственных микрокапсулированных средах в последнее время разводят и энтомофагов. Например, для воспитания златоглазки обыкновенной лучшими являются микрокапсулы в оболочках на основе парафина и воска. Показано также, что можно применять жидкие ИПС, заключенные в полые гидрофобные полимерные материалы (полипропилен) с внутренним диаметром 150-400 мкм.
Как правило, насекомые питаются в естественных условиях твердой пищей. Поэтому во все ИПС первоначально вводили агар-агар. Но этот продукт достаточно дорогой и его необходимо заменять. В нашей стране имеется опыт успешной замены агар-агара и продуктов питания человека в средах для массового разведения отходами пищевой промышленности. Например, при замене агар-агара на свекловичный жом было обеспечено массовое разведение непарного шелкопряда, озимой и капустной совок. Заменителем может стать и полиэтиленгликоль (ПЭГ).
Заменителями белка в ИПС могут служить отходы рыбной промышленности - молоки лососевых рыб. Большие возможности как заменителя белка у кормовой биомассы из личинок мух, получаемой при утилизации биоорганических отходов. Личинки комнатной мухи по содержанию азота, липидов и других веществ превосходят все традиционные компоненты ИПС.
Но не следует забывать, что чрезмерное упрощение ИПС может отрицательно сказаться на жизнеспособности популяции. На современном этапе вопросы оптимизации питательных сред решаются с помощью математических методов. Например, для сравнительной оценки ИПС строят таблицы выживания, где указывают основные биологические показатели популяции: α1 - отрождение личинок, %; α2 - число самок, %; П - плодовитость яиц на одну самку, шт. На их основе рассчитывается обобщенный показатель (Y1):
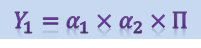
Чем лучше ИПС, тем выше показатель Y1. Другой прием оптимизации сред - использование биохимических тестов для контроля сред. Целенаправленное создание ИПС возможно только на основе сопоставления их химического состава со стандартными компонентами или с составом природного корма. Состав сред может контролироваться оценкой физиологического состояния насекомых по ферментативным тестам. Так, чувствительным тестом является определение содержания таких ферментов, как глюкозо-6-фосфат или малатдегидраза.
В ИПС совершенно необходимо включать ингибиторы микрофлоры. Сюда относят метабен, бензойную кислоту, антиоксиданты. Специальные среды требуются для выращивания гнотобионтов. Известные ИПС после автоклавирования оказались непригодными для гусениц такого гнотобионта, как большая пчелиная огневка.
Фактор непрерывного разведения. При массовом разведении насекомых нужна непрерывность. Однако следует помнить, что при непрерывном разведении в течение длительного времени может сильно снижаться жизнеспособность популяции.
Взаимодействие с патогенными микроорганизмами. Роль патогенных микроорганизмов в ограничении численности культуры резко возрастает при массовом разведении. Этот эффект тем значительнее, чем выше плотность. На возникновение и распространение эпизоотии влияет возрастной состав культуры. В лабораторных условиях он преимущественно одновозрастной, что обусловливает более массовый характер заболевания. Применение различных терапевтических препаратов (например, антиоксидантов) в ИПС может снижать риск эпизоотии, но тогда устраняется фактор отбора на устойчивость к инфекции.
Плотность популяции. Плотность популяции во многом определяет физиологическое состояние особей, их жизнеспособность и продуктивность. Культура насекомых при разведении весьма чувствительна к повышению плотности, так как миграция в искусственных условиях исключена. Поэтому повышенная плотность популяции оказывает наиболее отрицательное влияние на жизнедеятельность видов в той стадии развития насекомого, в которой происходит расселение и миграция вида в природе. Так, для непарного шелкопряда повышение плотности культуры в I возрасте приводит к росту смертности. Это обусловлено тем, что вид расселяется путем разноса гусениц ветром в природе. Существенное значение в снижении жизнеспособности и плодовитости культуры имеет раздражимость при контакте особей. Вследствие невозможности миграции создается состояние, близкое к стрессовому.
Если насекомым свойственен каннибализм (капустная совка), то при разведении гусениц с IV возраста требуется их индивидуальное содержание (в гекселях). Но для некоторых видов, наоборот, положителен эффект группы. Это показано на примере гнотобионтного разведения гусениц пчелиной огневки.
Генетические аспекты разведения насекомых. При разведении насекомых есть два решающих момента:
♦ зависимость генетической однородности культуры от объема, взятого для разведения биоматериала и гетерогенности родительской популяции;
♦ изменение характера отбора в условиях разведения.
Чем меньше начальное количество особей, взятых для разведения и выше гетерогенность родительской популяции, тем больше шансов получить экотип, генетически отличный от исходной популяции.
Искусственно созданная популяция из открытой превращается в закрытую, потерявшую связь с родительской. Такие изменения значительно изменяют роль тех или иных генотипов в популяции. Генотип очень чувствителен к условиям среды как фактору отбора. Поэтому правильное соотношение всех вышеприведенных факторов очень важно. Для этого применяют методы математического моделирования с целью оптимизации выращивания культуры насекомых.

