Органическая химия

Моносахариды — гетерофункциональные соединения. В их молекулах одновременно содержатся и карбонильная (альдегидная или кетонная), и несколько гидроксильных групп, т.е. моносахариды представляют собой полигидроксикарбонильные соединения: полигидроксиальдегиды и полигидроксикетоны. |
В зависимости от того, какая группа: альдегидная или кетонная — входит в состав, моносахариды подразделяются на альдозы (в моносахариде содержится альдегидная группа) и кетозы (содержится кетогруппа).
Например, глюкоза — это альдоза, а фруктоза — это кетоза.

В зависимости от числа атомов углерода в молекуле моносахарид называется тетрозой, пентозой, гексозой и т.д.
Если объединить последние два типа классификации, то глюкоза — это альдогексоза, а фруктоза — кетогексоза. Большинство встречающихся в природе моносахаридов — это пентозы и гексозы.
![]() Моносахариды изображаются в виде проекционных формул Фишера. Символ D означает, что гидроксильная группа у последнего асимметрического атома углерода в проекции Фишера располагается справа от вертикальной линии, а символ L — что гидроксильная группа расположена слева. Каждой альдозе D-ряда соответствует стереоизомер L-ряда, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение. Такие стереоизомеры называются энантиомерами.
Моносахариды изображаются в виде проекционных формул Фишера. Символ D означает, что гидроксильная группа у последнего асимметрического атома углерода в проекции Фишера располагается справа от вертикальной линии, а символ L — что гидроксильная группа расположена слева. Каждой альдозе D-ряда соответствует стереоизомер L-ряда, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение. Такие стереоизомеры называются энантиомерами.
В кристаллическом состоянии моносахариды существуют в виде циклических полуацеталей, образующихся в результате внутримолекулярной реакции соответствующих функциональных групп. При растворении в воде цикл раскрывается с образованием цепной формы, в растворе устанавливается равновесие из пяти таутомерных форм, которые могут самопроизвольно переходить друг в друга.
Полуацетали образуются при взаимодействии молекул двух соединений — альдегида и спирта. В процессе реакции разрывается двойная связь карбонильной группы, по месту разрыва к которой присоединяются атом водорода гидроксила и остаток спирта. Циклические полуацетали образуются за счет взаимодействия аналогичных функциональных групп, принадлежащих молекуле одного соединения — моносахарида. Реакция протекает в том же направлении: разрывается двойная связь карбонильной группы, к карбонильному кислороду присоединяется атом водорода гидроксила и образуется цикл за счет связывания атомов углерода карбонильной и кислорода гидроксильной групп.
Наиболее устойчивые полуацетали образуются за счет гидроксильных групп при четвертом и пятом углеродных атомах. Возникающие при этом пятичленные и шестичленные кольца называют соответственно фуранозной и пиранозной формами моносахаридов. Эти названия происходят от названий пяти- и шестичленных гетероциклических соединений с атомом кислорода в цикле — фурана и пирана.
Моносахариды, имеющие циклическую форму, удобно изображать перспективными формулами Хеуорса. Они представляют собой идеализированные плоские пяти- и шестичленные циклы с атомом кислорода в цикле, дающие возможность видеть взаимное расположение всех заместителей относительно плоскости кольца.

ХЕУОРС (Хэворт), Уолтер Норманн
(19.03.1883–19.03.1950), Нобелевская премия (1937)
Для построения формул Хеуорса необходимо:
1. |
Пронумеровать углеродные атомы моносахарида в проекционной формуле Фишера. |
2. |
Повернуть ее направо так, чтобы цепь углеродных атомов заняла горизонтальное положение. Тогда атомы и группы, расположенные в проекционной формуле слева, будут находиться вверху, а расположенные справа — внизу от горизонтальной прямой, а при дальнейшем переходе к циклическим формулам — соответственно над и под плоскостью цикла. |
В действительности же углеродная цепь моносахарида не расположена на прямой линии, а принимает в пространстве изогнутую форму. Как видно, гидроксил при пятом углеродном атоме значительно удален от альдегидной группы, т.е. занимает положение, неблагоприятное для замыкания кольца. Для сближения функциональных групп осуществляется поворот части молекулы вокруг валентной оси, соединяющей четвертый и пятый углеродный атомы, против часовой стрелки на один валентный угол. В результате такого поворота гидроксил пятого атома углерода приближается к альдегидной группе, при этом два других заместителя также меняют свое положение, в частности, группировка — СН2ОН располагается над цепью углеродных атомов. Одновременно с этим и альдегидная группа за счет поворота вокруг σ-связи между первым и вторым углеродными атомами сближается с гидроксилом. Сблизившиеся функциональные группы взаимодействуют между собой по указанной выше схеме, приводя к образованию полуацеталя с шестичленным пиранозным циклом.
Возникающую в результате реакции гидроксильную группу называют гликозидной (полуацетальной). Образование циклического полуацеталя приводит к появлению нового асимметрического атома углерода, называемого аномерным. В результате возникают два диастереомера α- и β-аномеров, различающиеся конфигурацией только первого углеродного атома.
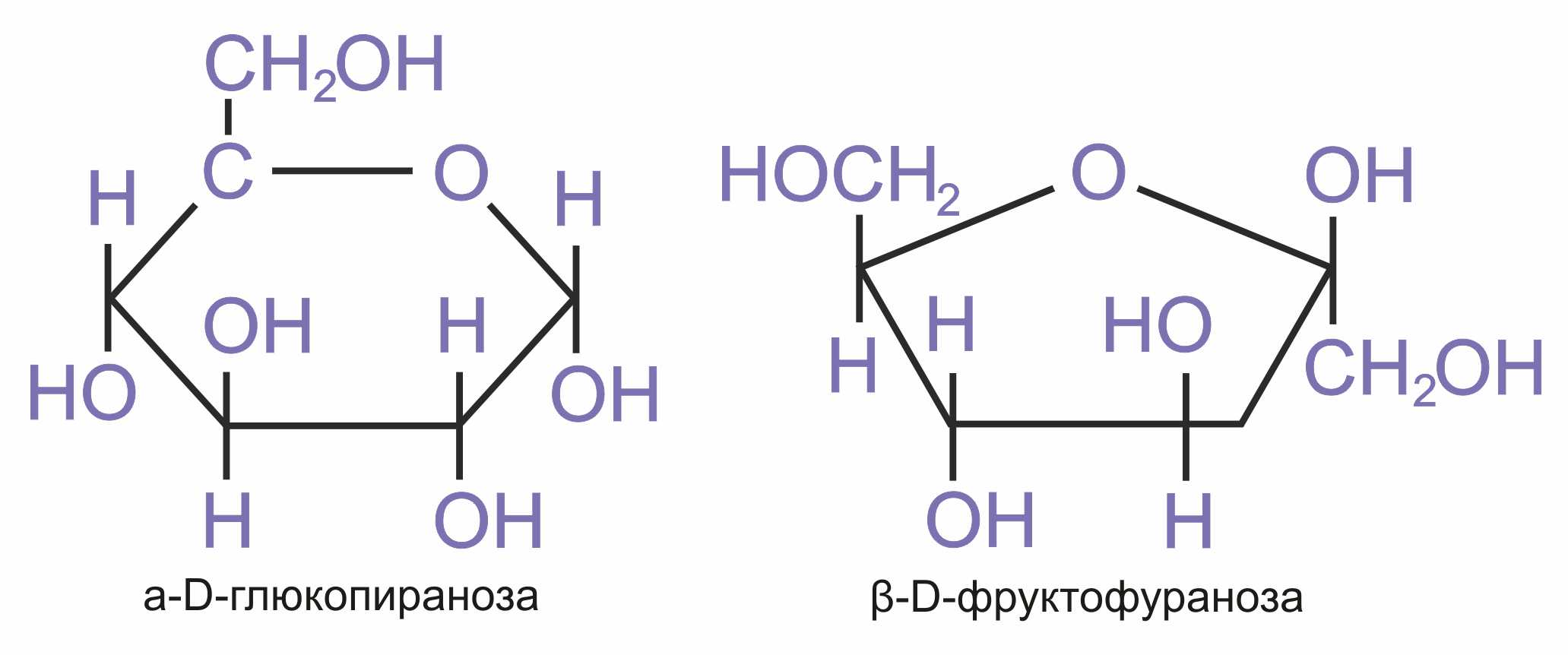
У α-аномера конфигурация аномерного центра одинакова с конфигурацией последнего асимметрического атома углерода, определяющего принадлежность к D- и L-ряду, а у β-аномера — противоположна. У альдопентоз и альдогексоз D-ряда в формулах Хеуорса гликозидная гидроксильная группа у α-аномеров расположена под плоскостью, а у β-аномеров – над плоскостью цикла.
По аналогичным правилам осуществляется переход и к фуранозным формам Хеуорса. Разница лишь в том, что в реакции участвует гидроксил четвертого углеродного атома, а для сближения функциональных групп необходим поворот части молекулы вокруг σ-связи между третьим и четвертым атомами углерода и по часовой стрелке, в результате чего пятый и шестой углеродный атомы расположатся под плоскостью цикла.
Названия циклических форм моносахаридов включают в себя указания на конфигурацию аномерного центра (α- или β-), на название моносахарида и его ряда (D- или L-) и размер цикла (фураноза или пираноза).
Получение моносахаридов
В свободном виде в природе встречается преимущественно глюкоза. Она же является структурной единицей многих полисахаридов. Другие моносахариды в свободном состоянии встречаются редко и в основном известны как компоненты олиго- и полисахаридов. В природе глюкоза получается в результате реакции фотосинтеза:
![]()
Впервые глюкоза получена в 1811 г. русским химиком Г.Э. Кирхгофом при гидролизе крахмала.

КИРХГОФ (Kirchhoff), Густав Роберт
(12.03.1824–17.10.1887)
Позже синтез моносахаридов из формальдегида в щелочной среде предложен А.М.Бутлеровым.
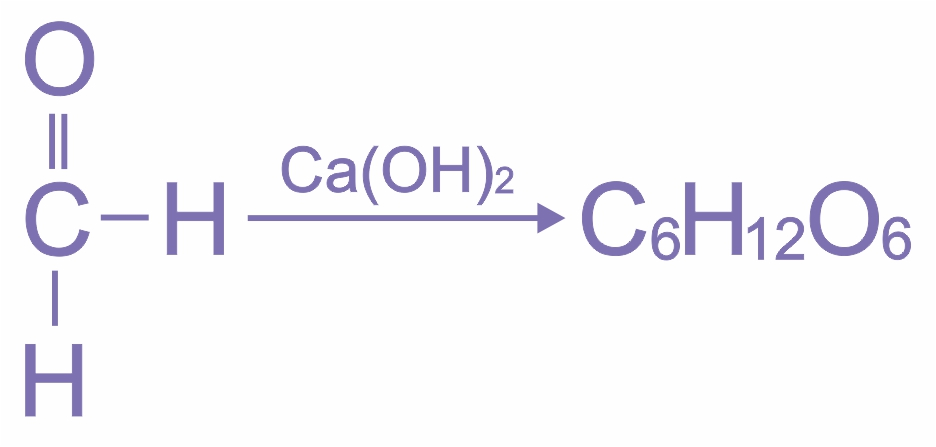
В промышленности глюкозу получают гидролизом крахмала в присутствии серной кислоты.
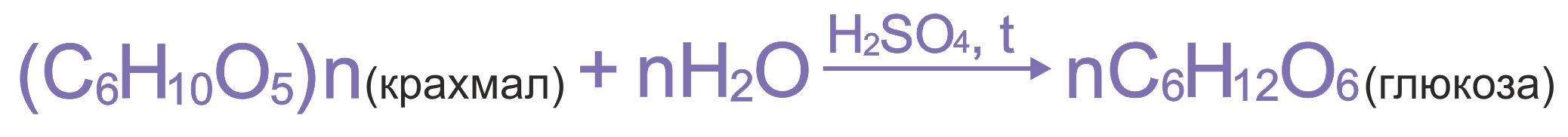
Физические свойства моносахаридов
Моносахариды — твердые вещества, легко растворимые в воде, плохо — в спирте и совсем не растворимые в эфире. Водные растворы имеют нейтральную реакцию на лакмус |
Большинство моносахаридов обладают сладким вкусом, однако меньшим, чем свекловичный сахар.
Химические свойства моносахаридов
Моносахариды проявляют свойства спиртов и карбонильных соединений.
1. Реакции по карбонильной группе
1. |
Окисление: |
|
a) |
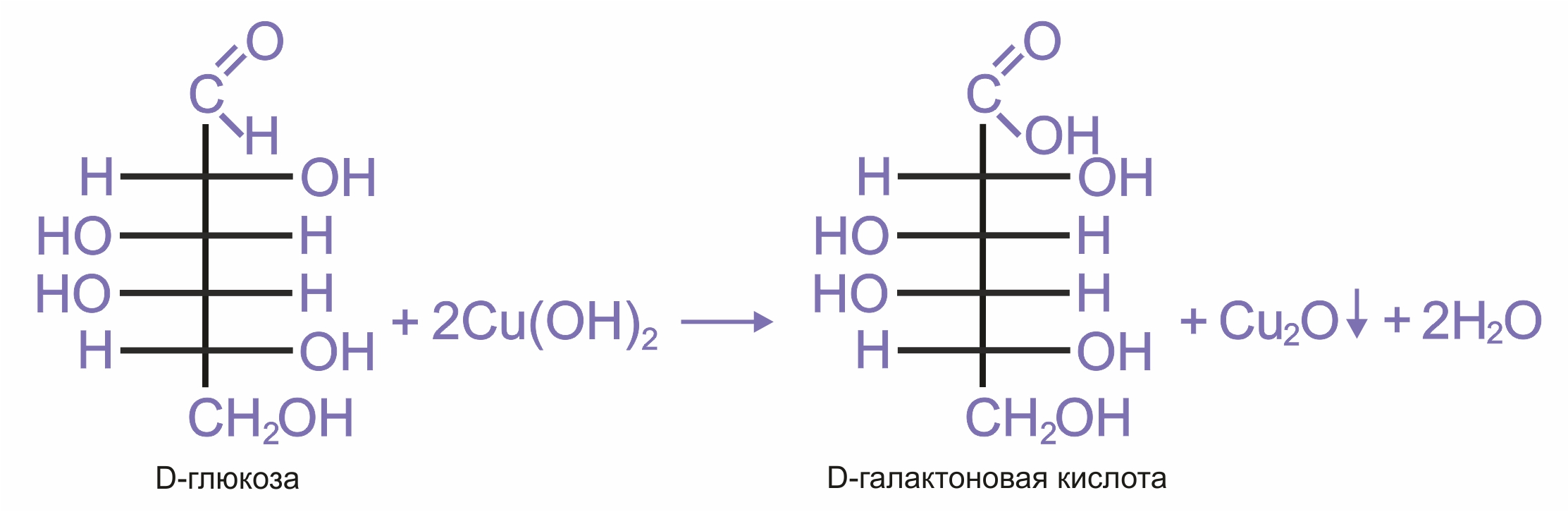
Как и у всех альдегидов, окисление моносахаридов приводит к соответствующим кислотам. При действии мягкими окислителями образуются альдоновые кислоты. Например, при окислении глюкозы аммиачным раствором гидрата окиси серебра образуется глюконовая кислота (реакция «серебряного зеркала»):
|
|
б) |
Реакция моносахаридов с гидроксидом меди при нагревании также приводит к альдоновым кислотам:
|
|
в) |
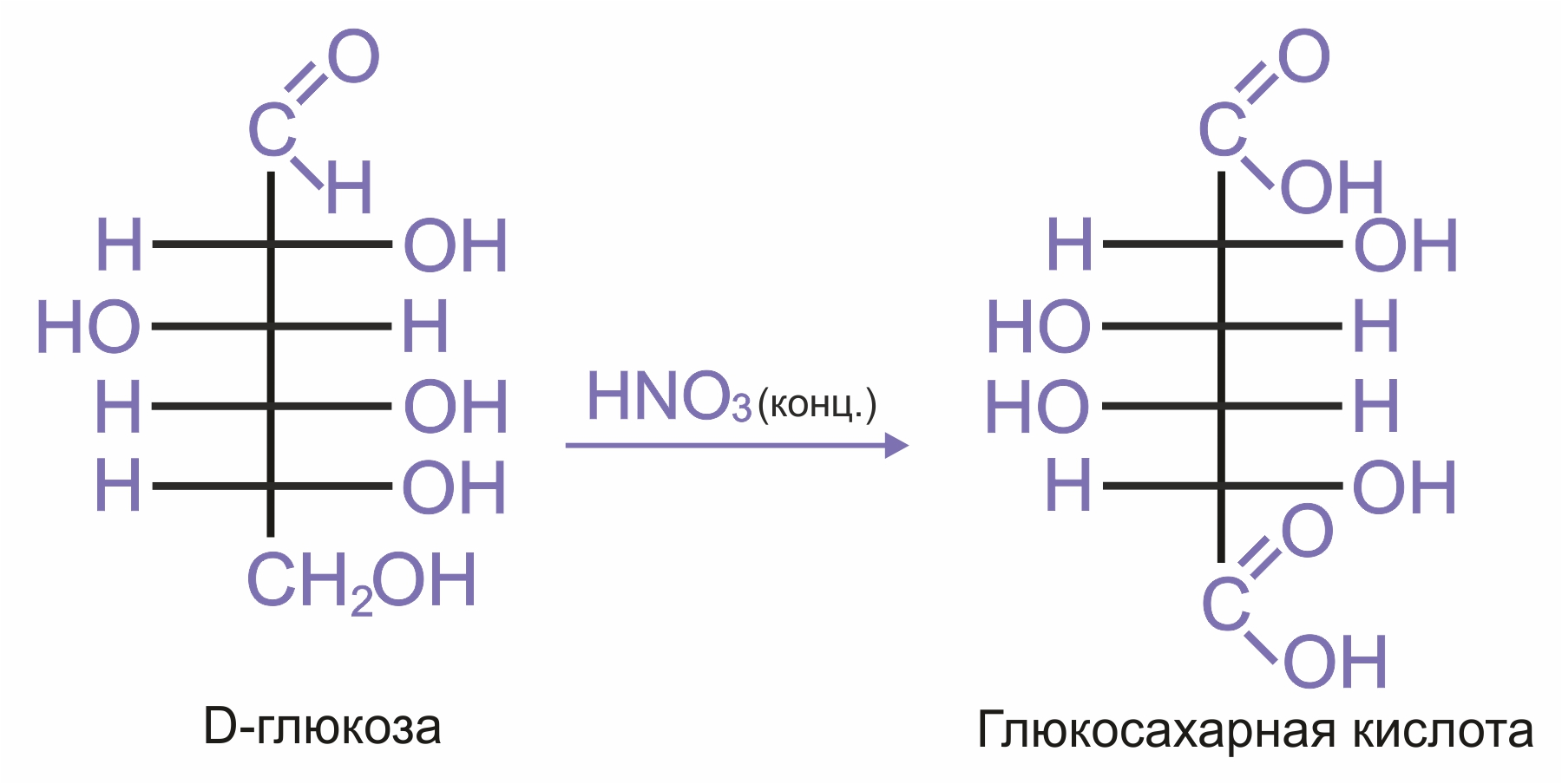
При действии сильных окислителей окисляется в карбоксильную группу не только альдегидная, но и первичная спиртовая группа, приводя к двухосновным сахарным кислотам.
|
|
2. |
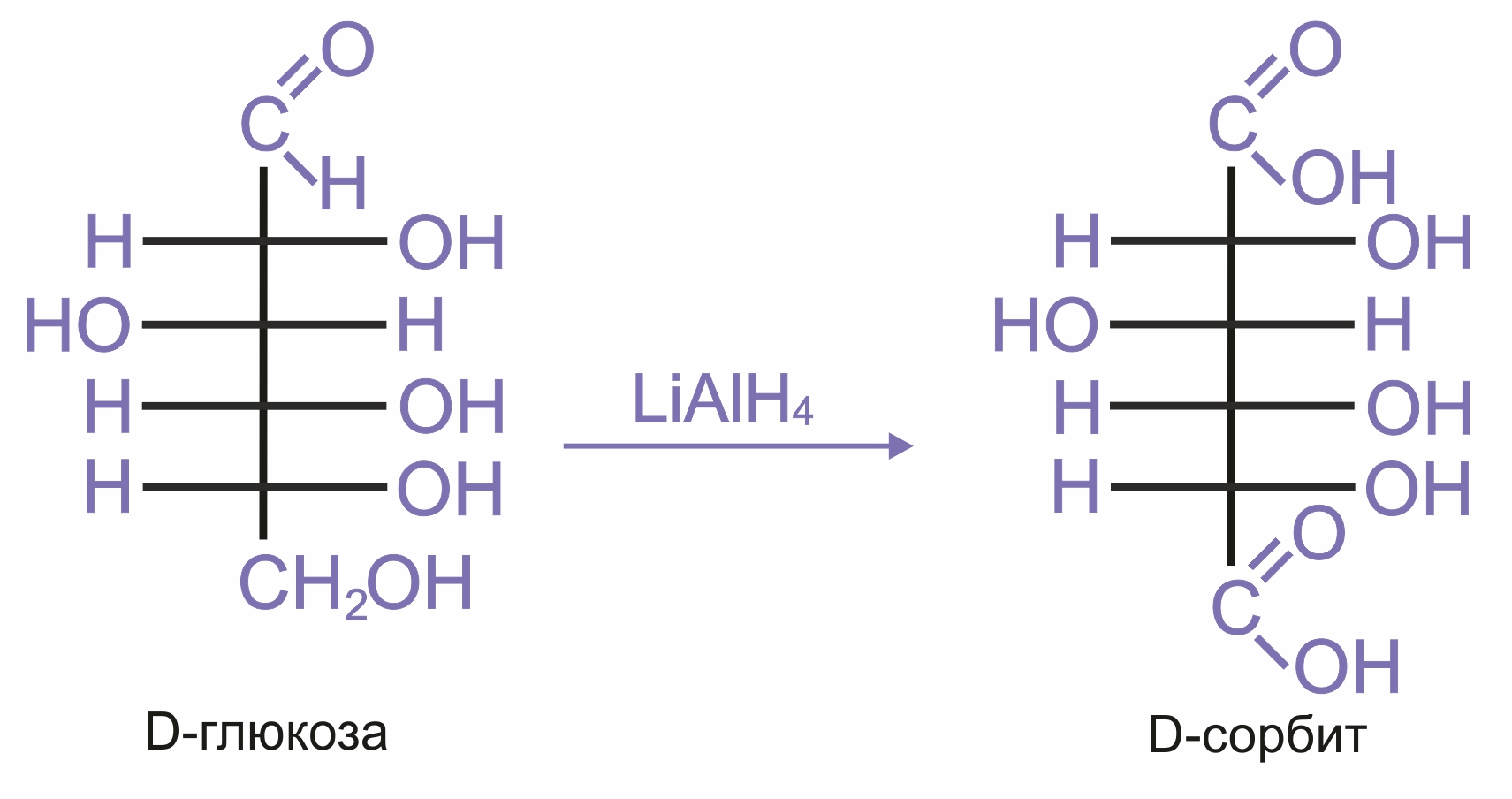
Восстановление. Восстановление сахаров приводит к многоатомным спиртам. В качестве восстановителя используют водород в присутствии никеля, алюмогидрида лития и др.
|
|
2. Реакции по гидроксильным группам
Реакции по гидроксильным группам моносахаридов осуществляются, как правило, в полуацетальной (циклической) форме.
1. |
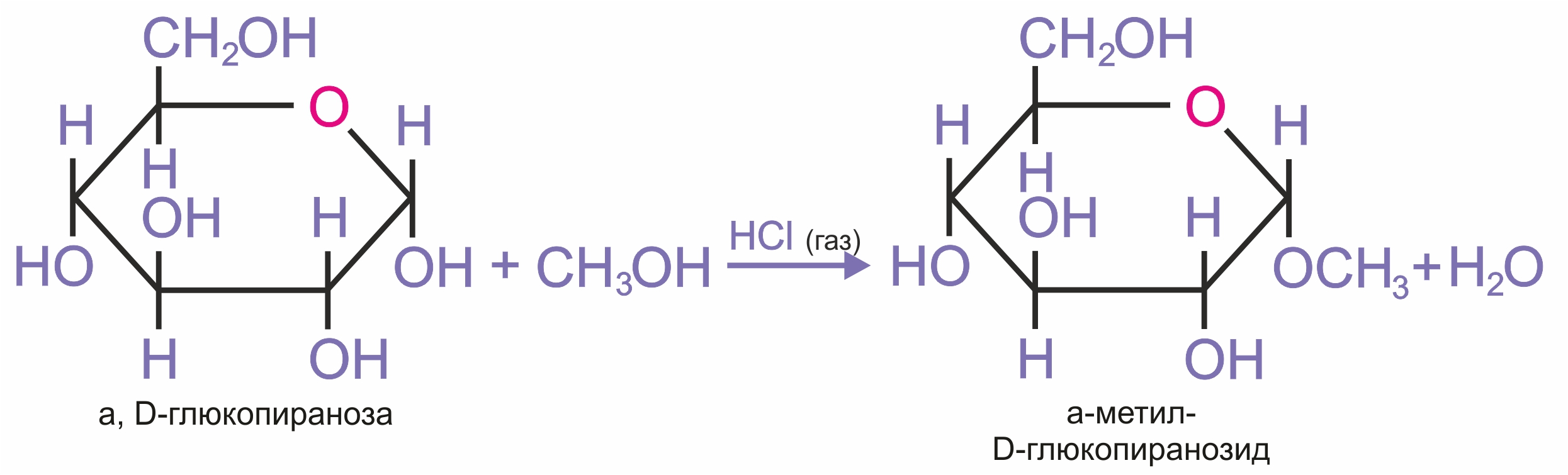
Алкилирование (образование простых эфиров). При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
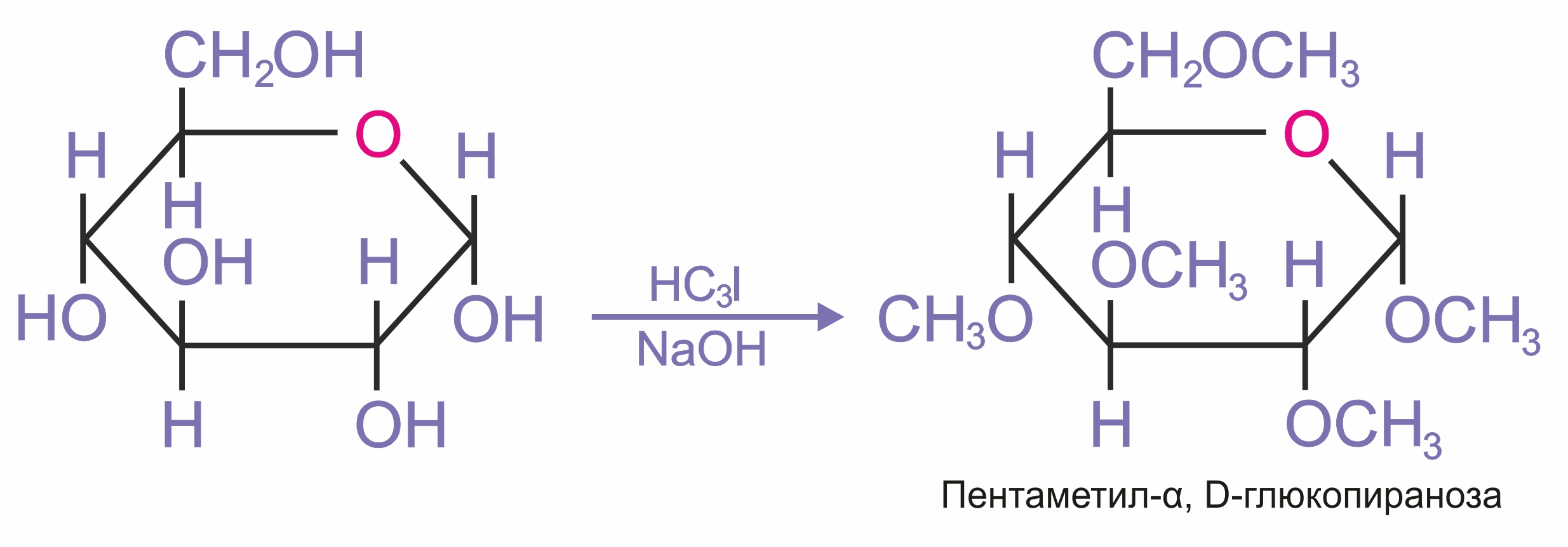
При использовании более сильных алкилирующих агентов (йодистый метил или диметилсульфат) подобное превращение затрагивает все гидроксильные группы моносахарида.
|
2. |
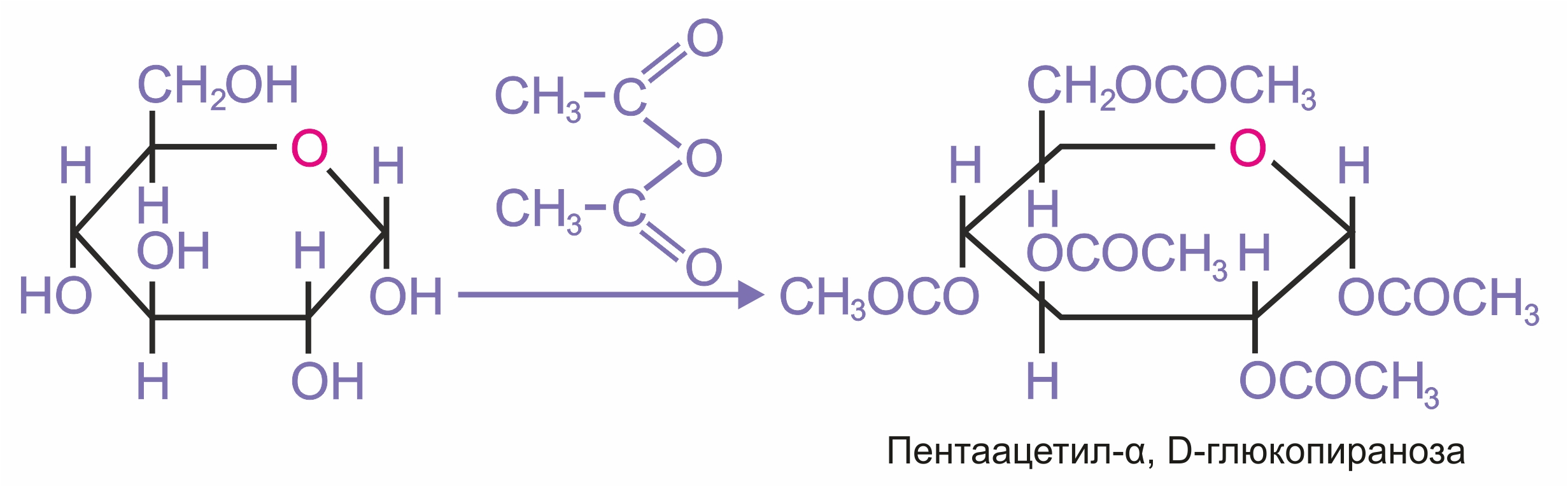
Ацилирование (образование сложных эфиров). При действии на глюкозу уксусного ангидрида образуется сложный эфир — пентаацетилглюкоза.
|
3. |
Как и все многоатомные спирты, глюкоза с гидроксидом меди (II) дает интенсивное синее окрашивание (качественная реакция). |
3. Специфические реакции
Свойства моносахаридов характеризуются и некоторыми специфическими свойствами — процессами брожения.
Брожение — расщепление молекул сахаров под воздействием ферментов (энзимов). |
Виды брожения:
Данные виды брожения, вызываемые микроорганизмами, имеют широкое практическое значение.
Например, спиртовое — для получения этилового спирта, в виноделии, пивоварении и т.д., а молочно-кислое — для получения молочной кислоты и кисло-молочных продуктов.