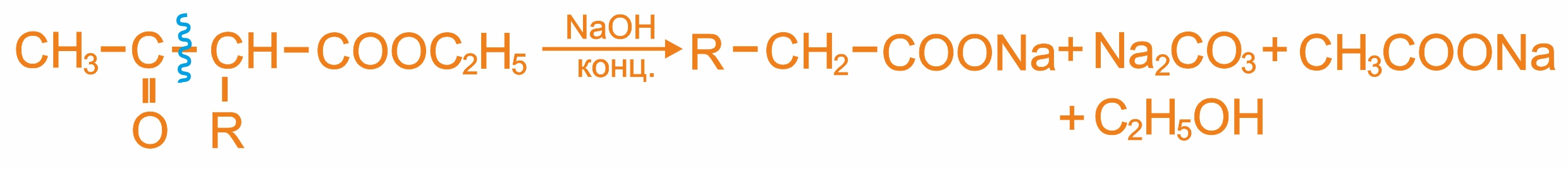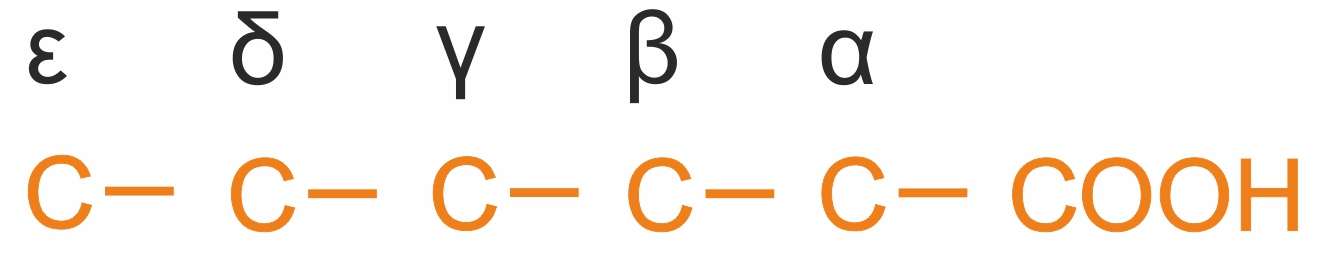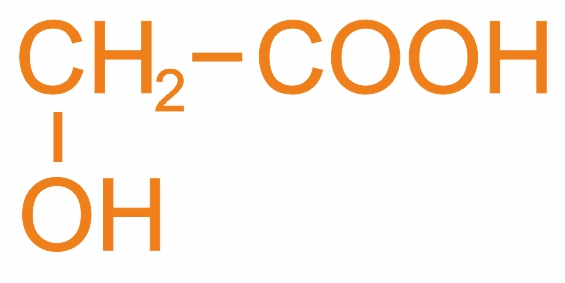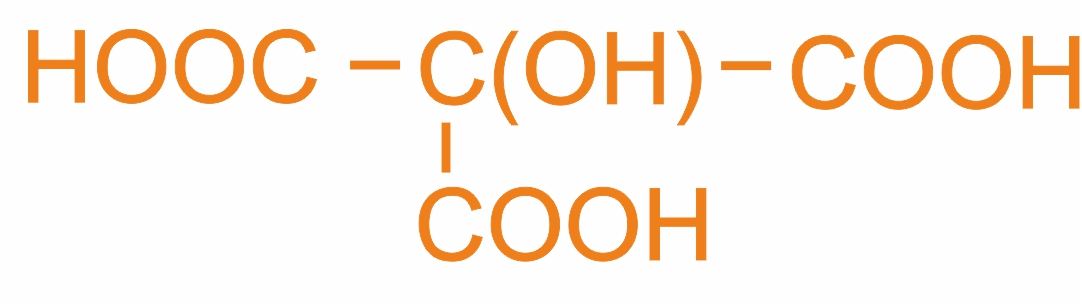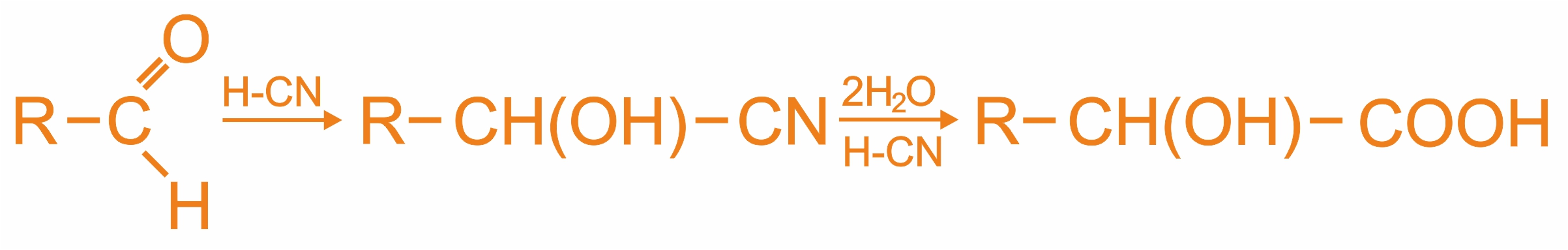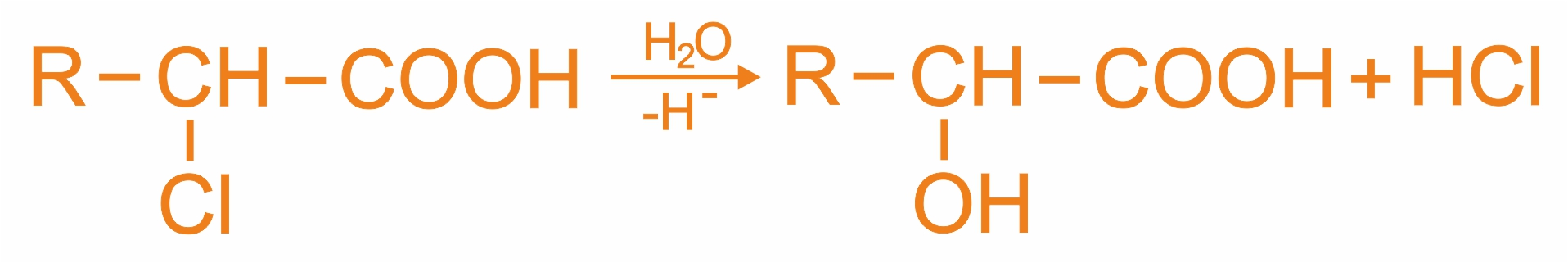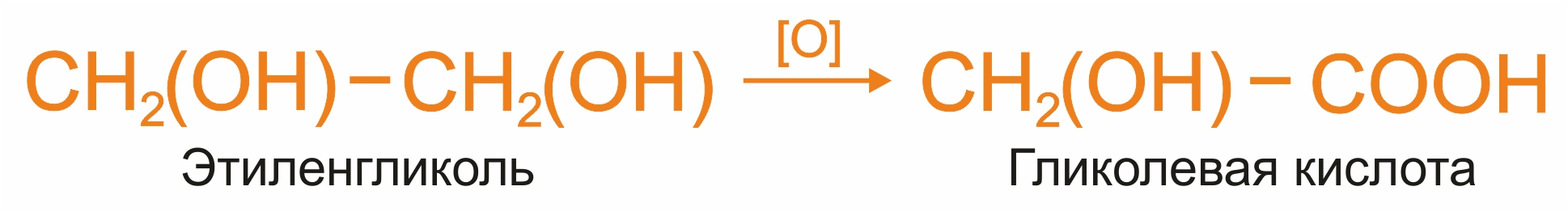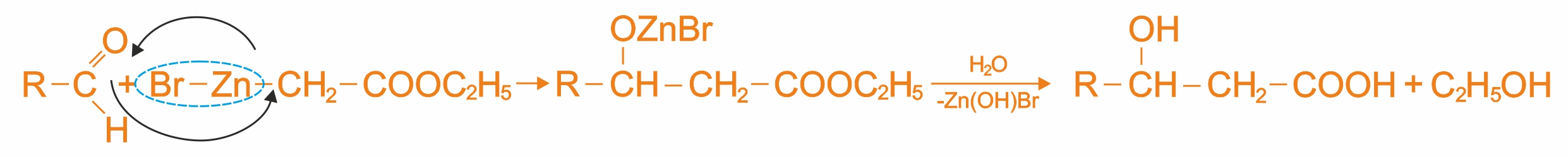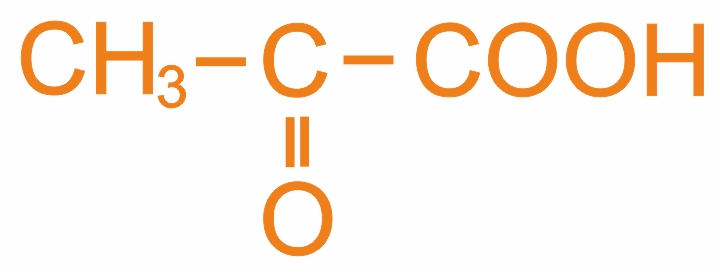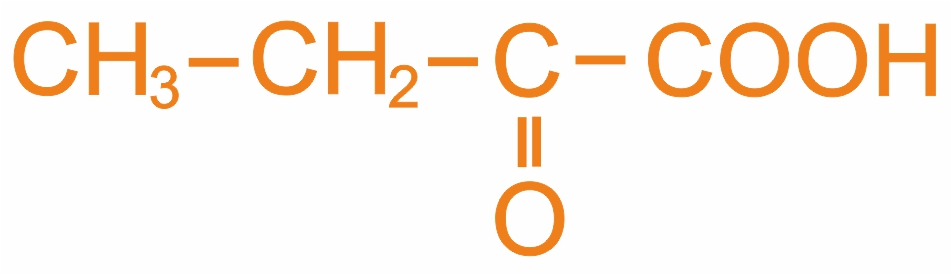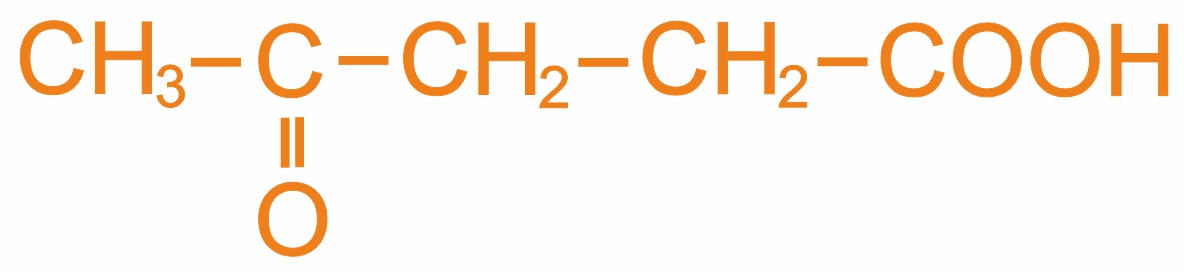Органическая химия

Тема 3.5 ОКСИ– и ОКСОКИСЛОТЫ
Оксикислотами называют соединения, содержащие в молекуле две функциональные группы: –ОН (гидроксильная) и –СООН (карбоксильная). |
• |
по количеству карбоксильных групп: одно-, двух- и многоосновные; |
• |
двух-, трех- и многоатомные кислоты; |
• |
алифатические и ароматические. |
Изомерия оксикислот:
• |
Структурная изомерия вызывается особенностями строения углеродного скелета и положением гидроксильной группы относительно карбоксила (α, β, γ и т.д.)-оксикислоты:
|
• |
Если все четыре заместителя у атома углерода одинаковы, то его пространственная модель представляет собой правильный тетраэдр, в центре которого находится атом углерода, а в вершинах располагаются заместители.
В своей простейшей форме оптическая изомерия проявляется в тех случаях, когда соединение может существовать в двух пространственных модификациях.
Асимметричность характерна для молекул, не имеющих элементов симметрии. Элементами симметрии молекул являются: ось симметрии, плоскость симметрии, центр симметрии.
Атом углерода, связанный с четырьмя различными заместителями, называется асимметрическим. |
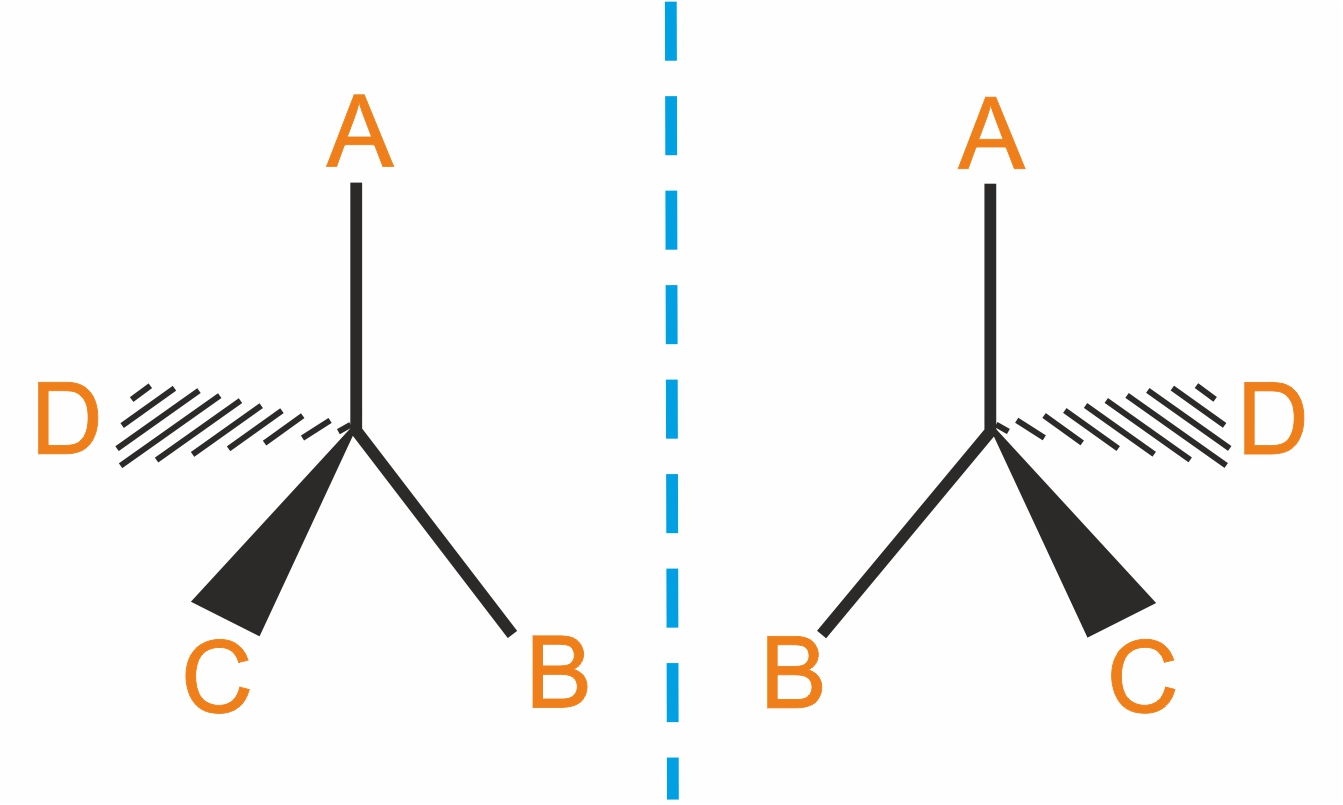
В таких молекулах их зеркальные изображения не могут быть совмещены друг с другом.
Если молекула не имеет элементов симметрии, то она асимметрична. Асимметричность (хиральность, от слова хиро — рука) — свойство объекта быть несовместимым со своим изображением в зеркале.
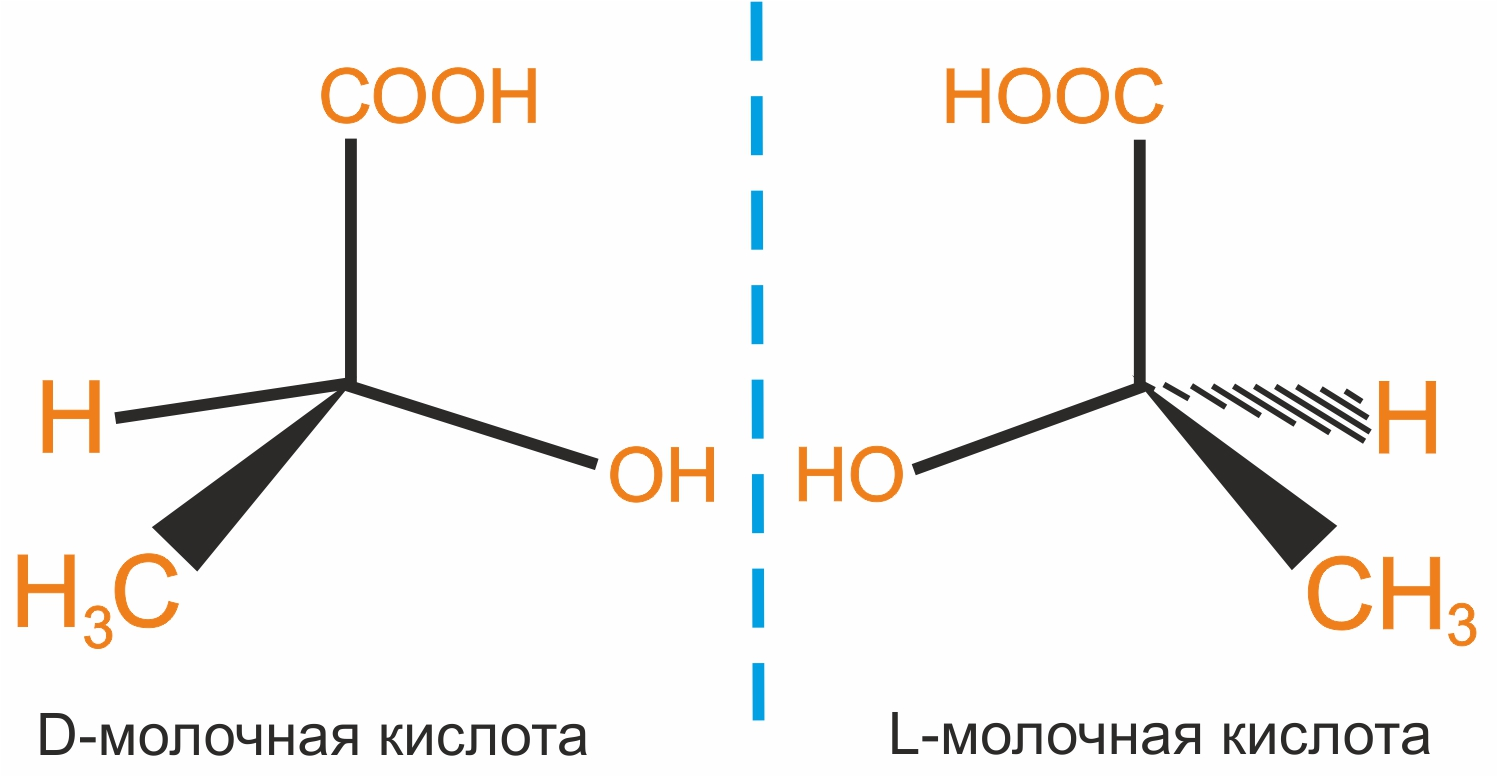
Строение молочной кислоты: в этой молекуле присутствует асимметрический атом углерода. Следовательно, эта молекула может существовать в виде двух изомеров, представленных на рисунке.
На плоскости зеркальные изомеры удобно изображать в виде проекционных формул Фишера.
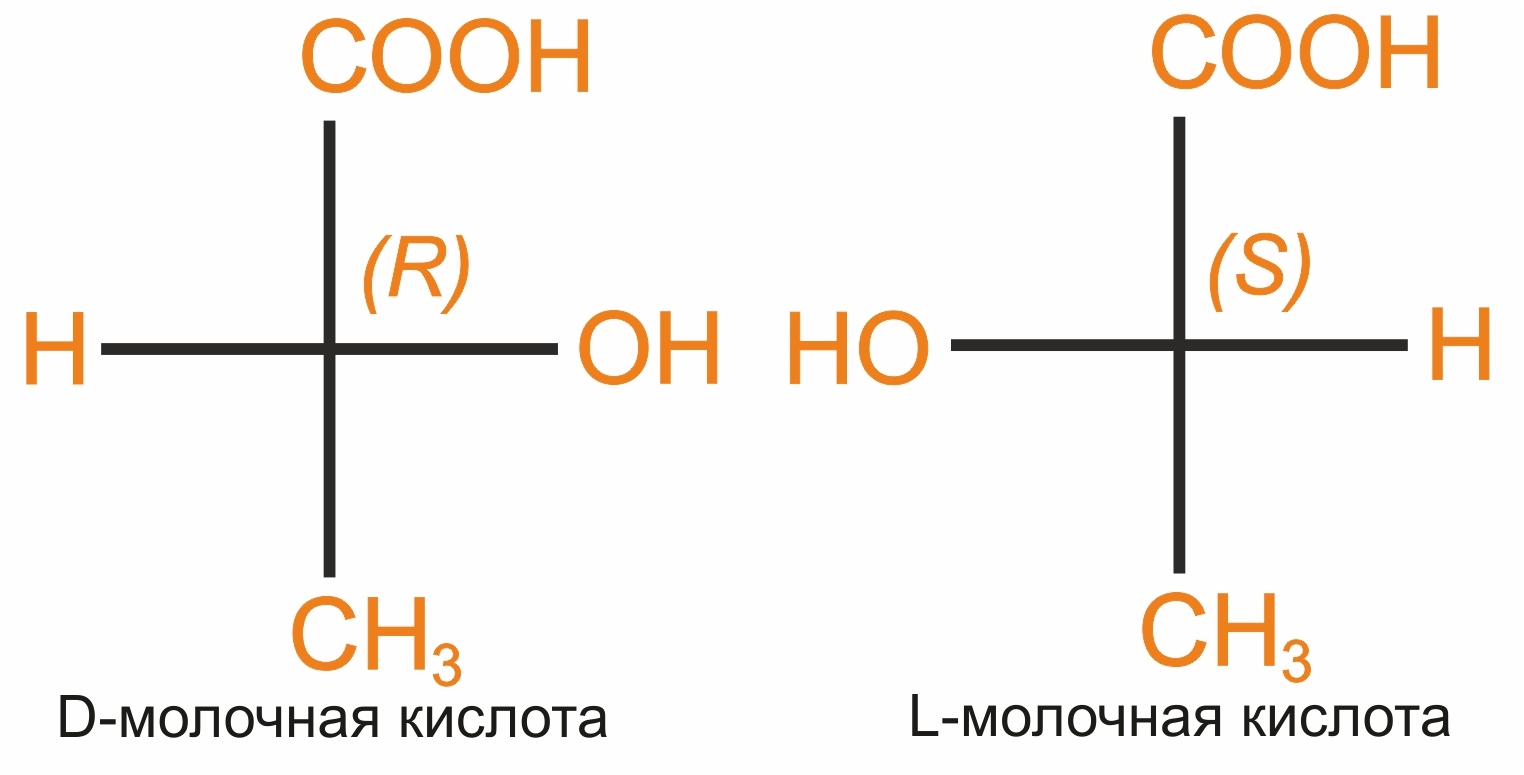
Структуры, которые содержат асимметрический углеродный атом, называются зеркальными изомерами (антиподы, энантиомеры). Зеркальные изомеры проявляют одинаковые физические и химические свойства, отличаются только отношением к плоскополяризованному свету. Зеркальные изомеры вращают плоскость поляризации на одинаковую величину, но в противоположных направлениях.
Понятие о плоскополяризованном свете
Обычный свет — совокупность электромагнитных волн, колебания которых расположены в различных направлениях плоскости, перпендикулярной направлению распространения луча. При прохождении света через призму Николя луч будет поляризоваться, т.е. его колебания происходят в определенной плоскости.
Общая схема поляриметра
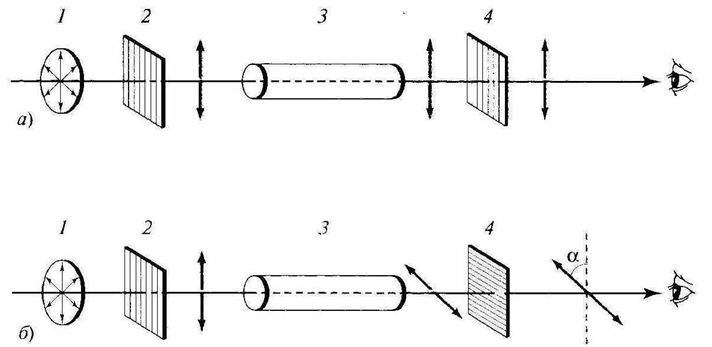
Оптическую активность веществ определяют при помощи поляриметра. Важнейшими частями прибора являются поляризатор (2) (неподвижно закрепленная призма) и анализатор (4) (призма, способная поворачиваться). На пути светового луча помещают кювету (3) с исследуемым веществом. Если вещество не проявляет оптической активности, то луч света проходит через нее без изменений. Однако если вещество проявляет оптическую активность, то по мере прохождения поляризованного света через кювету с веществом, плоскость поляризации будет поворачиваться на определенный угол. Это можно зарегистрировать путем поворота призмы анализатора.
Оптические изомеры — это пространственные изомеры, имеющие одинаковый количественный и качественный состав, одинаковое строение, одинаковые физические и химические свойства, но отличающиеся способностью вращать плоскополяризованный свет в противоположных направлениях.
Оптические изомеры, вращающие плоскость поляризации вправо, называют правовращающими и обозначают знаком «+», влево — левовращающими и обозначают знаком «-». По конфигурации оптические изомеры делят на 2 ряда: D-ряд (группа –ОН наиболее удаленного от окисленного атома углерода находится справа); L-ряд (данная группа –ОН находится слева).
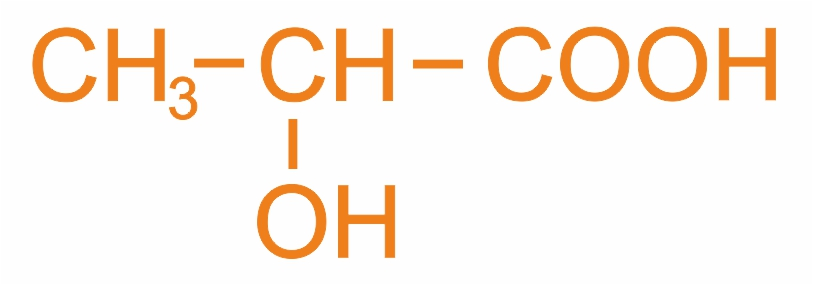
Номенклатура оксикислот используются как систематическая, так и рациональная номенклатуры; широко распространена тривиальная номенклатура, например:
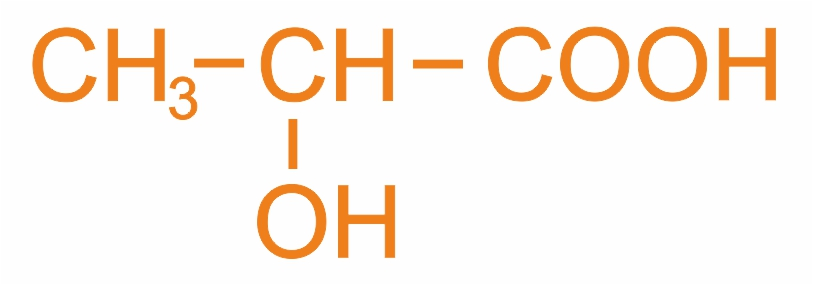
(м.н.) 2-оксипропановая кислота
(р.н.) α-оксипропионовая кислота
(т.н.) молочная кислота
![]() Важнейшие представители оксикислот
Важнейшие представители оксикислот
Название кислоты |
Формула |
Примечание |
Гидроксиэтановая (м.н.), оксиуксусная (р.н.), гликолевая кислота (т.н.) |
|
Содержится в незрелом винограде, свекле и других растениях |
2-гидрокспропановая (м.н.), α-оксипропионовая (р.н.), молочная кислота (т.н.) |
|
Содержится в мышечных тканях, кисло-молочных продуктах |
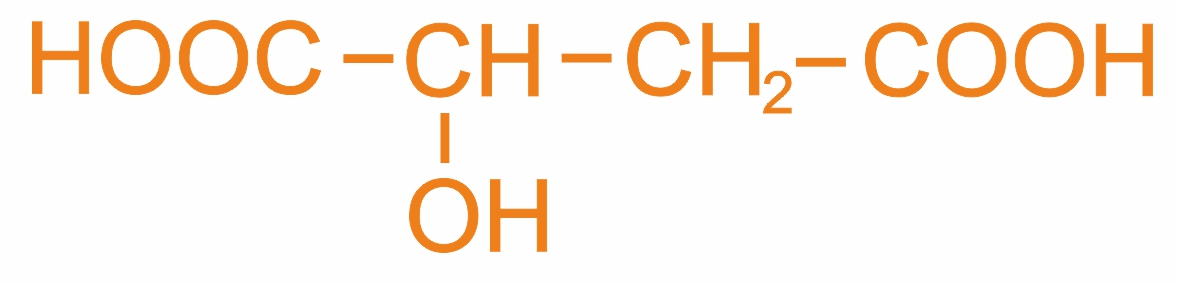
2-гидроксибутандиовая кислота (м.н.), α-оксиянтарная кислота (р.н.), яблочная кислота (т.н.) |
|
Встречается в кислых сортах яблок и других фруктах |
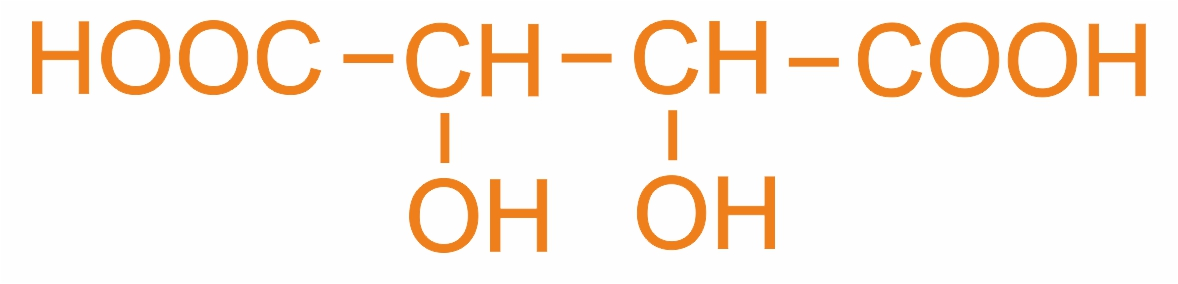
2,3-дигидроксибутандиовая, кислота (м.н.) винная кислота (т.н.) |
|
Содержится в винограде и других фруктах |
3–гидрокси-3-карбокси-пентандиовая (м.н.), лимонная (т.н.) |
|
Содержится в цитрусовых и других фруктах |
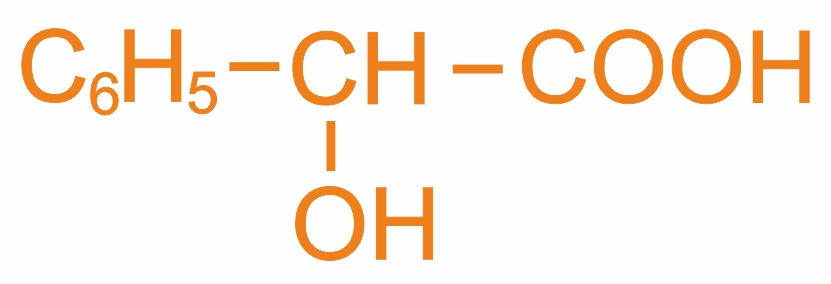
2-гидрокси-2-фенилэтановая кислота (м.н.), миндальная (т.н.) |
|
Содержится в гликозидах миндаля |
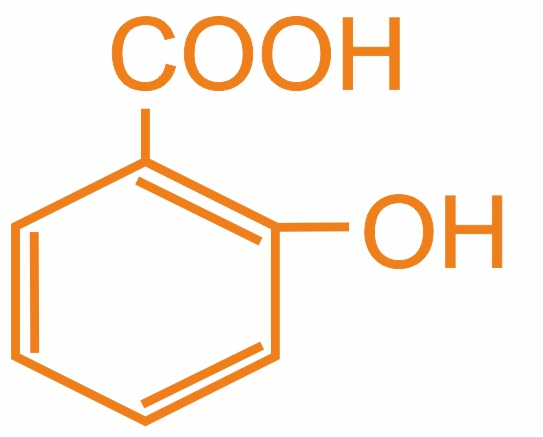
2-гидроксибензойная (м.н.), салициловая (т.н.) |
|
Соли применяются для консервирования, в фармации |
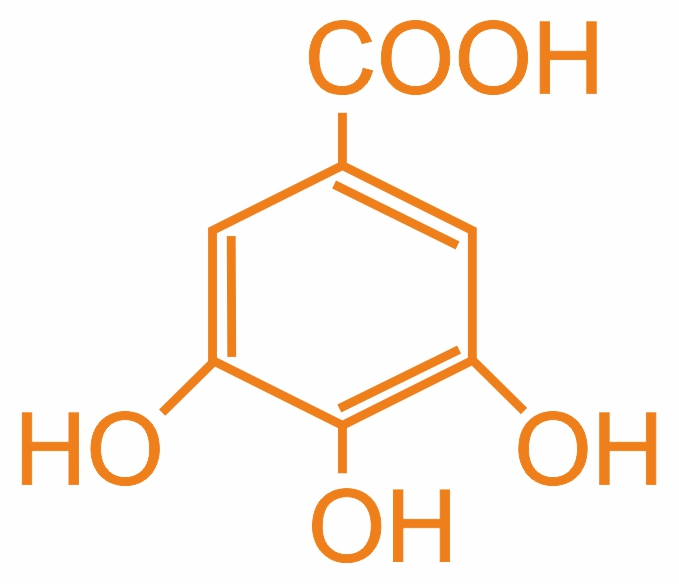
3,4,5-тригидроксибензойная (м.н.), галловая (т.н.) |
|
Встречается в дубовой коре, листьях чая |
Способы получения оксикислот
Получение α-оксикислот
1. |
|
2. |
Получение α-оксикислот гидролизом галогенкарбоновых кислот:
|
3. |
Окисление гликолей:
|
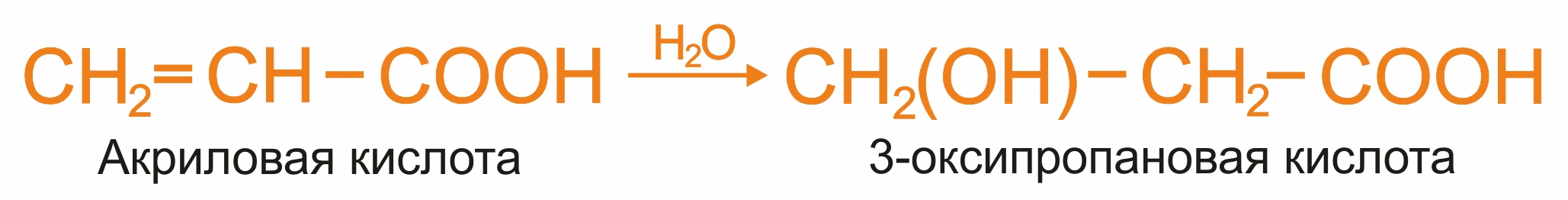
Получение β-оксикислот
1 |
|
2 |
Реакция Реформатского:
|
3 |
|
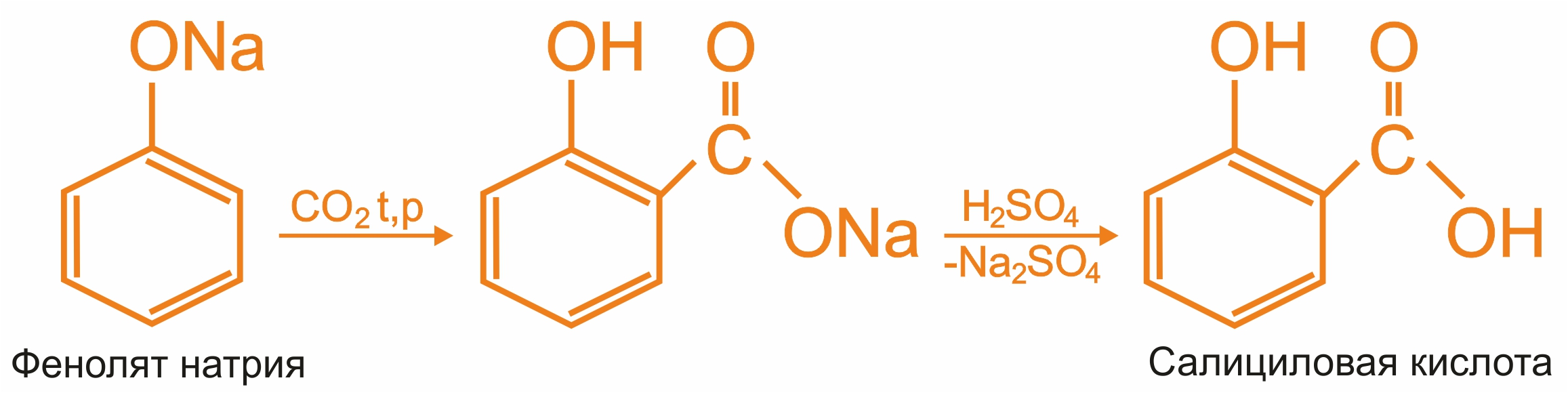
Получение фенолокислот
Физические свойства оксикислот
Оксикислоты — кристаллические вещества, растворимые в воде. Они плавятся при значительно более высоких температурах, чем предельные кислоты. Оксикислоты проявляют более высокие кислотные свойства.
Химические свойства оксикислот
Оксикислоты — бифункциональные соединения. |
Химические свойства оксикислот обусловлены природой функциональных групп. Они вступают в большинство реакций, характерных для карбоновых кислот и оксисоединений — спиртов и фенолов, а также возможны реакции, связанные с их взаимным влиянием.
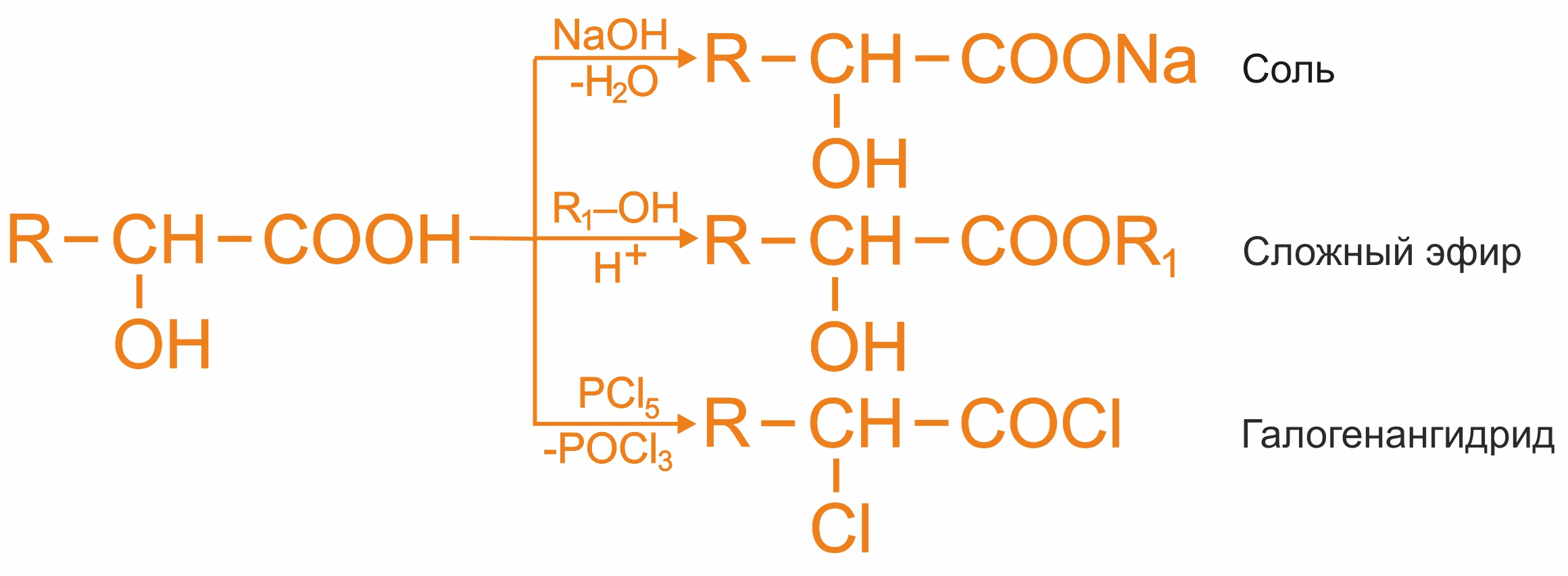
![]() Реакции по карбоксильной группе
Реакции по карбоксильной группе
![]() Реакции по гидроксильной группе (спиртовые свойства)
Реакции по гидроксильной группе (спиртовые свойства)
Оксикислоты жирного ряда дают все характерные реакции на гидроксильную группу: окисление вторичной спиртовой группы, замена спиртовой группы на галоген, образование простых эфиров, сложных эфиров:
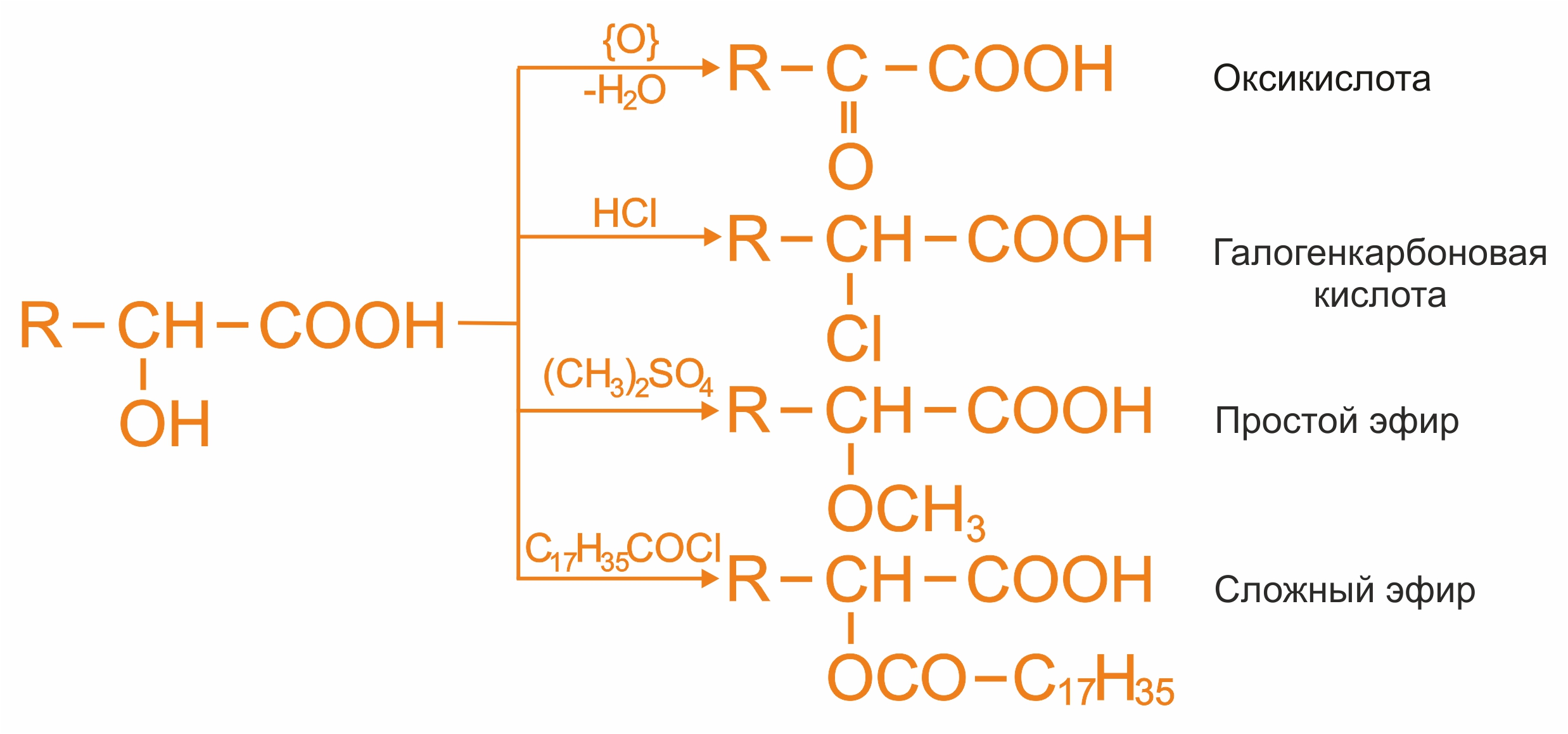
![]() Отношение оксикислот к нагреванию
Отношение оксикислот к нагреванию
α-оксикислоты при нагревании образуют циклический сложный эфир — лактид. Лактиды являются кристаллическими веществами и разлагаются при кипячении с кислотами или основаниями на исходные соединения:
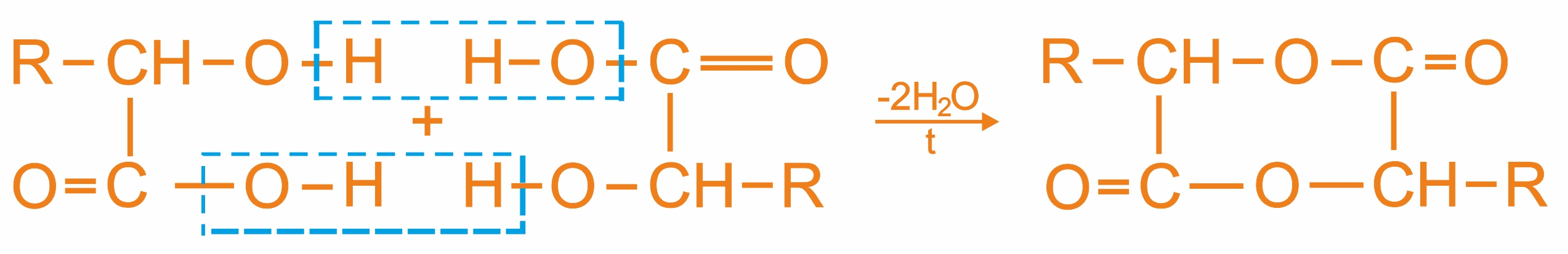
β-оксикислоты при нагревании теряют воду с образованием непредельных кислот:
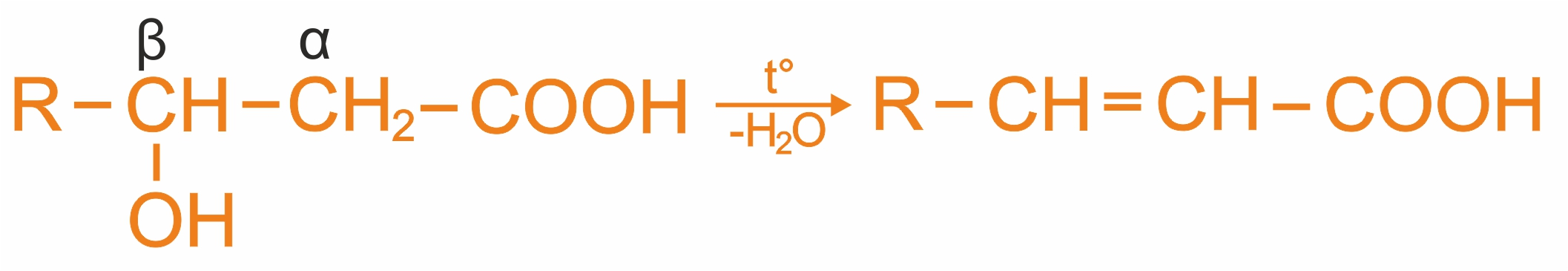
γ- и δ-оксикислоты при нагревании образуют внутренние сложные эфиры — лактоны:

Ароматические оксикислоты (фенолокислоты)
Фенолкарбоновые кислоты широко распространены в природе: дубильные вещества, гликозиды и т.д. Кроме салициловой и галловой кислот , в природе встречаются и другие фенолкарбоновые кислоты:
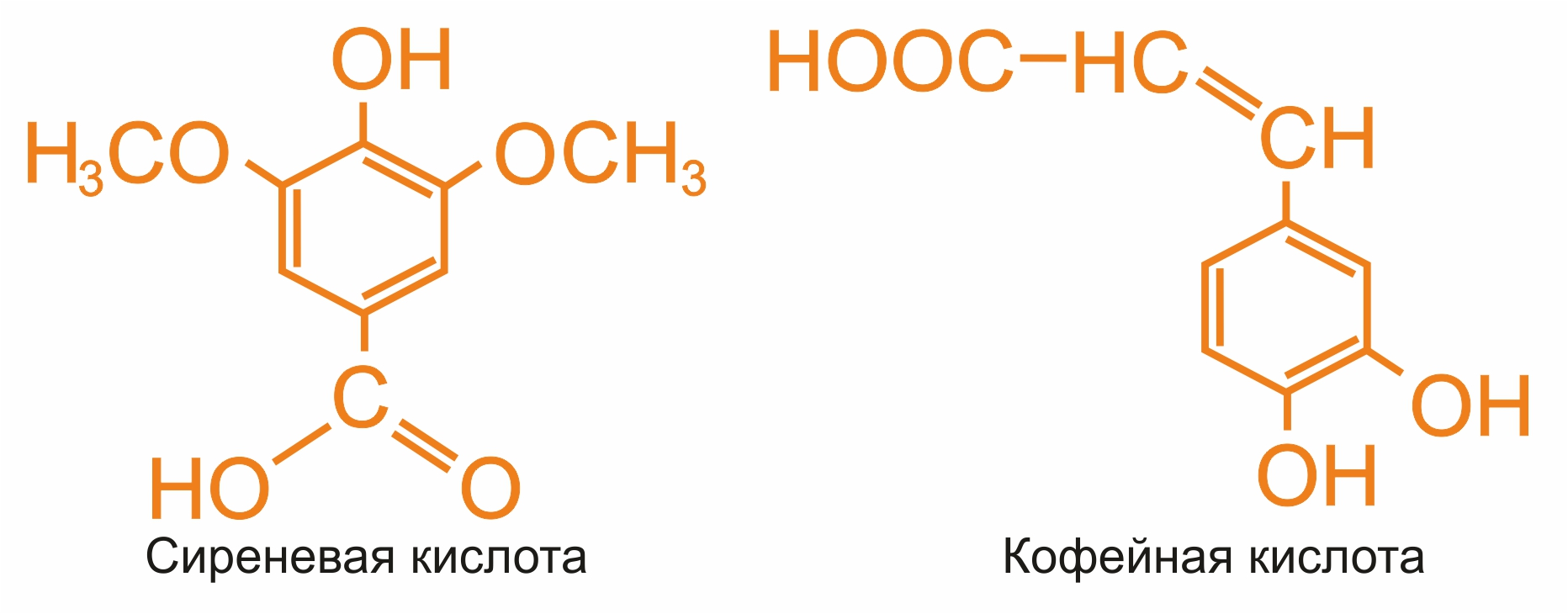
Фенолкарбоновые кислоты дают характерные реакции на фенольный гидроксил: реакции со щелочью, хлоридом железа (фиолетовое окрашивание) и т. д.
ОКСОКАРБОНОВЫЕ КИСЛОТЫ
Изомерия, номенклатура, примеры природных оксокислот
Оксокислотами называют соединения, содержащие в молекуле две функциональные группы: карбоксильную и оксогруппу (альдегидную или кетонную). Оксокислоты делятся на альдегидо- и кетокислоты. |
Важнейшие представители оксокислот
Формула |
Кислота |
Примечание |
|
Глиоксиловая (оксоэтановая) |
Содержится в недозрелых фруктах |
|
Пировиноградная (2-оксопропановая) |
Промежуточное соединение в биосинтезе углеводов и липидов |
|
Ацетоуксусная кислота (3-оксобутановая) |
Ацетоуксусный эфир используется при синтезе кислот и кетонов |
|
Левулиновая (4-оксопентановая) |
Образуется при распаде углеводов в кислых средах |
Получение оксокислот
Общие способы получения оксокислот
1. |
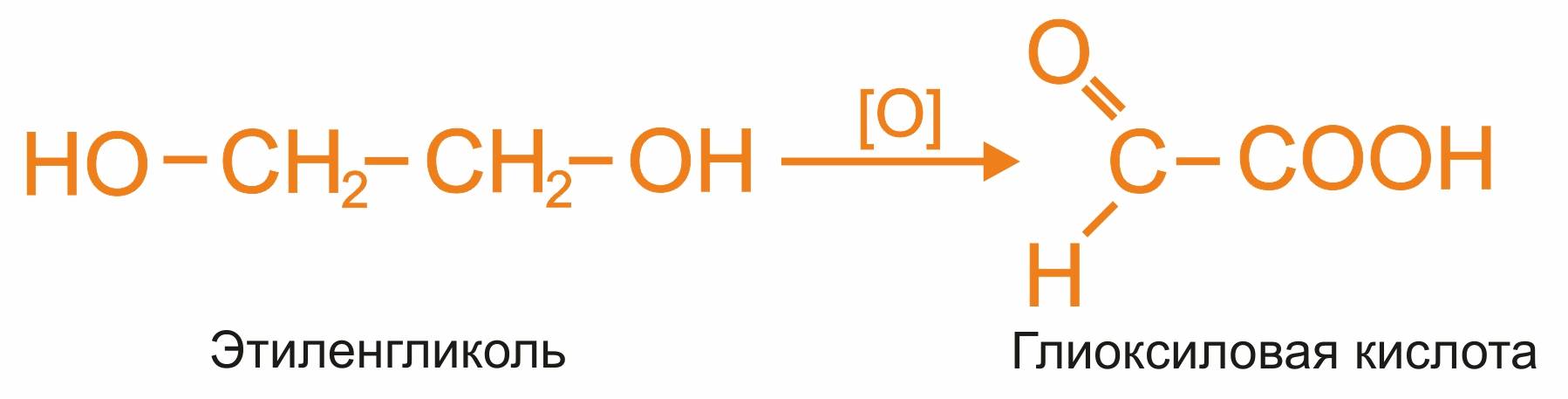
Окисление гликолей:
|
2. |
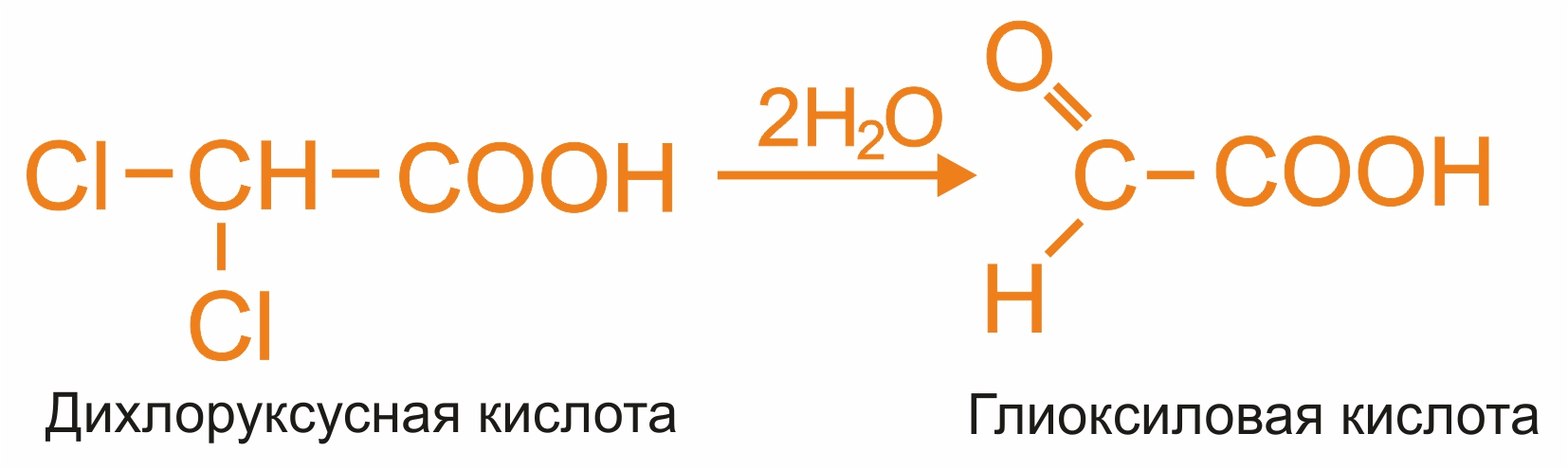
Гидролиз дигалогензамещенных кислот:
|
3. |
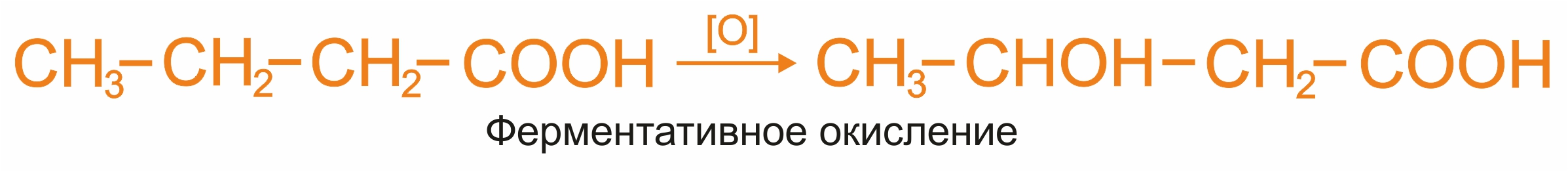
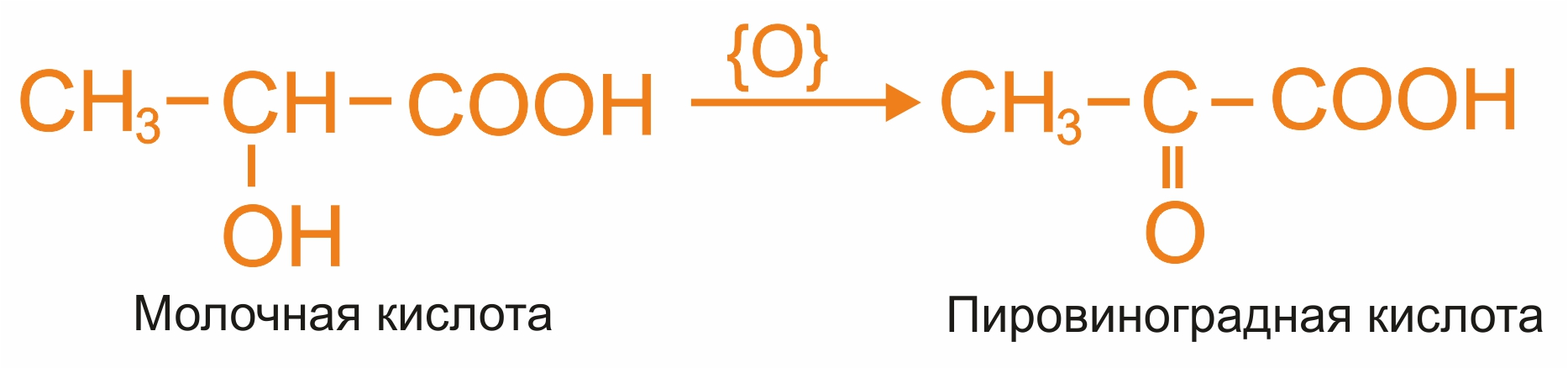
Окисление оксикислот:
|
Специальные способы получения оксокислот
4. |
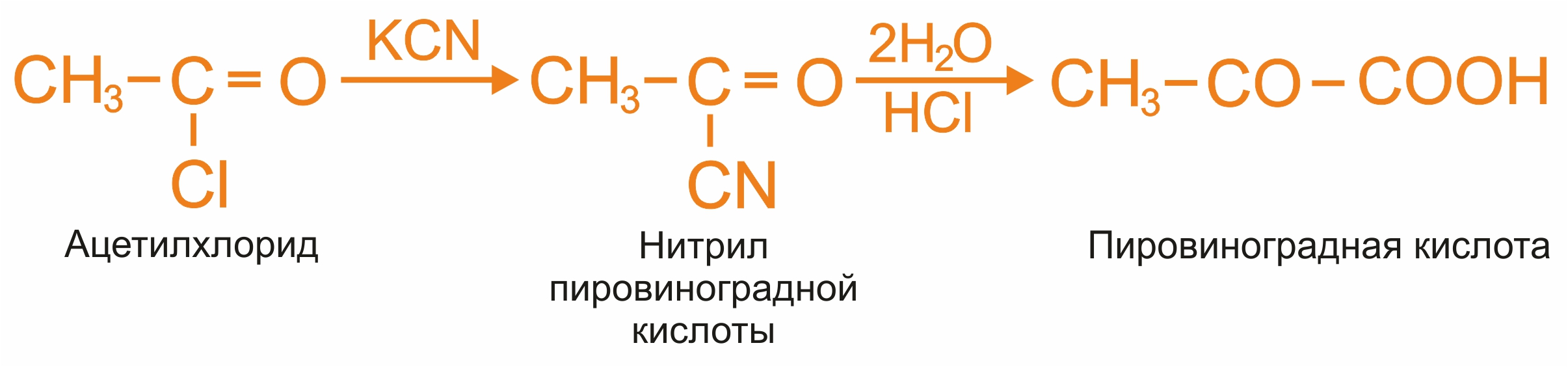
Взаимодействие ацилгалогенидов с цианидами:
|
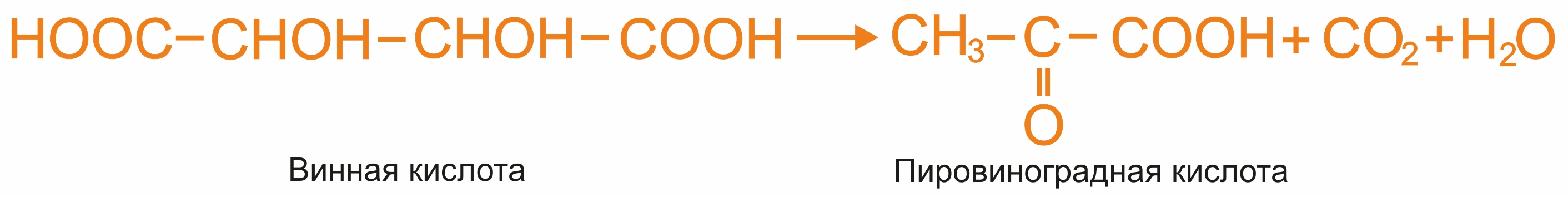
5. |
Пиролиз винной кислоты:
|
Химические свойства оксокислот
Реакции по карбонильной группе
Оксокислоты дают все типичные реакции на альдегидную и кетонную группы: с гидразином, гидроксиламином, аммиаком, синильной кислотой, гидросульфитом натрия, реактивом Гриньяра и другие реакции.
Например:
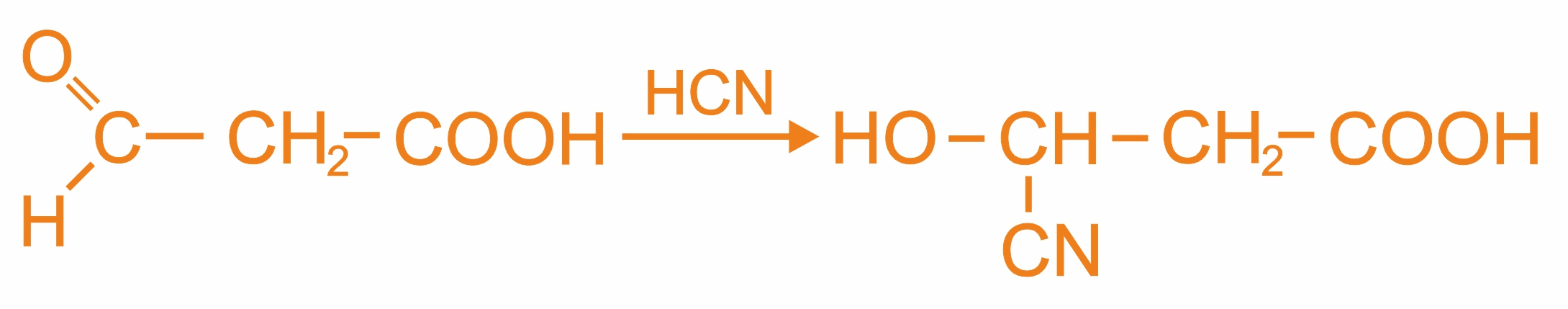
При взаимодействии оксокислоты с синильной кислотой идет реакция оксинитрильного синтеза.
Реакции по карбоксильной группе
Оксокислоты дают все типичные реакции на карбоксильную группу: образование солей, галогенангидридов, ангидридов, амидов, сложных эфиров, другие реакции. Оксокислоты проявляют более сильные кислотные свойства, чем обычные карбоновые кислоты, из-за акцепторного влияния оксогруппы.
Реакции нагревания оксокислот
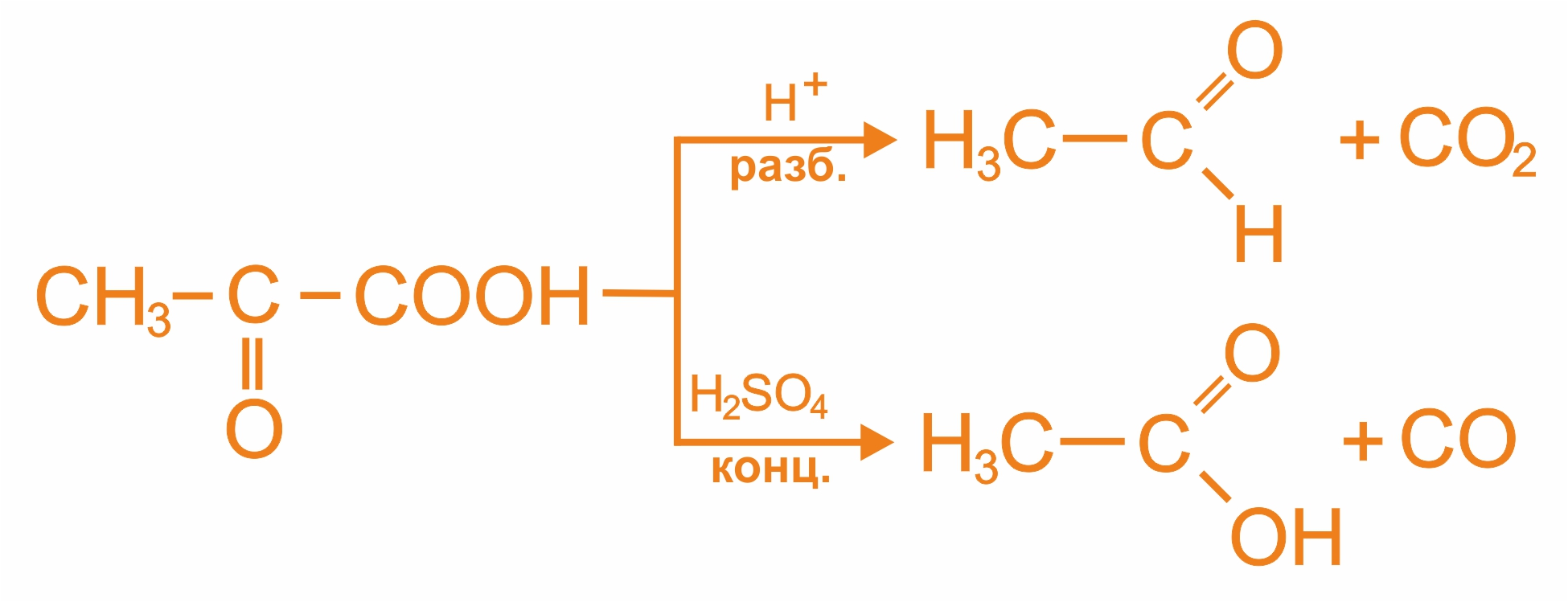
α-оксокислоты при нагревании с минеральными кислотами декарбоксилируются:
Отличие альдегидокислот от кетокислот
Альдегидокислоты в отличие от кетокислот дают характерные реакции на альдегидную группу, например: реакцию «серебряного зеркала», реакцию Фелинга.
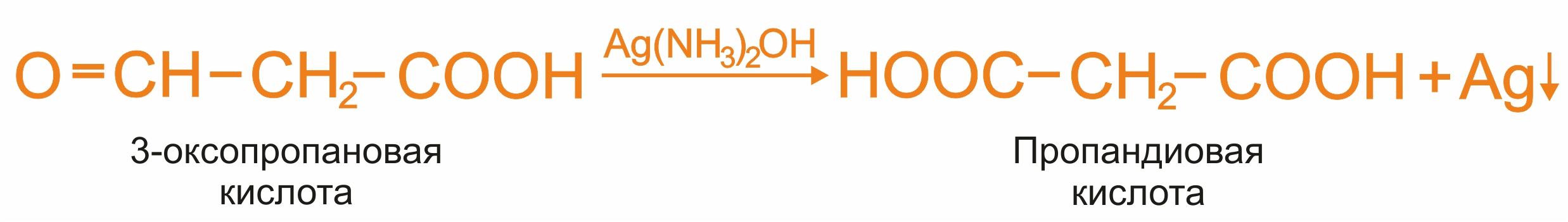
Ацетоуксусный эфир — первое из органических соединений, на примере которого впервые было изучено явление таутомерии.
Таутомерия — это подвижная, динамическая изомерия, сосуществование изомерных форм, находящихся в равновесии и способных переходить друг в друга (динамические изомеры). |
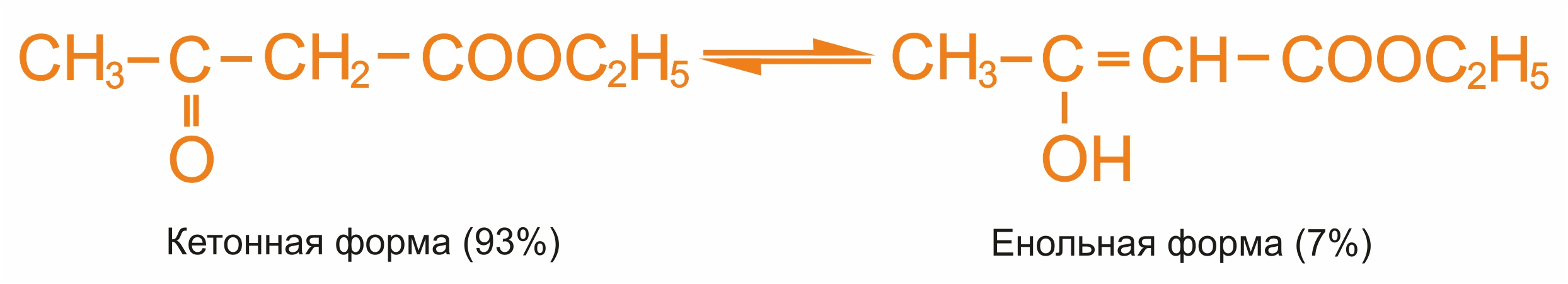
Такой вид таутомерии называют кето-енольной, он является частным случаем таутомерии с переходом водорода. В ацетоуксусном эфире имеется подвижный водород в метиленовой группе СН2, подвижность водорода объясняется влиянием оксогруппы и сложноэфирной группы.
Реакции кетонной формы
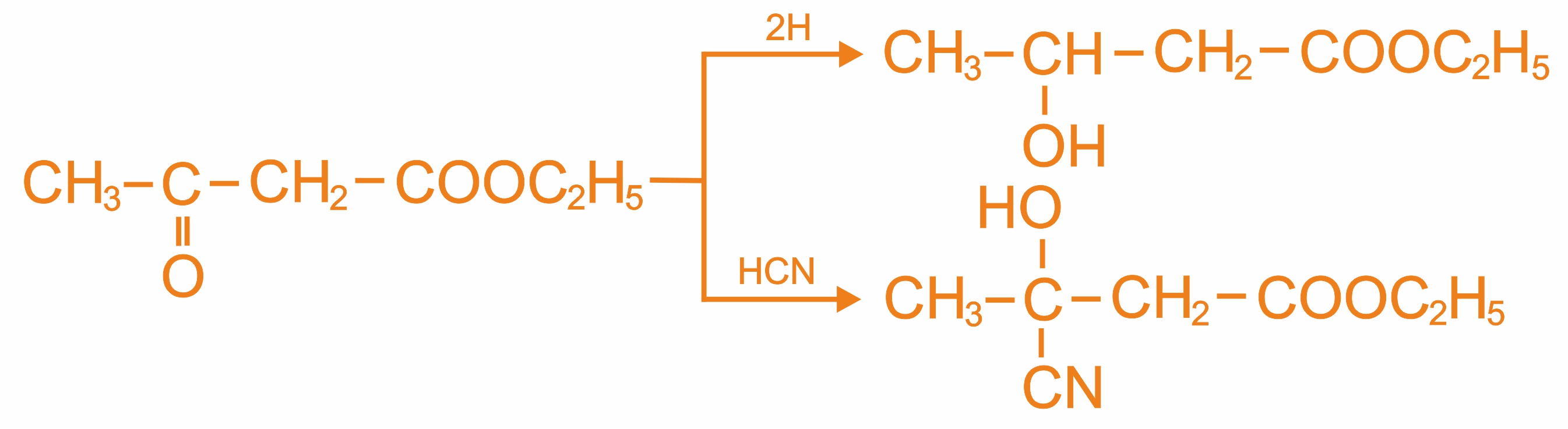
Реакции енольной формы
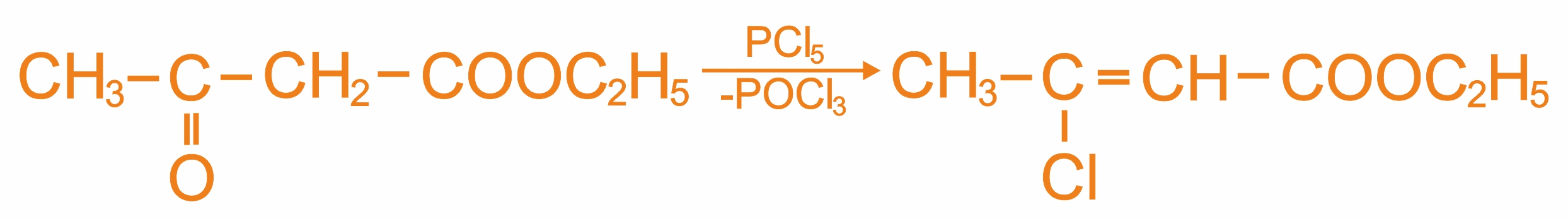
При реакции енольной формы ацетоуксусного эфира с пентахлоридом фосфора происходит замещение гидроксильной группы на галоген.
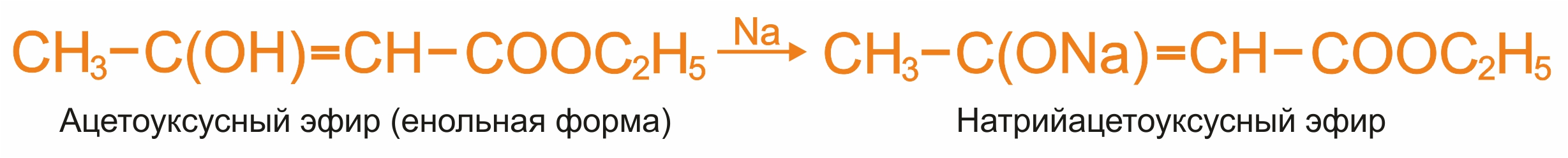
Алкилирование и ацилирование ацетоуксусного эфира
При алкилировании и ацилировании используют натрийацетоуксусный эфир, который получают при действии натрия на ацетоуксусный эфир.
При алкилировании и ацилировании натрийацетоуксусного эфира идут реакции с переносом реакционного центра:
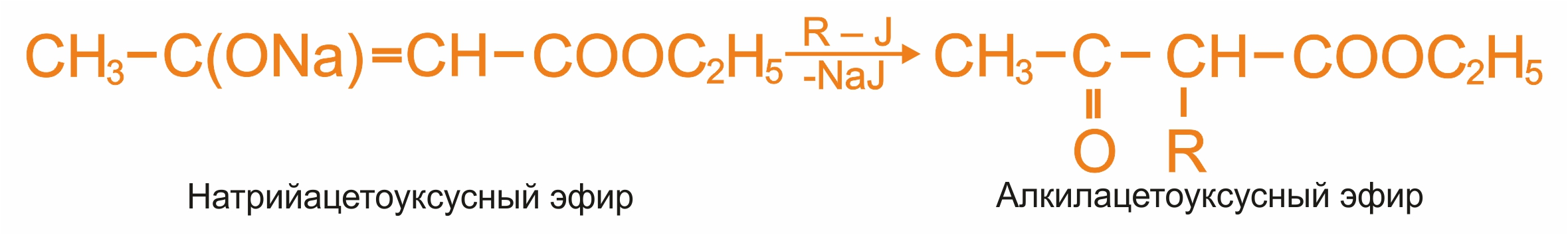
Ацетоуксусный эфир можно использовать для получения кетонов и кислот.
Кетонное расщепление ацетоуксусного эфира
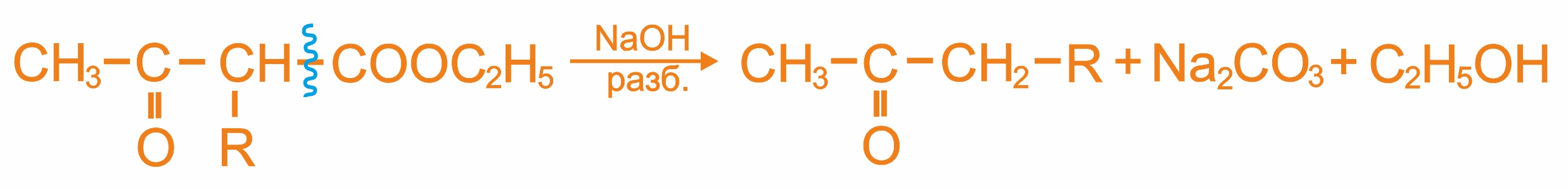
Кислотное расщепление ацетоуксусного эфира