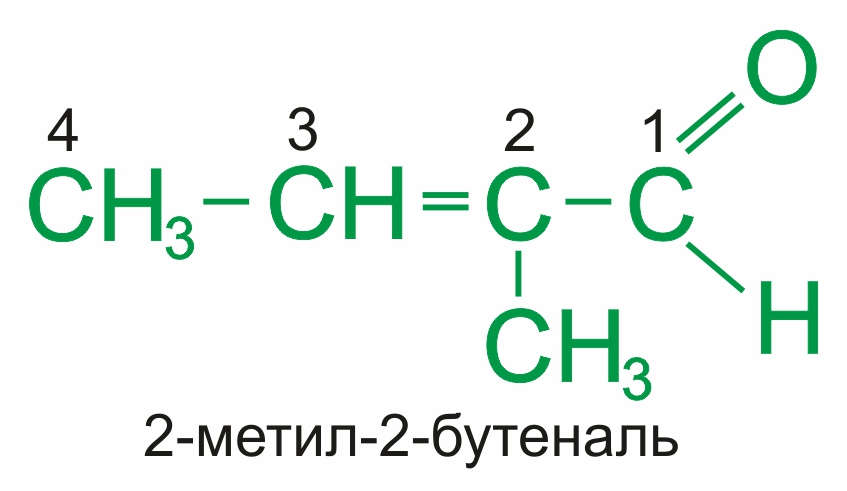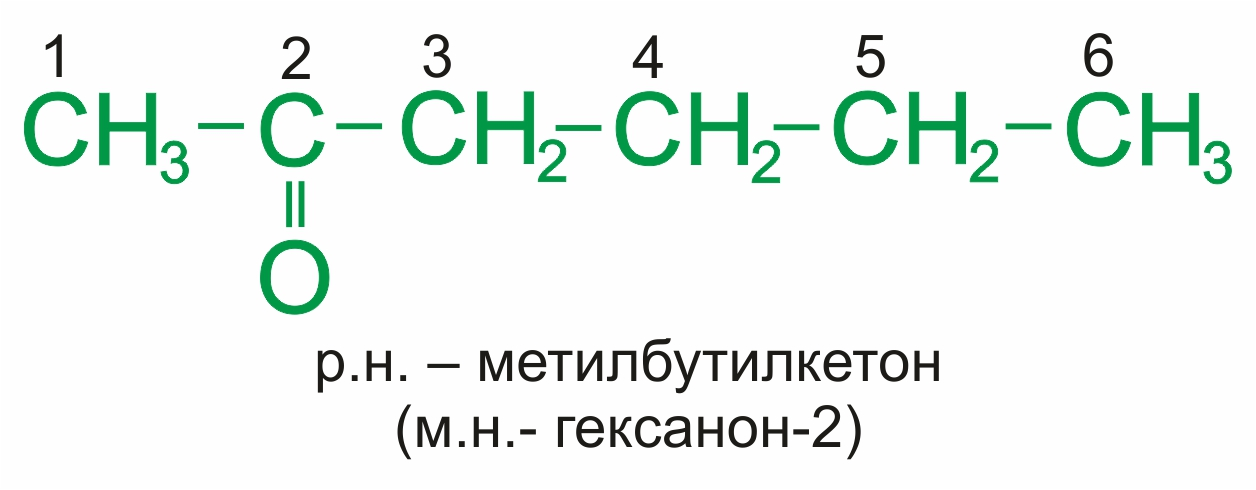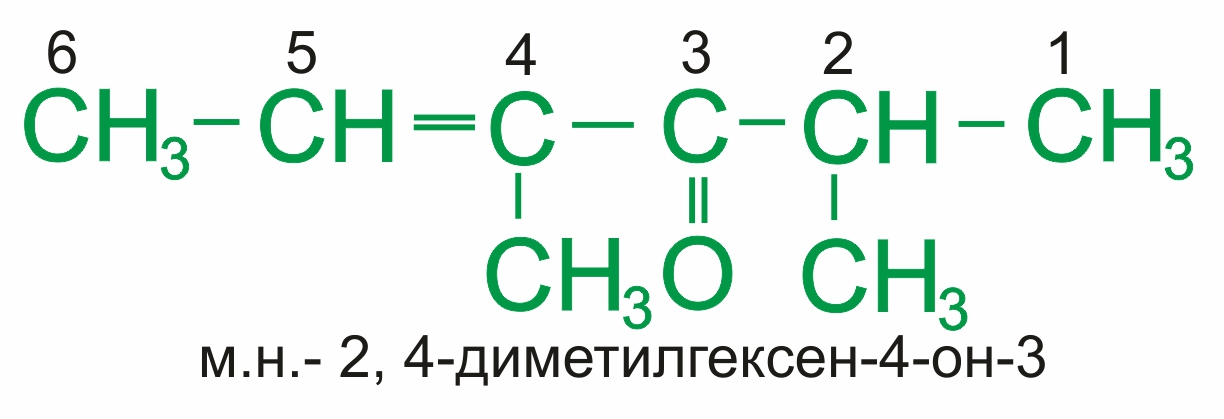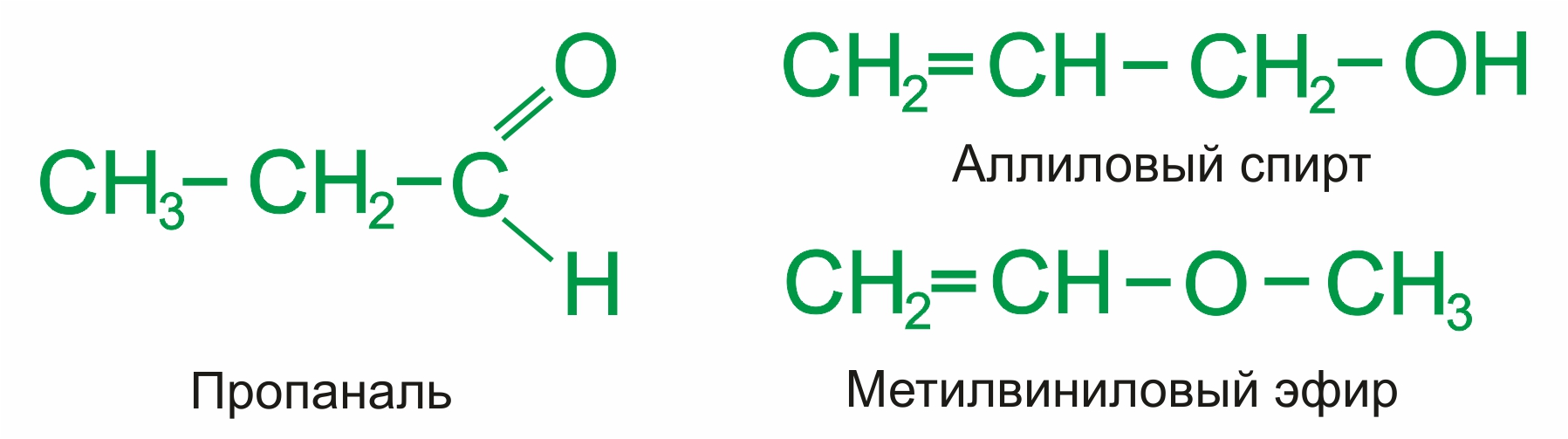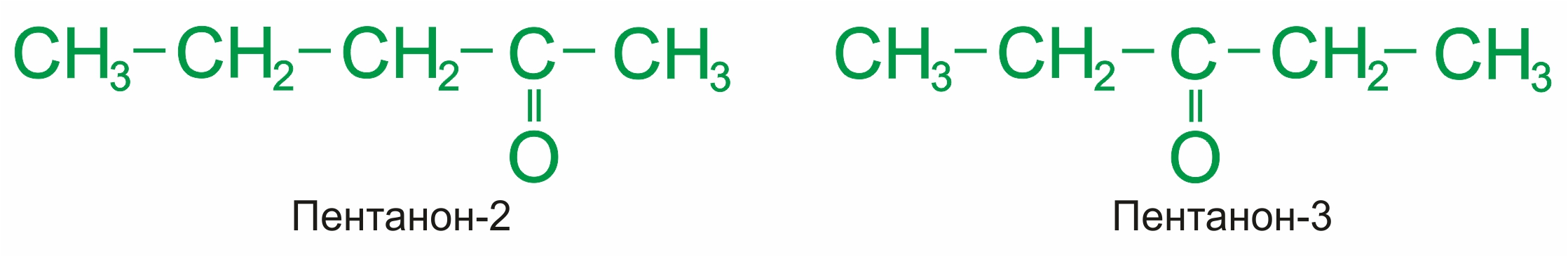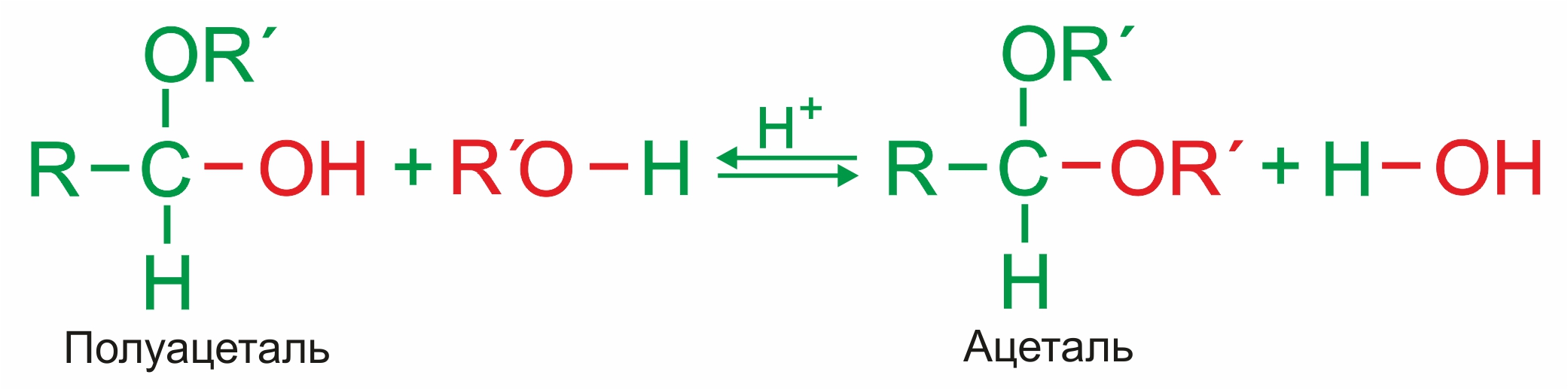Органическая химия

Тема 3.3. АЛЬДЕГИДЫ и КЕТОНЫ (карбонильные соединения)
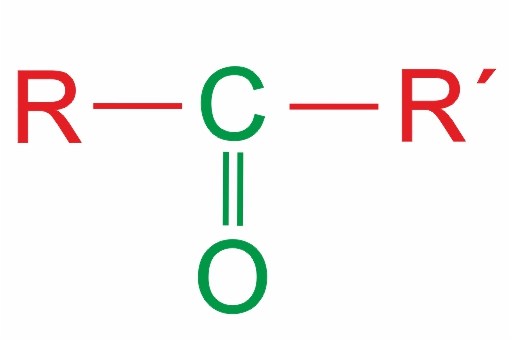
Органические соединения, в молекуле которых имеется карбонильная группа >С=O, называются карбонильными соединениями, или оксосоединениями. |
Общая формула карбонильных соединений:
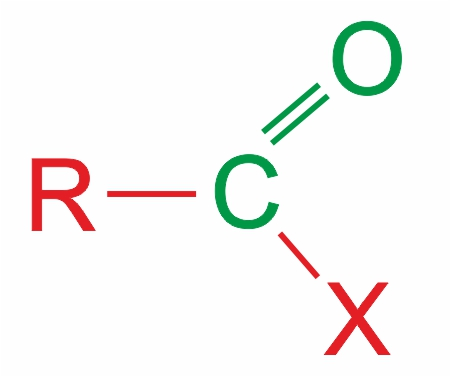
В зависимости от типа заместителя Х эти соединения подразделяют на:
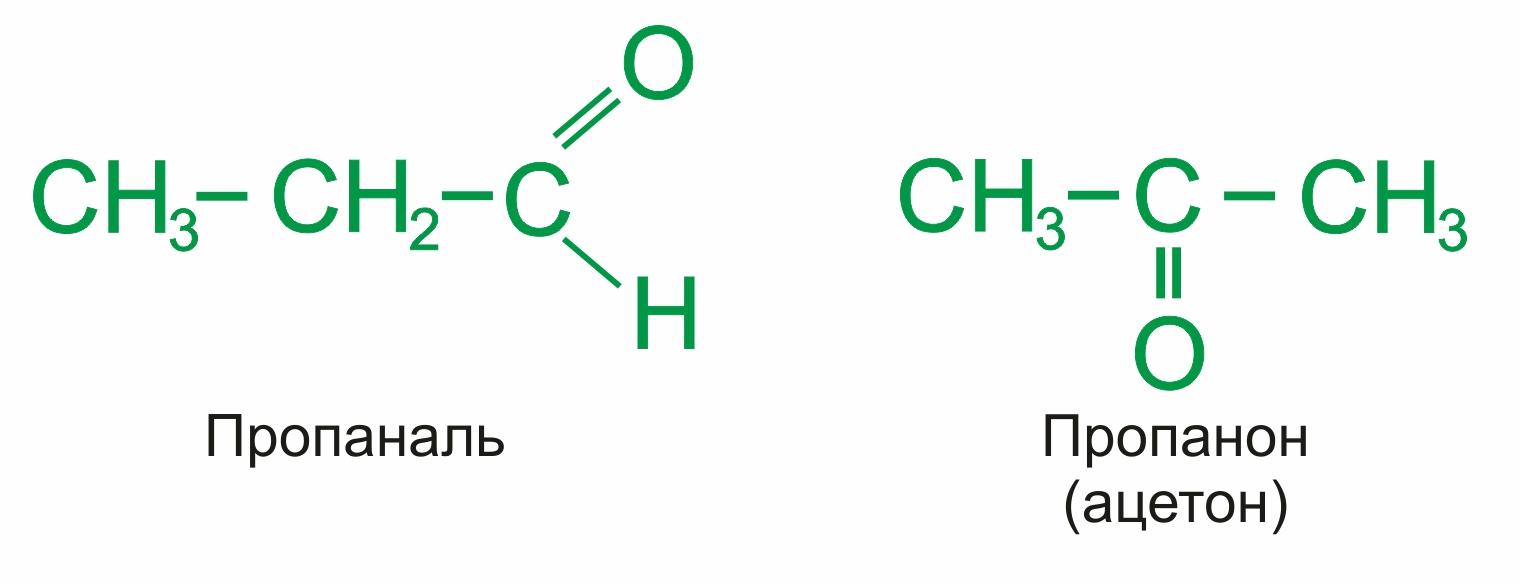
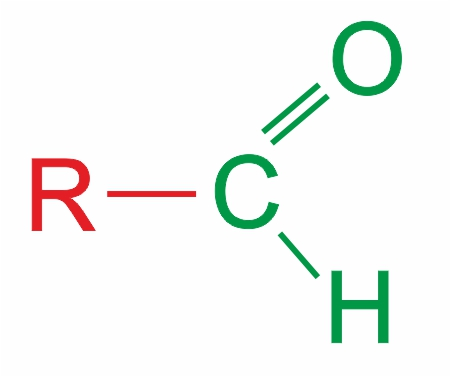
![]() Альдегиды — органические соединения, в молекулах которых атом углерода карбонильной группы (карбонильный углерод) связан с атомом водорода.
Альдегиды — органические соединения, в молекулах которых атом углерода карбонильной группы (карбонильный углерод) связан с атомом водорода.
Общая формула: R–CН=O, в развернутом виде:
Кетоны — органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами. |
Общие формулы: R2C=O, R–CO–R', в развернутом виде
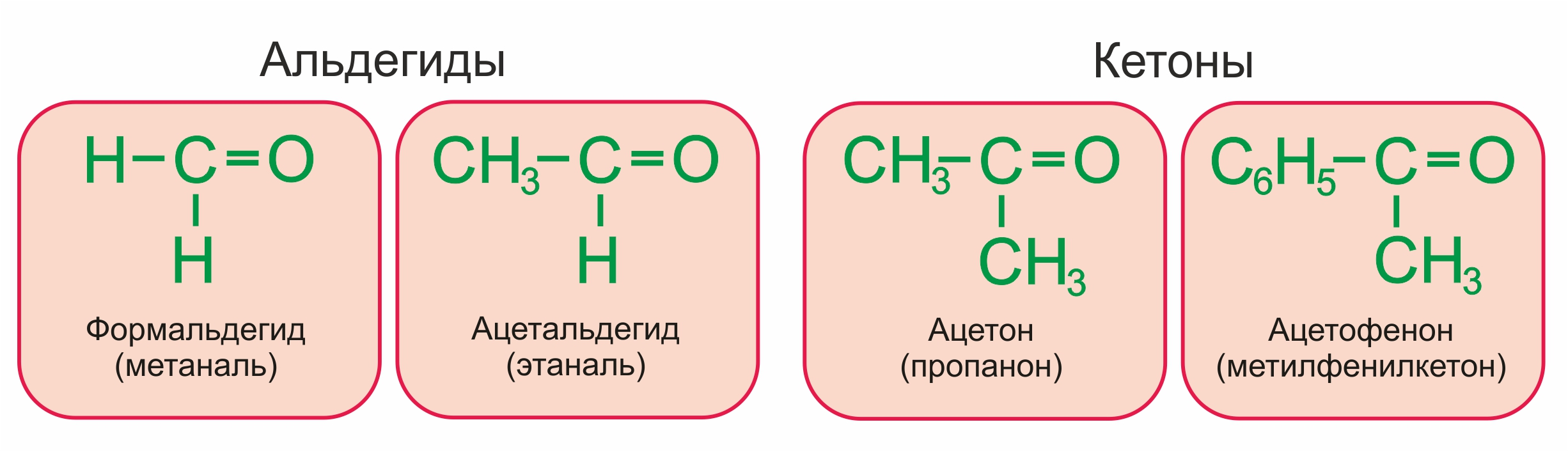
Примеры:
Модели простейших карбонильных соединений |
||
Название |
Формула |
Модель |
Формальдегид (метаналь) |
H2C=O |
|
Ацетальдегид (этаналь) |
СH3-CH=O |
|
|
(пропанон) |
(СH3)2C=O |
|
![]() Номенклатура альдегидов и кетонов
Номенклатура альдегидов и кетонов
Для альдегидов очень распространены тривиальные названия, они связаны с тривиальными названиями кислот с тем же углеродным скелетом, в которые превращается альдегид при окислении, например, муравьиный альдегид H2C=O; уксусный альдегид СH3-CH=O и т.д.
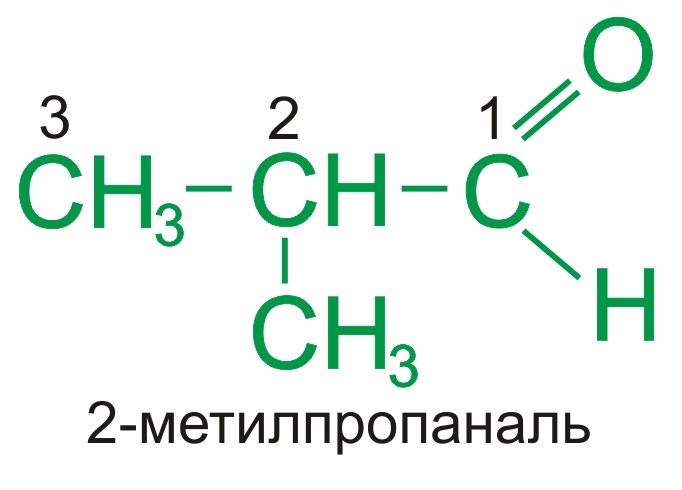
По международной номенклатуре ИЮПАК наличие альдегидной группы обозначается суффиксом –аль, который добавляется к соответствующему алкану с тем же количеством атома углерода:
|
|
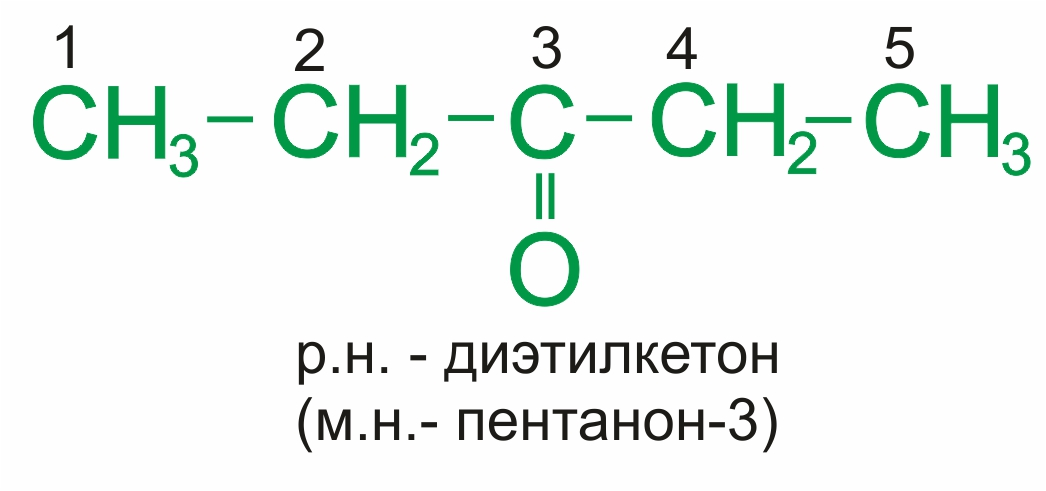
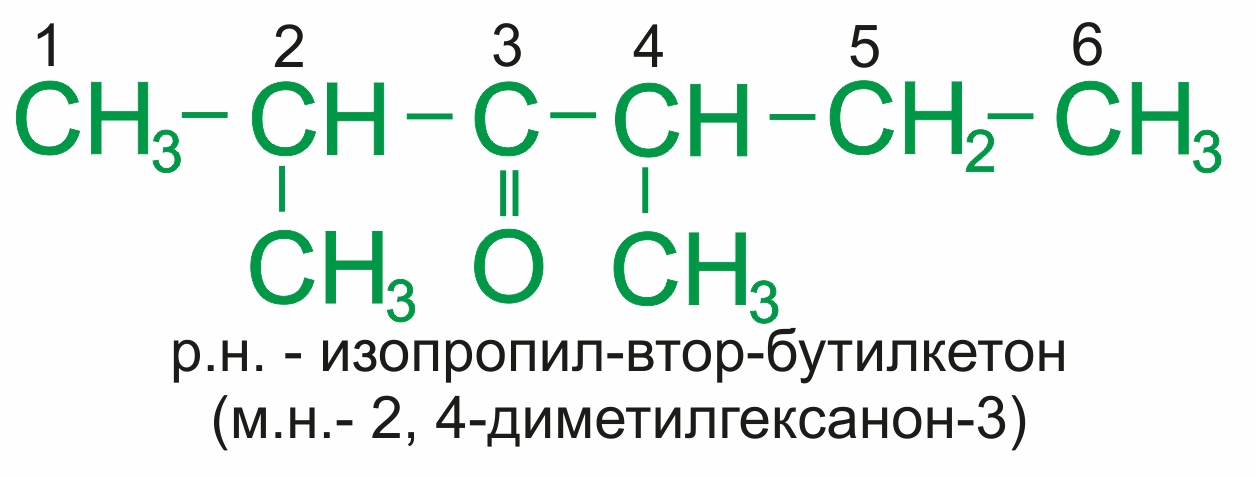
Для кетонов часто применяют названия по рациональной номенклатуре, которые составляются из названий радикалов, связанных с карбонильной группой, и слова кетон. При использовании международной номенклатуры ИЮПАК к названию соответствующего алкана добавляется суффикс –он и цифра.
Примеры:
|
|
|
|
При наличии более старшей группы кетонная группа обозначается префиксом оксо-:
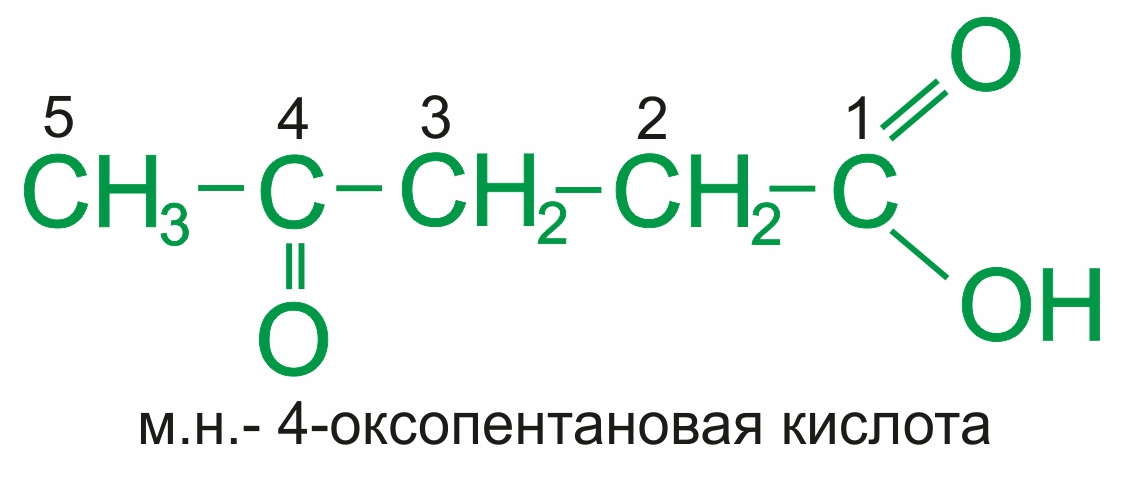
Изомерия альдегидов и кетонов
1. |
Изомерия альдегидов: |
|
• |
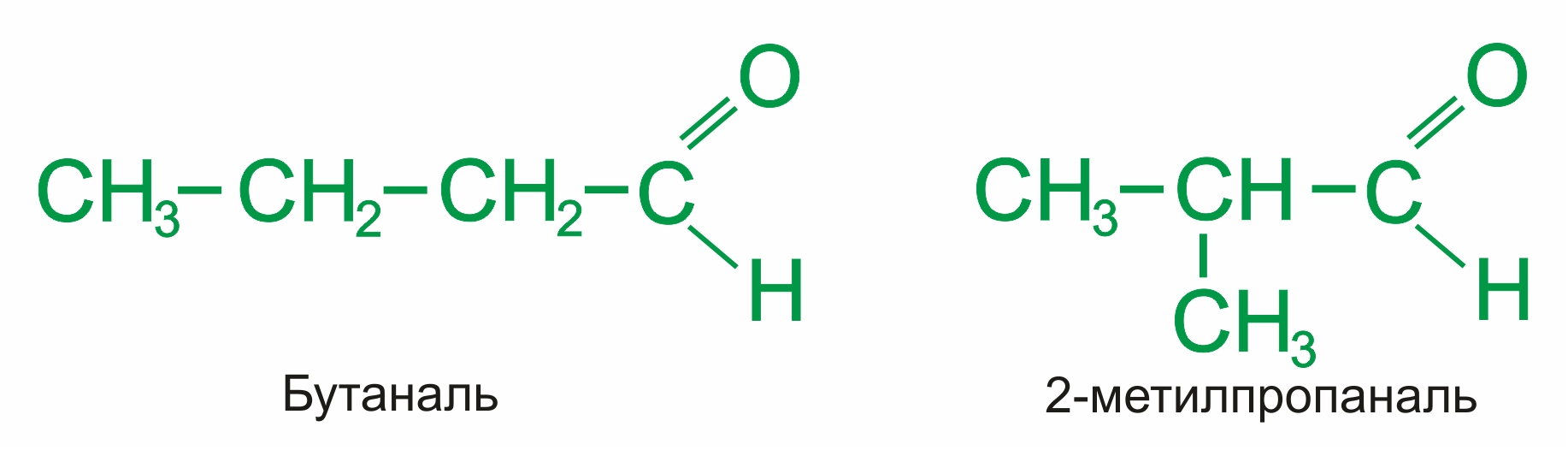
изомерия углеродного скелета, начиная с С4:
|
|
• |
межклассовая изомерия с кетонами, начиная с С3:
и с непредельными спиртами и простыми эфирами (с С3):
|
|
2. |
Изомерия кетонов: |
|
• |
углеродного скелета (c C5):
|
|
• |
положения карбонильной группы (c C5):
|
|
• |
межклассовая изомерия (аналогично альдегидам). |
|
Способы получение альдегидов и кетонов
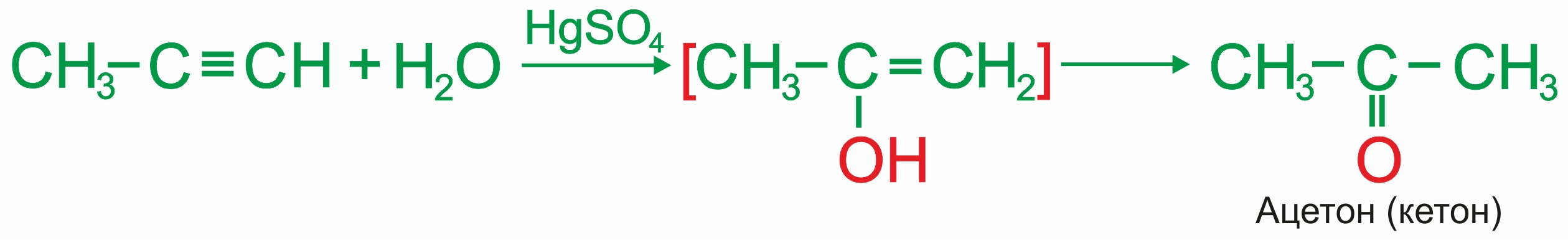
1. |
Гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей Нg2+. Данная реакция называется реакция Кучерова. |
|
• |
Ацетилен по реакции Кучерова образует ацетальдегид СН3СНО:
|
|
• |
|
|
2. |
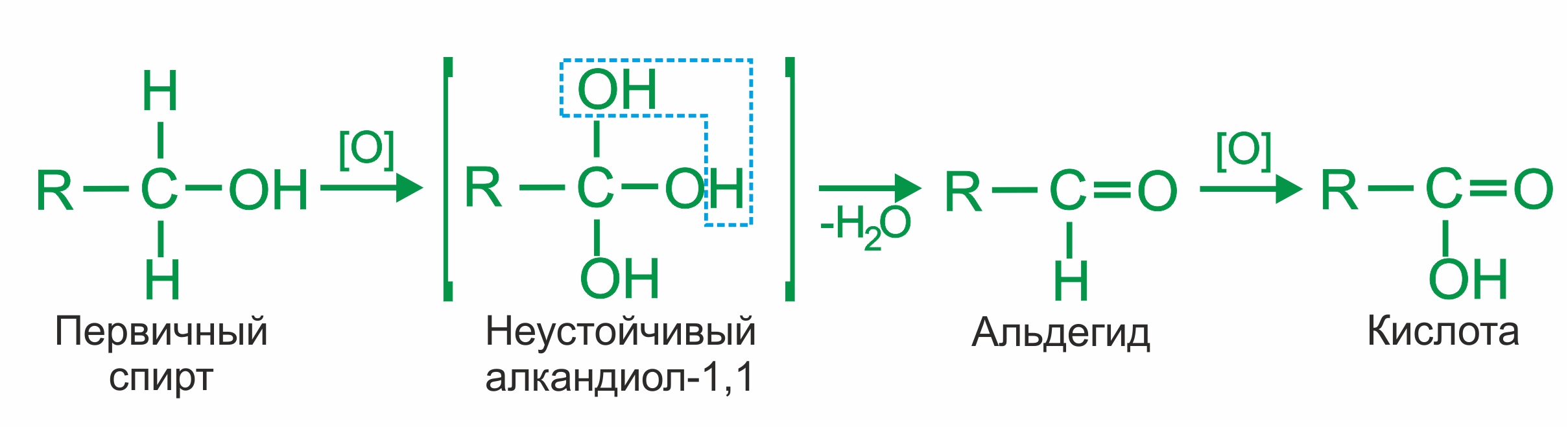
Окисление спиртов. |
|
• |
При окислении первичных спиртов образуются альдегиды:
|
|
• |
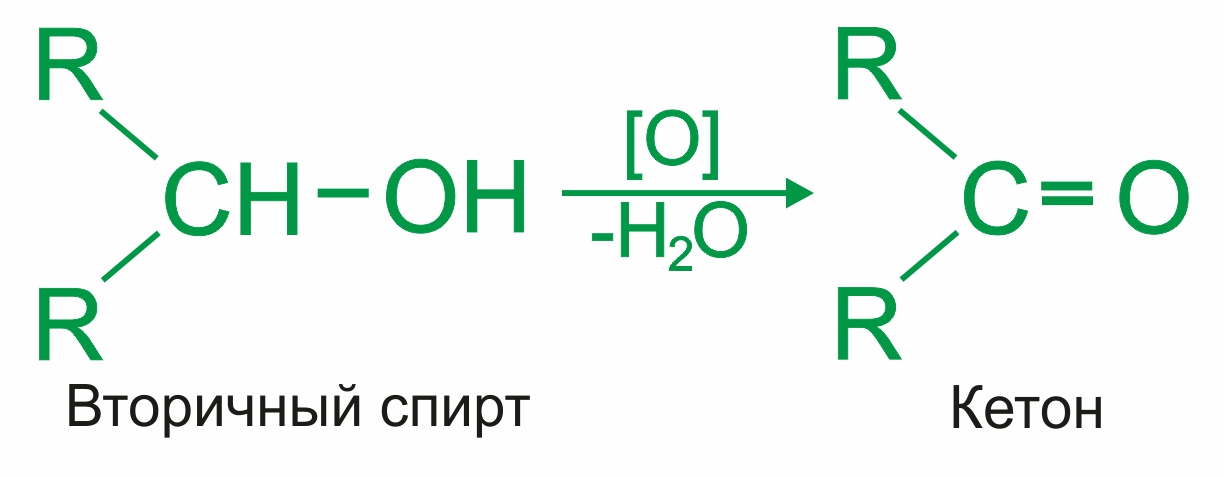
При окислении вторичных спиртов образуются кетоны:
|
|
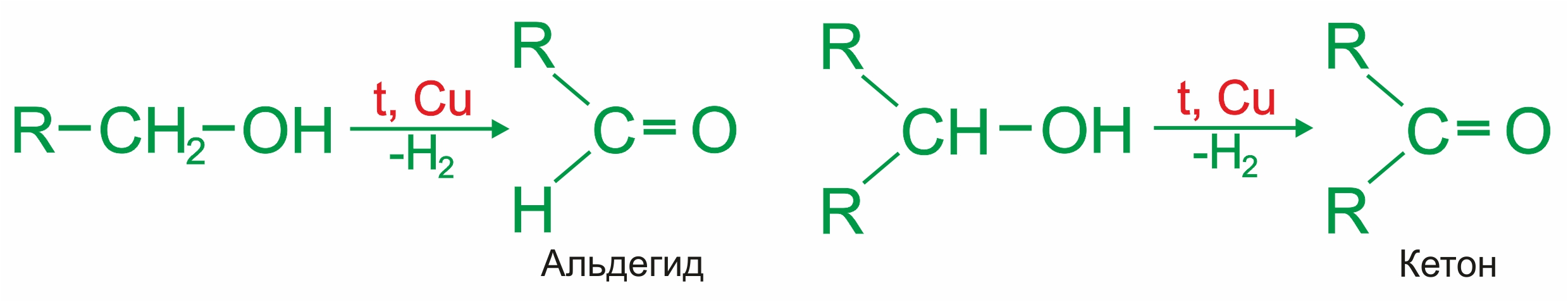
3. |
Промышленный способ получения альдегидов и кетонов — дегидрированием спиртов, в присутствии катализаторов и при нагревании:
|
|
Физические свойства альдегидов и кетонов
Оксосоединения не способны образовывать водородные связи, поэтому их температуры кипения значительно ниже, чем соответствующих спиртов.
Температуры кипения кетонов обычно бывают несколько выше, чем изомерных им альдегидов. В обычных условиях только формальдегид является газом, альдегиды С2–C5 и кетоны С3–C4 — жидкости, высшие — твердые вещества. Формальдегид имеет резкий неприятный запах. Средние гомологи ряда альдегидов обладают устойчивым характерным запахом (альдегидный запах).
Высшие альдегиды (С7–С16) обладают приятным запахом и широко используются в парфюмерии.
Формальдегид хорошо растворим в воде, его 40%-й водный раствор называют формалином.
Ацетальдегид (этаналь) также хорошо растворим в воде.
Ацетон (пропанон, или диметилкетон) — бесцветная жидкость, хорошо растворимая в воде, спирте и эфире. Это широко используемый органический растворитель, он хорошо растворяет жиры, смолы и многие другие органические вещества.
Химические свойства альдегидов и кетонов
1. |
Присоединение по карбонильной группе —С=О. |
|
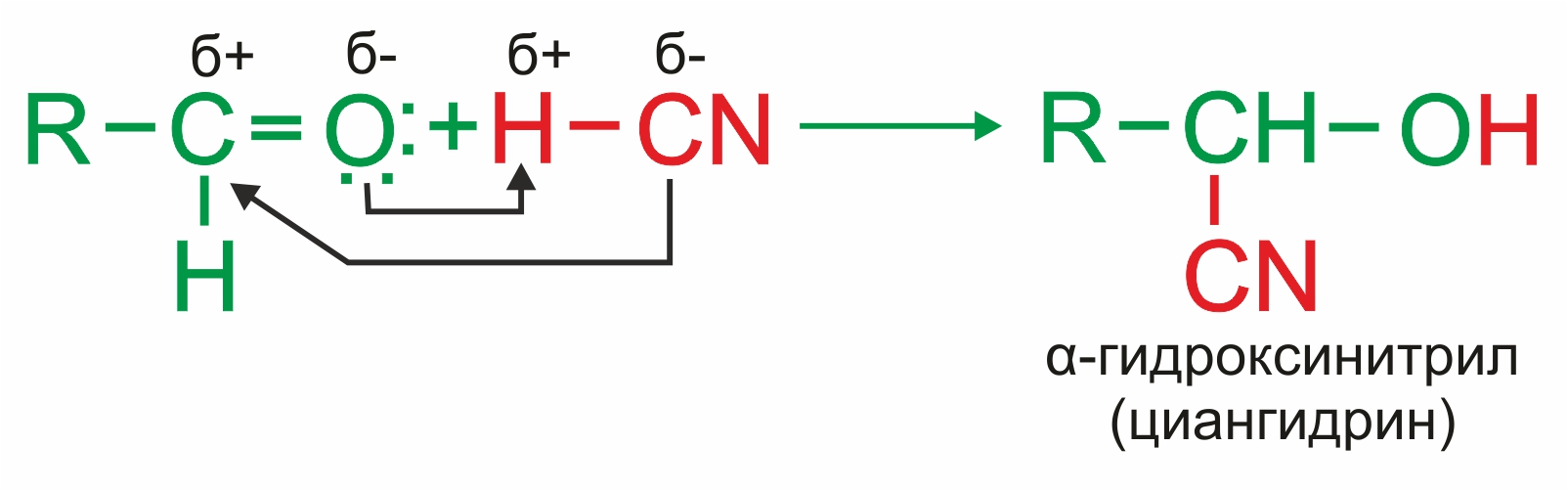
• |
Присоединение синильной кислоты:
|
|
• |
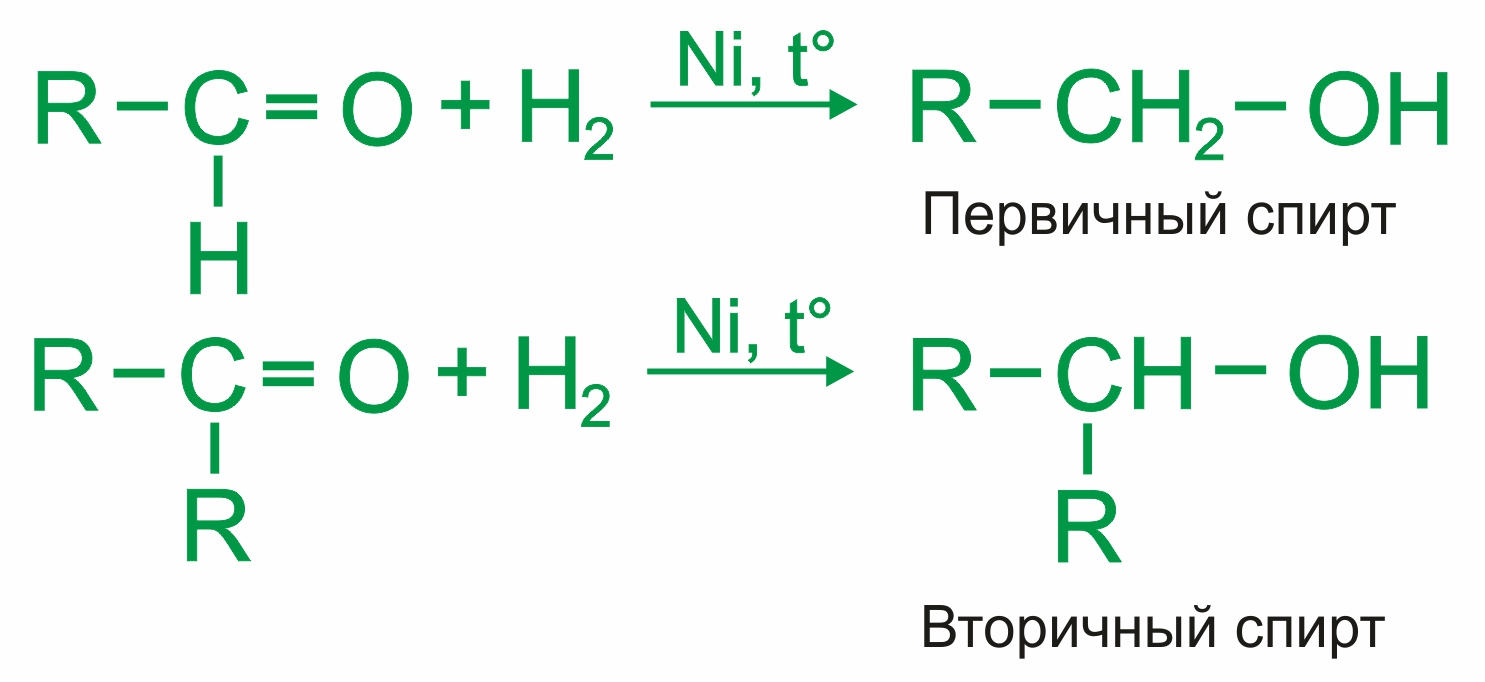
Присоединение водорода — восстановление (альдегиды при восстановлении образуют первичные спирты, кетоны — вторичные):
|
|
• |
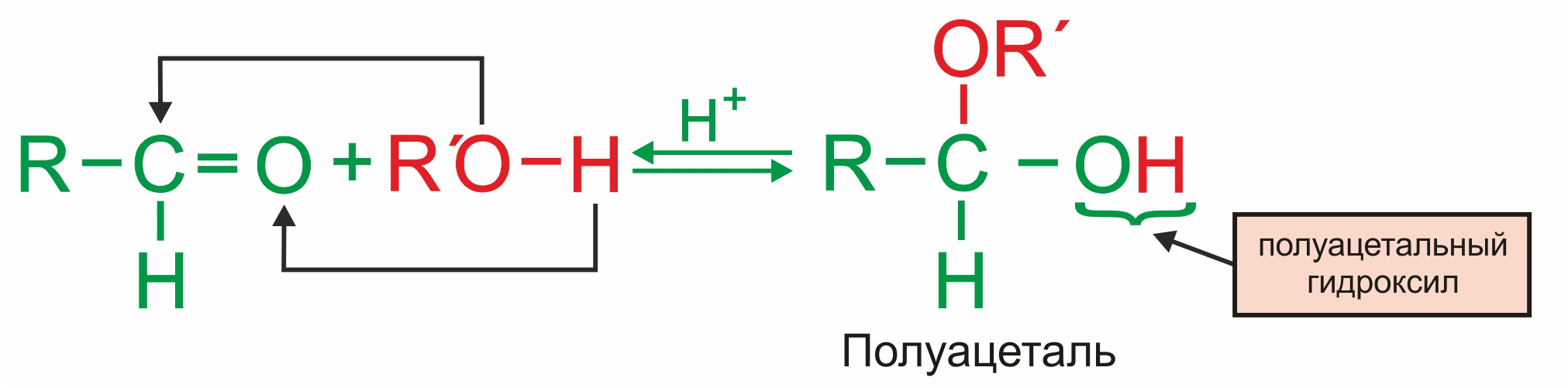
Присоединение спиртов (образуются полуацетали в присутствии кислот):
Взаимодействие полуацеталя еще с одной молекулой спирта приводит к образованию ацеталя:
|
|
2. |
Окисление. |
|
а) |
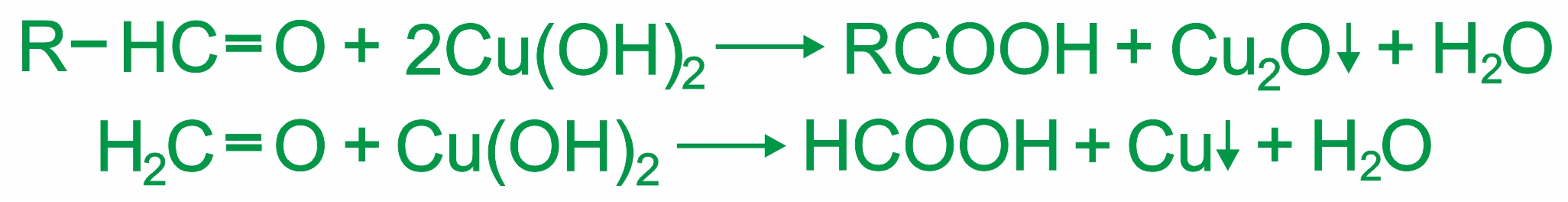
Альдегиды очень легко окисляются до карбоновых кислот даже мягкими окислителями, как оксид серебра и гидроксид меди (II). |
|
• |
Реакция «серебряного зеркала» — окисление аммиачным раствором оксида серебра — реактив Толленса (на стенках пробирки выделяется серебро):
|
|
• |
Окисление гидроксидом меди (II) (образуется красно-кирпичный осадок или металлическая медь — реакция «медного зеркала»):
|
|
б) |
Кетоны не окисляются при данных условиях. Они окисляются с трудом лишь при действии более сильных окислителей и повышенной температуре. Происходит разрыв углерод-углеродных связей, соседних с карбонильной группой, что приводит к образованию смеси карбоновых кислот. |
|
3. |
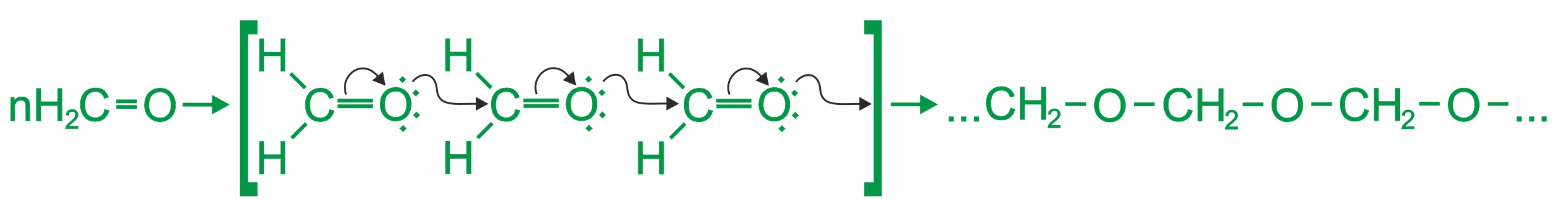
Полимеризация карбонильных соединений (характерна в основном для альдегидов). При стоянии 40%-го водного раствора формальдегида (формалина), образуется полимер формальдегида в виде белого осадка с невысокой молекулярной массой — параформ (неустойчив, в кислой среде гидролизуется с образованием исходных продуктов):
|
|
4. |
Реакции замещения. |
|
а) |
Замещение атома кислорода в карбонильной группе —С=О:
|
|
б) |
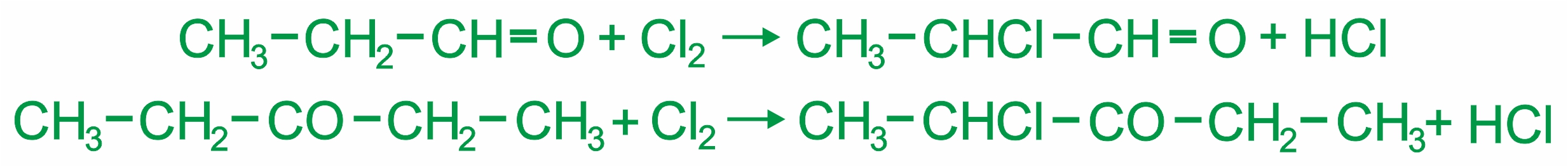
Замещение атома водорода в радикале в α-положении:
|
|
5. |
Реакции конденсации карбонильных соединений. |
|
• |
Конденсация с фенолами. Практическое значение имеет реакция формальдегида с фенолом:
Для фенола – это реакция электрофильного замещеения (SE), а для формальдегида – нуклеофильное присоединение (AN) |
|
Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол. В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолоформальдегидные смолы, из которых получают пластмассы — фенопласты (бакелиты).
Фенопласты — важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготовляют большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали.
Применение альдегидов и кетонов
Формальдегид используют для получения фенолформальдегидных смол; мочевиноформальдегидных (карбамидных) смол; синтеза лекарственных средств (уротропин); как дезинфицирующее средство; как консервант биологических препаратов (благодаря способности свертывать белок).
Уксусный альдегид используют при производстве уксусной кислоты и в органическом синтезе.
Ацетон используют как растворитель лаков, красок, ацетатов целлюлозы и как сырье для синтеза различных органических веществ.
Альдегиды входят в состав пищевых продуктов и эссенций. Один из интересных альдегидов — это ванилин (ванилаль) — бесцветные игольчатые кристаллы с запахом ванили:
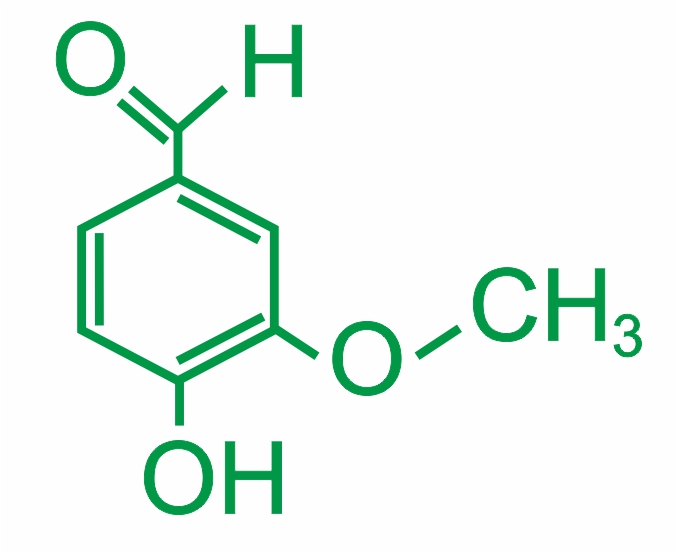
В основном ванилин используют как ароматизатор в сладостях. Он также используется в парфюмерии, для подавления неприятного запаха, вкуса медицинских препаратов, моющих средств. Нашёл применение и с более сильным запахом этилванилин. Он отличается от ванилина наличием этокси (—O—CH2CH3) группы вместо метокси(—O—CH3). Он содержит такие функциональные группы, как альдегидная, эфирная и фенольная. Ванилин содержится в виде гликозида в плодах, является компонентом ванили.