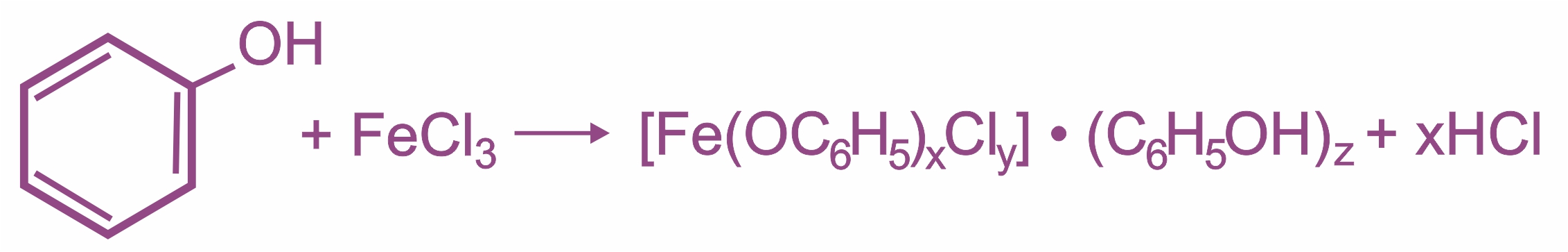Органическая химия

Тема 3.2. ФЕНОЛЫ
Органические соединения, содержащие гидроксильную группу, связанную непосредственно с атомом углерода ароматического ядра, называются фенолами. |
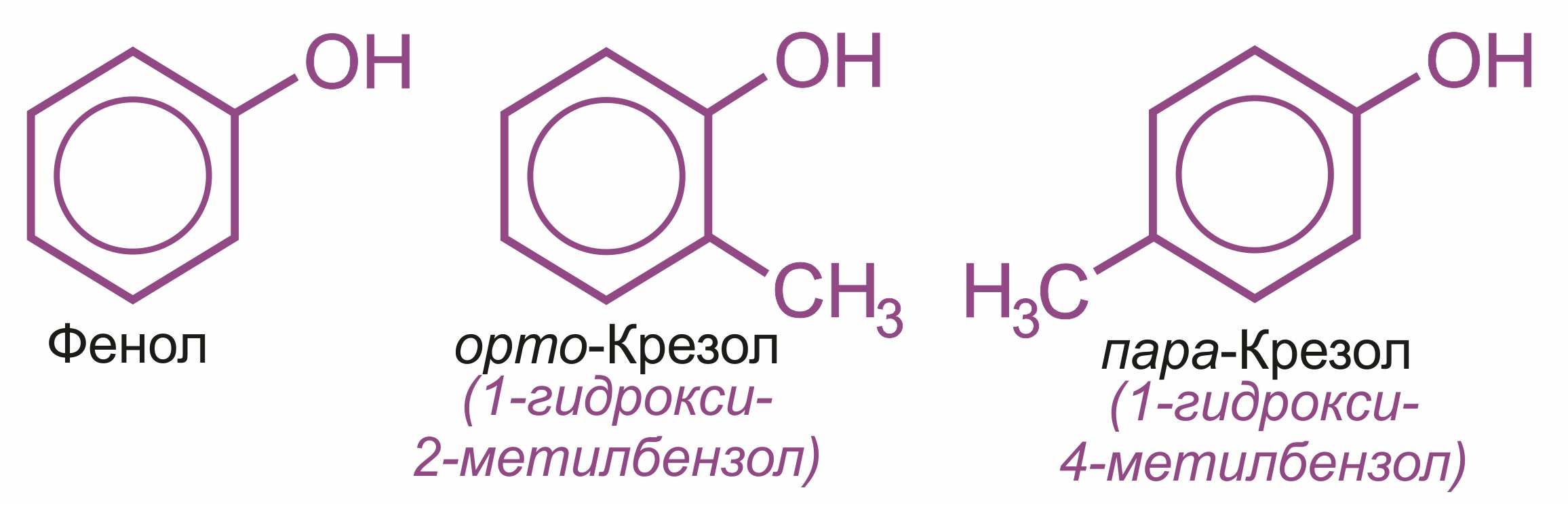
Классификация фенолов
• |
Одноатомные фенолы (содержат одну группу –ОН: фенол и крезолы); |
• |
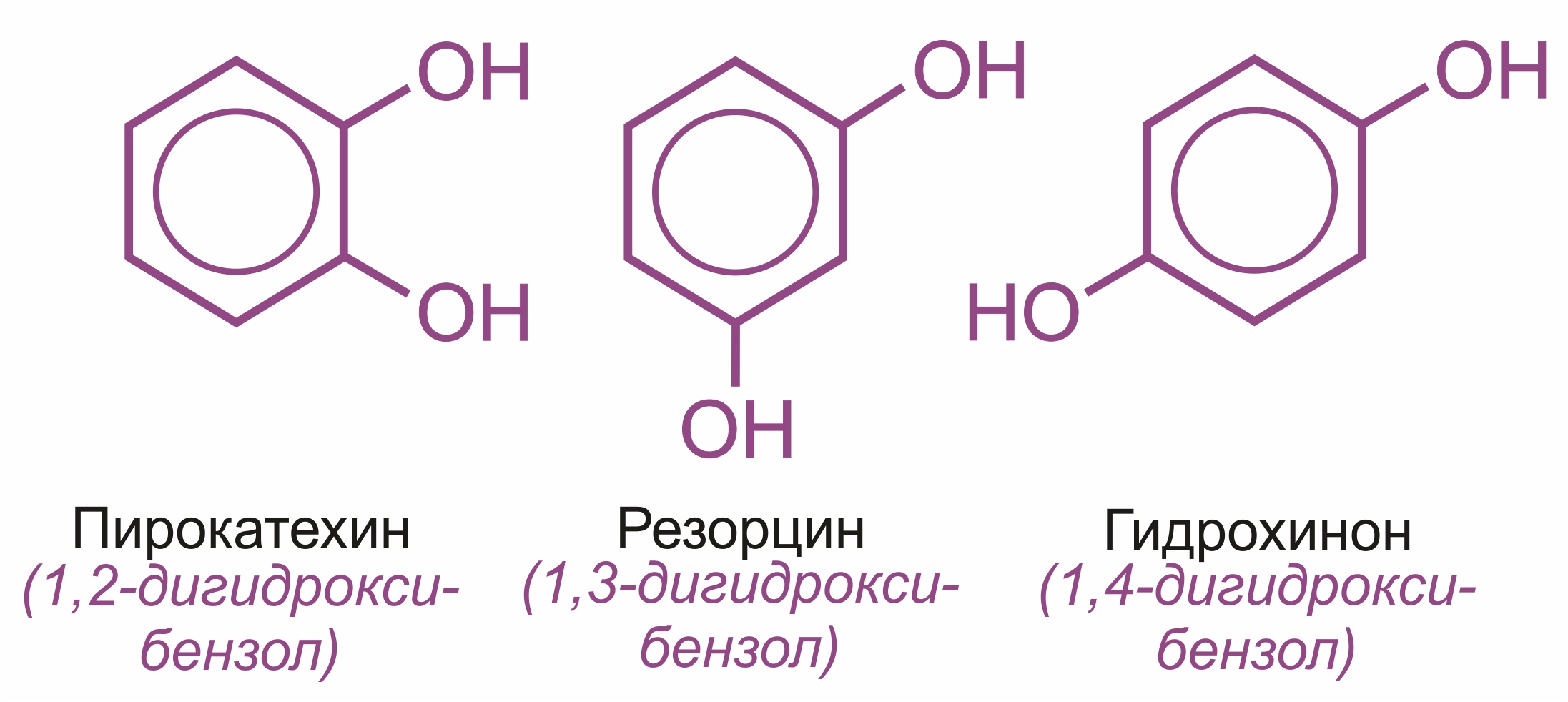
Многоатомные: двухатомные:
|
Изомерия фенолов
Структурная изомерия фенолов обусловлена различным расположением гидроксогрупп, а у гомологов фенолов — радикалов.
Физические свойства фенолов
Фенолы в большинстве своем — кристаллические вещества (метакрезол — жидкость) при комнатной температуре. Они обладают характерным запахом, довольно плохо растворимы в воде, но хорошо растворяются в водных растворах щелочей. Фенолы, как и спирты, образуют прочные водородные связи и имеют довольно высокие температуры кипения.
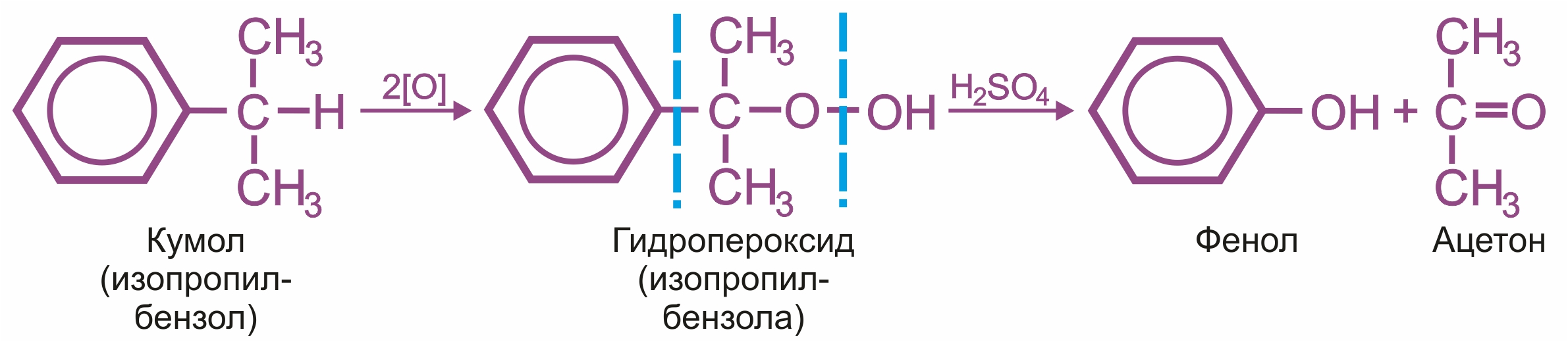
Способы получения фенолов
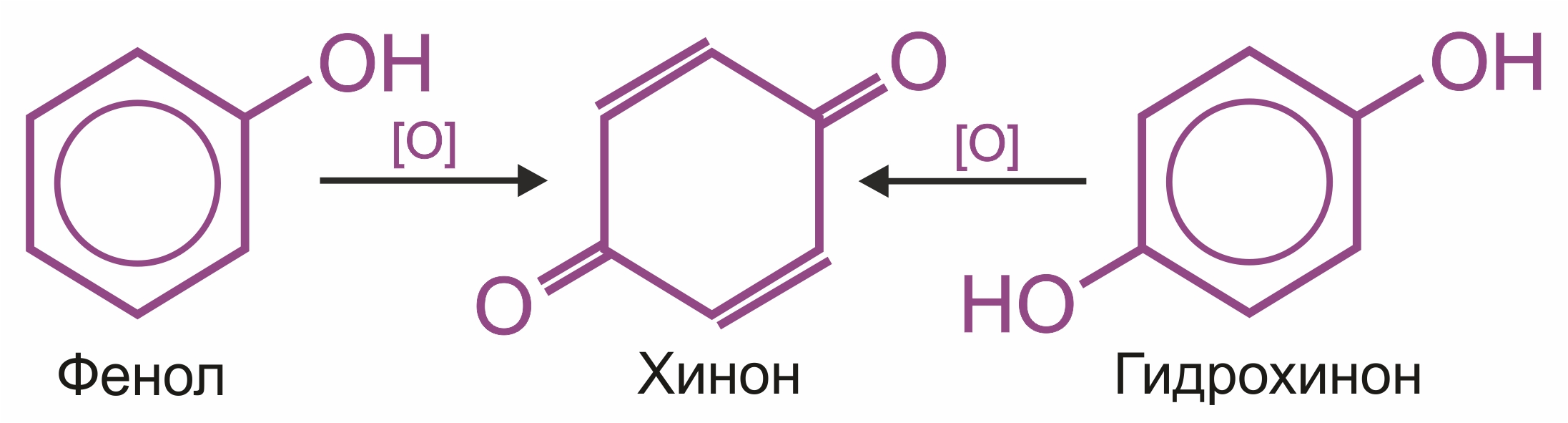
Химические свойства фенолов
В молекуле фенола наблюдается взаимное влияние атомов. Это проявляется как в особенностях поведения гидроксигруппы, так и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и параположениях.
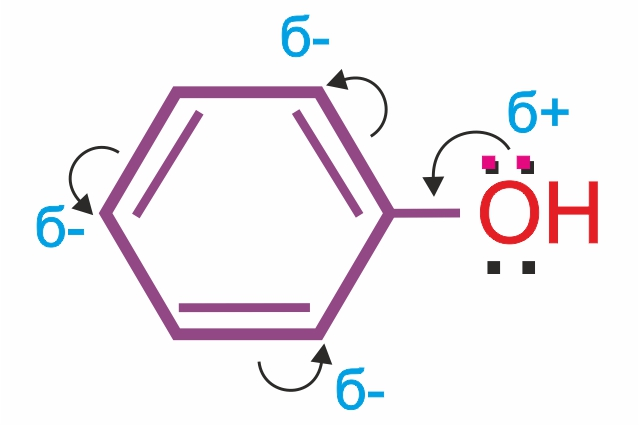
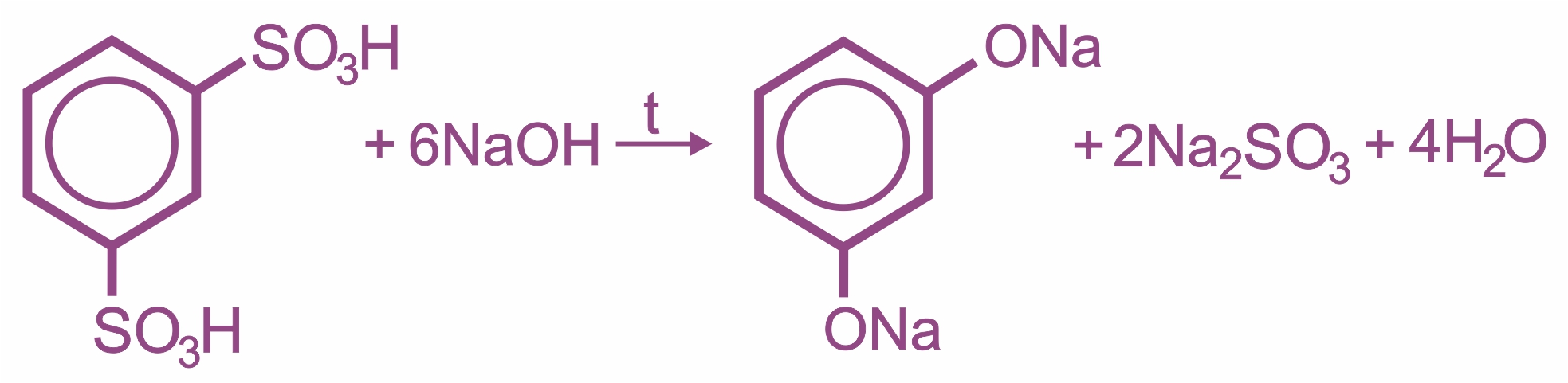
Влияние бензольного кольца: полярность связи О–Н увеличивается, и водород группы –ОН становится более реакционноспособным и легко замещается на металл даже при действии щелочей, образуя соли — феноляты. Фенолы являются более сильными кислотами (в отличие от предельных одноатомных спиртов).
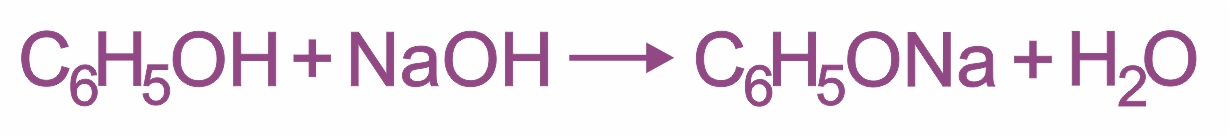
Взаимодействие фенола с раствором щелочи
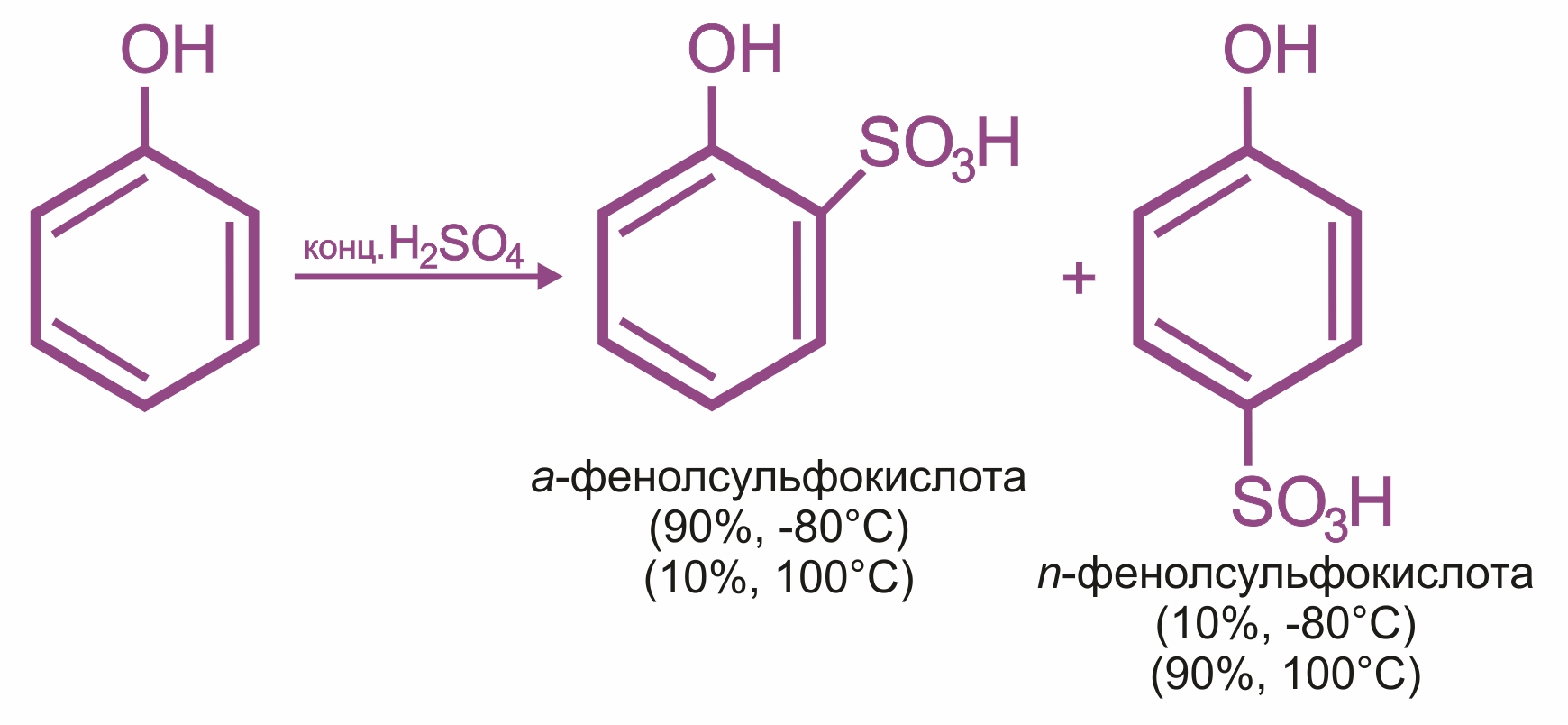
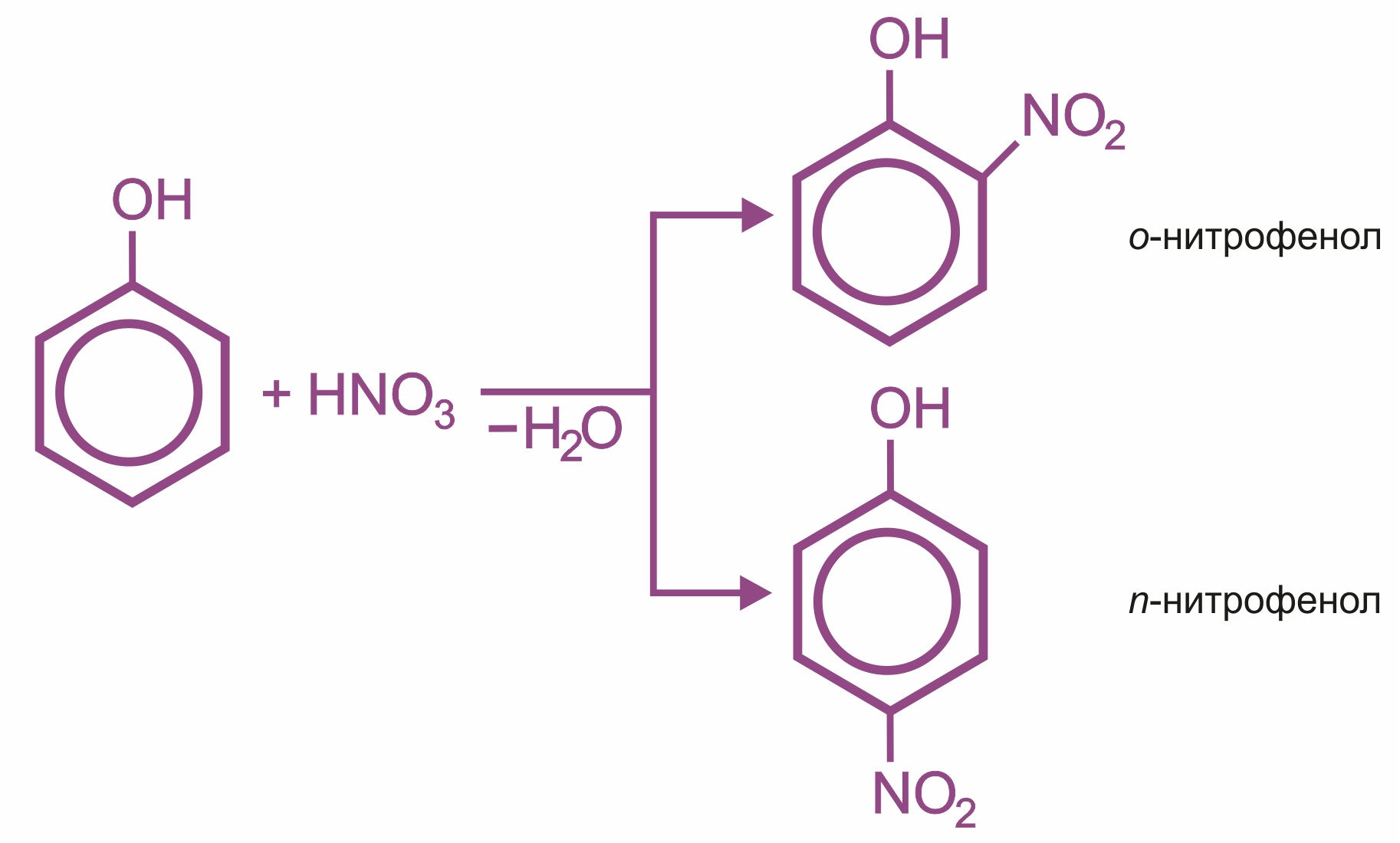
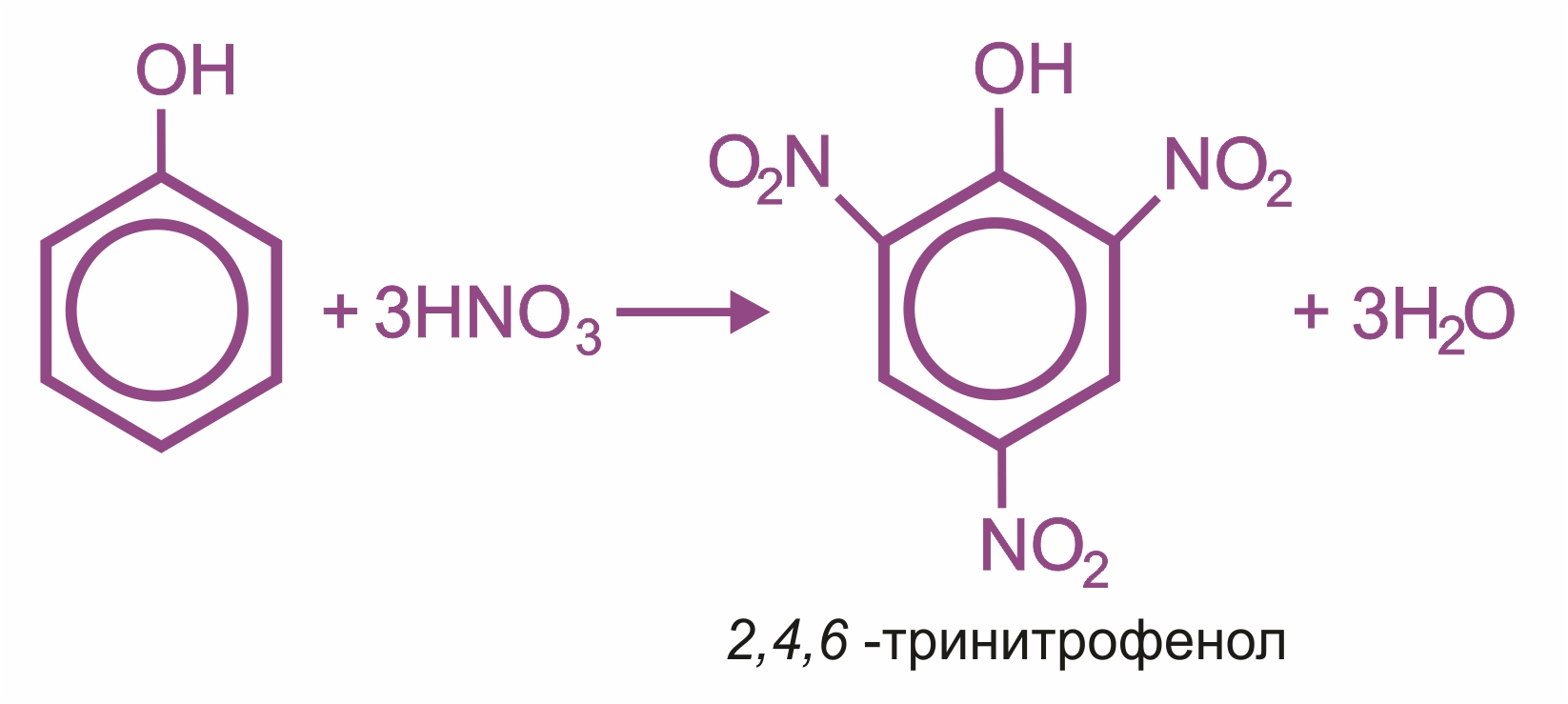
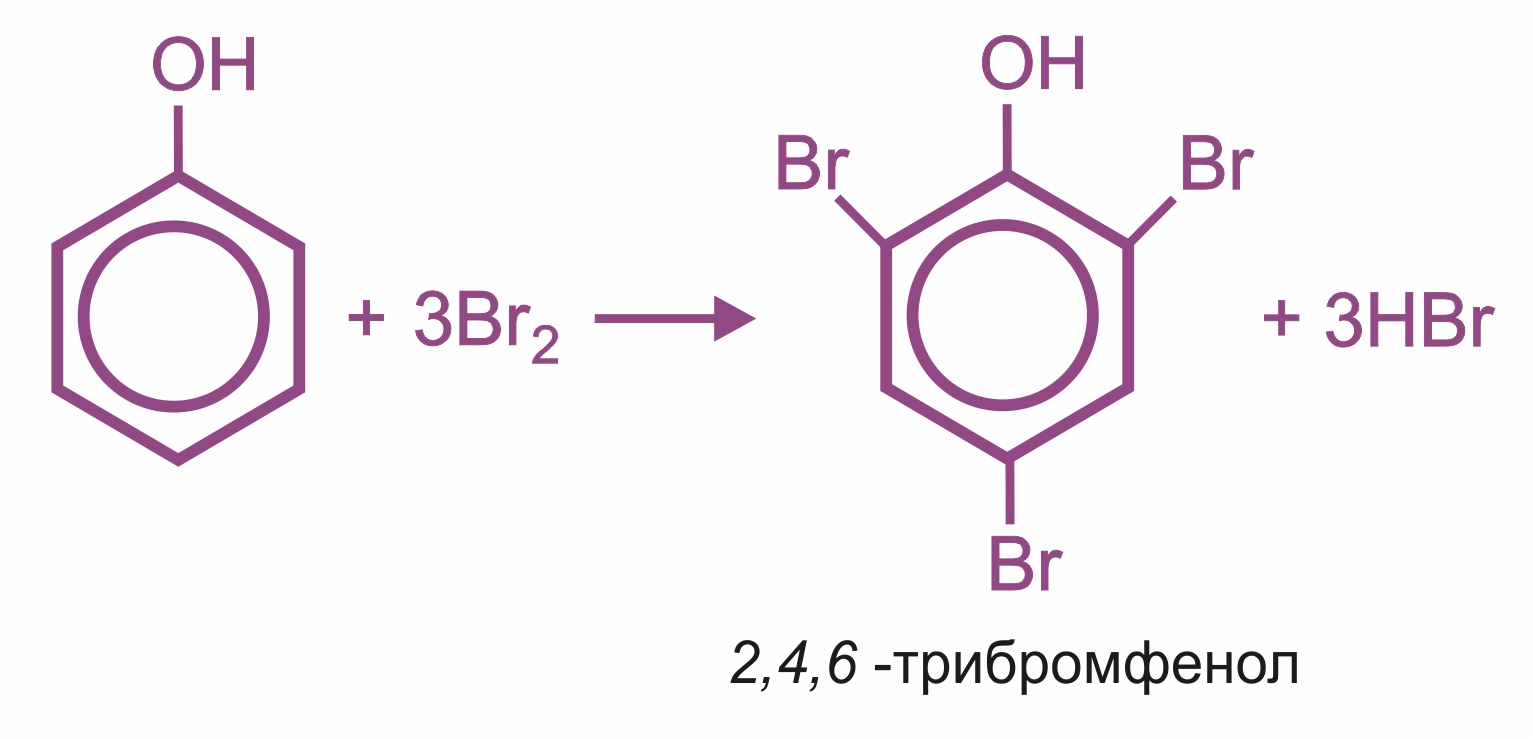
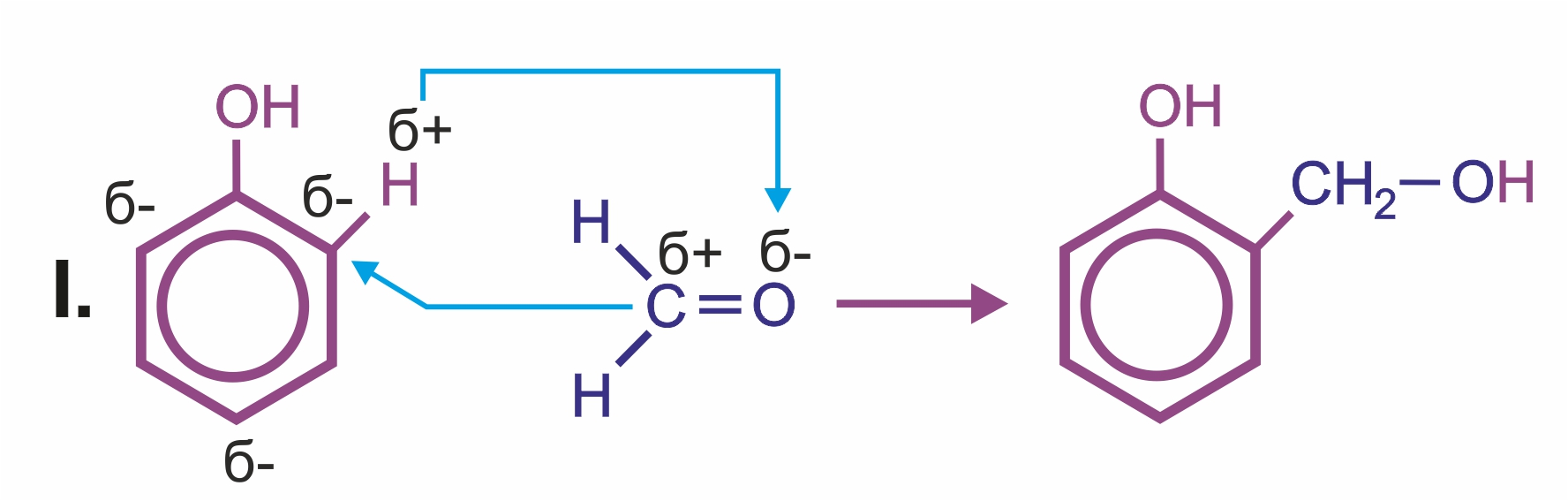
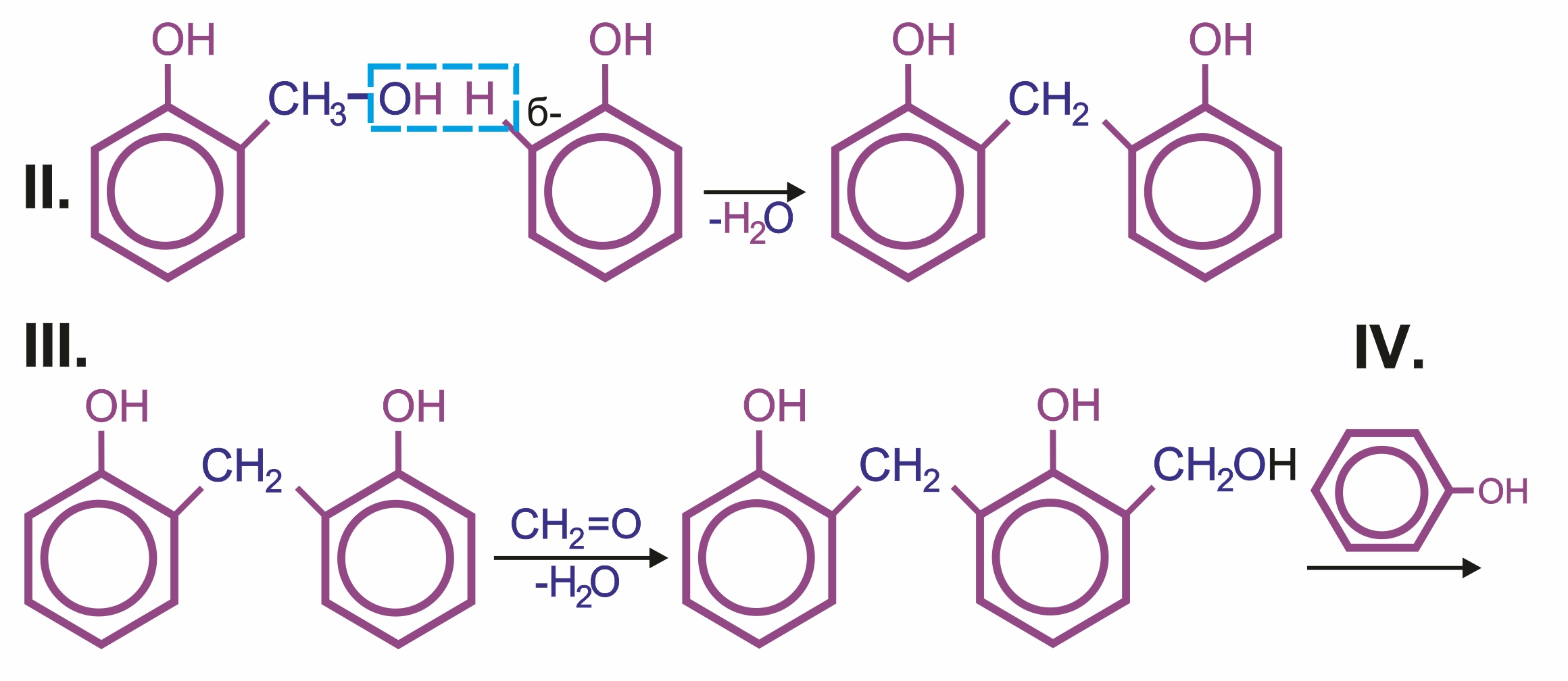
![]() Влияние группы –ОН в молекуле фенола: реакции электрофильного замещения (галогенирования, нитрования, сульфирования, поликонденсации и т. д.) протекают в орто- и параположениях:
Влияние группы –ОН в молекуле фенола: реакции электрофильного замещения (галогенирования, нитрования, сульфирования, поликонденсации и т. д.) протекают в орто- и параположениях:
Применение фенолов
• |
Фенол используется в производстве фенолформальдегидных смол, пластмасс, салициловых препаратов, красителей, инсектицидов. |
• |
Все фенолы обладают сильным бактерицидным действием, поэтому фенол и крезолы применяются в медицине и ветеринарии в качестве дезинфицирующих средств. |
• |
Многие алкилфенолы применяются в качестве антиоксидантов или ингибиторов окисления (2,4-диметил-6-третбутилфенол — ингибитор окисления бензинов). |