|
8.1. Методы иммуноанализа (серологические)
Иммуноанализ используется либо для обнаружения определенных антигенов с
помощью специфических к ним антител, либо, наоборот, для определения антител с
помощью специфичных антигенов. Иммуноанализ применяется как для выявления
наличия объекта, так и для определения его количества. Антигенами могут быть
вирусы, в частности, фитопатогенные. Рассмотрим примеры обнаружения
фитопатогенных вирусов. При введении в организм животных этих вирусов не
через пищеварительные каналы они, благодаря своей белковой оболочке,
действуют как антигены, т.е. побуждают иммунную систему к образованию антител
(защитная функция белков). Как правило, антител образуется больше,
чем необходимо для удаления введенного вируса. Их можно в течение длительного
времени обнаружить в сыворотке крови, которую и называют антисывороткой.
Необходимой предпосылкой приготовления антисывороток к фитопатогенным вирусам
является их высокая очистка. Очищенные препараты вводят внутривенно или
внутримышечно подопытным животным, чаще всего кроликам. После нескольких
инъекций у кроликов берут кровь, также несколько раз. Сыворотку, содержащую
антитела, хранят в замороженном или лиофилизированном состоянии до
употребления. Это поликлональные антитела. Антигены (в данном случае вирусы) и антитела могут при
определенных условиях реагировать друг с другом in
vitro. При этом возникают нерастворимые комплексы антиген-антитело,
которые удерживаются нековалентными связями. Эта реакция протекает по типу
«ключ к замку». Поэтому вирусы могут реагировать только с соответствующими им
антителами. Принцип серологических методов диагностики состоит в обнаружении
образовавшихся комплексов антиген-антитело с помощью различных способов. Наряду с точными методами
есть более простые, но менее точные. Агглютинация. Агглютинация означает
связывание. Для теста агглютинации используют неосветленные, т.е.
неотцентрифугированные образцы сока растений. На обезжиренное предметное
стекло пипеткой наносят раздельно две капли исследуемого сока, к одной из них
добавляют каплю антисыворотки, к другой - каплю сыворотки от неиммунизированного
животного. Смеси перемешивают стеклянной палочкой и оставляют на несколько
минут. Если смешан сок больного растения с антисывороткой, то в капле
образуются хлопья. Иногда вместо стекол используют пробирки. Преципитация. Если для
серологического анализа используется центрифугированный сок, то реакция между
антигеном и антителами протекает без участия клеточных фрагментов. Это
обеспечивает повышенную чувствительность. Образующиеся при этом хлопья
называют преципитатом. Центрифугирование сока, полученного с помощью ручного
пресса, проводят при 3000-5000g 20-30 мин. После этого капли сока наносят на
предметные стекла, добавляют равное количество антисыворотки и перемешивают,
доводя диаметр до 1-1,5 см. После инкубации при 25°С
в течение 30-60 мин проверяют результат. Показателем положительной реакции на
вирус является образование легких хлопьев преципитата. Другое название
преципитации - капельный
тест. AS-тест (ammonium sulfate). Для
усовершенствования серологической диагностики вирусов картофеля X, Y, S и М
разработана методика с использованием сульфата аммония. Его добавление к соку
помимо повышения способности вирусов к образованию осадка вызывает коагуляцию
низкомолекулярных белков и других мешающих веществ, которые удаляют
центрифугированием на малых скоростях (высаливание). В этом тесте по 0,3 мл
сока от каждой пробы помещают в пробирки и добавляют по 0,3 мл 1,3%-го
раствора сульфата аммония. После инкубации в течение часа при 27°С считывают результаты в темном поле микроскопа при 60-70-кратном увеличении. Преимущества AS-теста в следующем: ♦
чистота смеси обеспечивает надежное выявление преципитатов; ♦
реакция протекает полнее, что позволяет обнаружить больше зараженного
материала; ♦
число неспецифических реакций резко снижается. Двойная диффузия в агаре. Вместо жидкой среды, в
которой протекает реакция антиген-антитело, используют гелеобразную - агар. Для этого в 100 мл физиологического
раствора на водяной бане вываривают до осветления 1 г
агара, затем добавляют 50 мг азида натрия для подавления микроорганизмов.
По 10-15 мл теплого раствора разливают пипеткой в чашки Петри диаметром 9 см, установленные
строго горизонтально. После затвердевания агара в чашках Петри при комнатной
температуре с помощью пробочного сверла нарезают лунки диаметром 5 мм на
расстоянии 5 мм друг от друга. Сок растений вносят в лунки одного ряда, в
лунки соседнего ряда вносят антисыворотку в рабочем разведении. После
24-часовой инкубации при 24°С результаты считывают в
темном помещении с боковым освещением. При положительной реакции между
лунками с антигеном и сывороткой появляется белая линия преципитата. Реакция
происходит в результате диффузии в агар вируса и антител, которые при встрече
образуют преципитат. Радиальная
иммунодиффузия (РИД-тест). При
радиальной иммунодиффузии антисыворотку сразу смешивают с агаром, а в лунки
помещают антиген (сок
больного растения). Вирусы, диффундирующие в агар радиально, сразу
встречаются с антителами. Положительная реакция проявляется в виде белого,
разного по ширине кольца вокруг лунки. Тест пригоден не только для
качественного, но и для количественного определения вирусов, поскольку
ширина кольца прямо пропорциональна концентрации вирусов. Эти же методы можно применять для энтомопатогенных вирусов и
других микроорганизмов имеющих, значение для защиты растений.
Моноклональные антитела - гомогенная популяция
идентичных по структуре и специфичности антител к одной антигенной
детерминанте. Антигенная детерминанта - это та часть белка,
которая отвечает за взаимодействие с антителом. Поликлональные антитела в отличие от моноклональных представляют
смешанную популяцию антител, продуцируемых различными клонами
лимфоцитов в ходе иммунного ответа. Получение моноклональных антител.
Известно, что иммунная система человека и животных продуцирует специфические антитела
в ответ на огромное множество антигенов. В
основе этого лежит большое разнообразие клонов лимфоцитов, каждый из которых
вырабатывает антитела одного типа с узкой специфичностью. Например, общее
число клонов у мышей 107-108. Поэтому получаемые антитела поликлональны, и это мешает
обнаружению вируса в клетках, если его очень мало (большой фон).
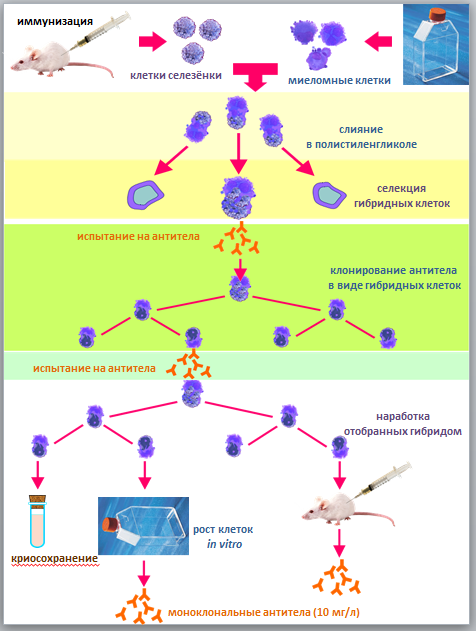
Получение гибридом, синтезирующих
моноклональные антитела, стало возможным благодаря двум методическим
разработкам клеточной инженерии: 1) культивированию миелом вне организма; 2) соматической гибридизации клеток. Миеломы являются потомками одной клетки, т.е. имеют моноклональное
размножение, что передается и гибридомам. Опухоли получают у животных путем
внутрибрюшинного введения минеральных масел или инертного твердого пластика. Процедура получения моноклональных антител включает следующие
этапы: ♦
иммунизация животных антигеном; ♦
подготовка клеток селезенки и миеломы к слиянию; ♦
слияние, получение гибридом; ♦
отбор продуцирующих специфические к антигену антитела клонов и клонирование; ♦
массовая наработка гибридомных клеток; ♦
получение культуральной жидкости или
асцита, содержащих антитела - гибридомы; ♦
выделение этих антител - гибридом. Вся процедура занимает 3-4 месяца (рис. 8.1).
Рисунок 8.1. Классическая модель наработки антител Обычно для иммунизации используют мышей и крыс. Это связано с
тем, что подходящие миеломные клетки мышей и крыс широко распространены, и
несложно выращивать полученные гибридомы в организме этих
животных. Экспериментально установлено, что для гибридизации
необходимо выделять селезеночные клетки животных через 3-4 суток после
последнего введения антигена. Обычно антиген вводят
неоднократно и с применением адъювантов, усиливающих иммунный ответ. Массовая наработка моноклональных антител. После
отбора гибридомных клеток, синтезирующих интересующие исследователя антитела, приступают к их
массовому наращиванию. Во-первых, клетки можно культивировать в суспензионной
культуре. Во-вторых, для получения больших количеств антител вводят
гибридомные клетки в организм животных и получают от них асцитную
жидкость. При этом также используют введение специальных агентов, повышающих
способность гибридом расти в брюшной полости. Эти моноклональные антитела
применяют для диагностики вирусов, бактерий, грибов или их белков в
тканях организма или в культуре клеток. Как уже отмечалось, в основе всех методов иммунодиагностики
лежит выявление комплекса антиген-антитело. В простейших методах (капельная агглютинация) эти
компоненты выявляют визуально, так как они имеют высокую светорассеивающую
способность. В более точных методах антиген определяют количественно. К ним
относится наиболее предпочитаемый из современных метод иммуноферментного анализа
(ИФА) -
метод двойных антител или “сэндвич-вариант”, по-английски - Ensyme
Linked Immunosorbent Assay
(ELISA - сокращение, часто встречаемое в литературе). Принцип твердофазного ИФА
основан на последовательном взаимодействии тестируемого антигена с антителами
(сначала с иммобилизованными на твердой фазе, затем с меченными ферментом) с
последующим выявлением фермента-маркера по реакции с субстратом. Для
количественного определения фермента применяют фотометрический метод, учитывая,
что оптическая плотность продукта ферментативной реакции пропорциональна
концентрации определяемого вируса или белка. Наиболее распространена для выявления фитопатогенных вирусов при
получении безвирусного картофеля следующая методика. В
качестве твердой фазы часто применяют 96-луночные микроплаты из оптически прозрачного
полистирола, позволяющие проводить весь цикл анализа от стадии иммобилизации до
измерения ферментативной активности в каждой из лунок. На первом этапе специфические антитела
адсорбируют на полистирольных платах. Эту операцию проводят с суспензией
антител в 0,01 М К-фосфатном буфере, содержащем 0,1
М NaCl, pH 7,2. Объем нанесенного в каждую лунку раствора 0,1 мл.
Полистирольные платы закрывают крышками и инкубируют в течении 10-14 ч при 4°С или 2 ч при 37°С. На этом этапе антитела адсорбционно
связываются с полистиролом за счет гидрофобных и электростатических
взаимодействий (иммобилизуются). Оптимальные условия способствуют наиболее
полному насыщению антителами поверхности полистирола. Для удаления избытка
антител, не связавшихся с полистиролом, плату промывают трижды буферным
раствором. На втором этапе в лунки с закрепленными
антителами помещают исследуемый образец (сок растений с подозрением на
заражение вирусом). В образце находится антиген. Образуется комплекс антиген-антитело,
избыток вируса удаляют промыванием. Находящийся на поверхности антиген
определить трудно. Поэтому на третьем этапе
опять добавляют антитела, но уже скрепленные с ферментом, который легко
идентифицируется. Образуется тройной бутерброд (сэндвич), сверху к нему
привязан фермент (антитело, меченное ферментом). Этим ферментом может
быть пероксидаза хрена, фосфатаза и т.д. Последний (четвертый) этап - количественное
определение фермента, а значит, и количества связанного с ним антитела, а
количество антитела, в свою очередь, равно количеству антигена, т.е. вируса. Для
количественного анализа используют реакцию фермента с субстратом с развитием
окраски, а интенсивность этой окраски определяют с помощью фотометров или
спектрофотометров на основе закона Ламберта-Бера:
где D - оптическая плотность; с - концентрация
вируса; l -
толщина кюветы; E -
коэффициент поглощения. Чаще используют фермент пероксидазу. При использовании в
качестве субстрата пероксидазы раствора 5-аминосалициловой кислоты (pH 6) с
перекисью водорода происходит ферментативная реакция окисления
5-аминосалициловой кислоты с образованием коричневой окраски. Обычно окраска
обнаруживается визуально через 15 минут инкубации. Количественную оценку
содержащихся вирусов в исследуемом материале проводят на основании
калибровочной кривой (оптическая плотность - содержание вируса). При использовании
фермента щелочной фосфатазы субстратом служит производное индолилфосфата,
которое при отщеплении фосфата дает характерное окрашивание. Автоматическое
считывание результатов анализа осуществляется непосредственно в лунках
специальными фотометрами. После завершения анализа платы можно использовать
повторно. Для этого их тщательно отмывают щелочным раствором, водой и буфером
последовательно. В заключение отметим, что методы иммуноанализа в защите
растений применяют также для обнаружения энтомопатогенных микроорганизмов,
являющихся основой биопрепаратов.
Например, серологическая типизация широко используется для наиболее
распространенных агентов биоконтроля насекомых - энтомопатогенных
бацилл. Одним из основных методов выяснения их сероварианта является реакция
агглютинации со специфическими агглютинирующими сыворотками, полученными при
иммунизации животных. Для более точной диагностики используют метод ИФА. Диагностика энтомопатогенных вирусов также необходима либо при
их наработке в культурах клеток насекомых, либо для обнаружения
нежелательного спонтанного заражения чистых культур клеток насекомых. Для
этого можно использовать 2 метода - ИФА и иммунофлюоресцентную микроскопию. В
данном случае антигеном
может быть вирион, нуклеокапсид или белок. Сущность иммунофлюоресцентной микроскопии
заключается в появлении специфического свечения комплекса «антиген-антитело»
в лучах сине-фиолетового и УФ-света при условии
использования в данном комплексе антител, соединенных с флюоресцирующим красителем,
а не с ферментом. На предметное стекло с мазком из исследуемого материала
наносятся антитела, меченные флюоресцирующим красителем. В случае содержания
в препарате вирусов, специфически родственных меченому антителу, происходит
их связывание. Возникающий при этом комплекс достаточно прочен, чтобы
сохраниться во время тщательной промывки. Специфическое свечение выявляется
под люминесцентным микроскопом. Помимо методов, основанных на использовании клеток, существуют
еще более точные методы диагностики микроорганизмов с использованием
молекулярных систем.
|