|
7.1. Основные методы генной инженерии Достижения молекулярной биологии обеспечили проведение работ с рекомбинантными
ДНК. Под рекомбинантными понимают ДНК, получаемые объединением двух
и более фрагментов ДНК, выделенных из биологического материала разного
происхождения. Здесь мы подходим к понятию генетического
эксперимента. Генетический эксперимент предполагает смешение генетического
материала двух различных клеток (рекомбинацию) и образование измененного
потомства. Генетический эксперимент стал основой технологий генной
инженерии. Суть технологий генной инженерии
состоит в воссоединении фрагментов ДНК в пробирке с последующим введением
новых рекомбинантных структур в живую клетку. Перенос чужеродного
генетического материала в организмы для придания им заданных свойств называют
трансформацией. Типовой эксперимент генной инженерии включает следующие этапы: 1) получение фрагментов ДНК; 2) конструирование рекомбинантных молекул ДНК из этих фрагментов
и векторов; 3) введение сконструированных структур в клетку; 4) отбор клонов с
нужной молекулой ДНК. На этапе 1 берут ДНК, либо
выделенную из различных организмов, либо полученную из и-РНК с помощью
обратной транскриптазы. Чтобы выделить нужные фрагменты ДНК, используют ферменты - рестриктазы. Не
всегда проникшая в бактериальную клетку чужеродная ДНК полезна. Для
ограничения путей распространения чужой ДНК служат бактериальные рестриктазы.
Они разрезают чужую ДНК как ножницами. В названии рестриктаз отражены
названия бактерий, из которых они выделены. Например, рестриктаза EcoR1 получена из кишечной палочки E.coli. На этапе 2 соединение фрагментов
ДНК зависит от того, с какими концами получились фрагменты после разрезания
рестриктазами - с «тупыми» или
«липкими». Наиболее простой метод соединения
фрагментов ДНК с «тупыми» концами - отжиг (реассоциация) с последующей
обработкой сшивающим ферментом ДНК-лигазой.
Если образовались симметричные разрезы от рестриктазы, то такие
комплементарные друг другу участки имеют тенденцию «слипаться» за счет
образования водородных связей между комплементарными последовательностями (фрагменты
с «липкими» концами). Хотя ДНК-лигаза и здесь используется для
восстановления целостности двойной спирали, ее эффективность значительно
выше. Фрагменты с липкими концами образует, например, рестриктаза EcoR1. Этапы 3 и 4. Введение
в клетку рекомбинантных ДНК осуществляют, как правило, с помощью векторов. В
качестве векторов используют молекулы
ДНК, способные присоединять чужеродную ДНК и обеспечивать ее репликацию,
экспрессию и/или трансформацию. Как правило, это плазмиды, бактериофаги,
вирусы животных и др. Чаще всего применяются плазмиды. Это
кольцевые молекулы ДНК (м.м.1-200 Мда), составляющие от 1 до 3% от
клеточного генома и кодирующие важные генетические свойства. Например, они
часто содержат гены устойчивости к антибиотикам. В природе, выполняя роль векторов, плазмиды могут поглощаться
бактериями, которые их не содержали. Некоторые плазмиды размножаются в клетке
до 100-200 копий. Это свойство обеспечивает клонирование нужного гена в
биотехнологических операциях. Клоны с генами, несущими заданные признаки,
отбирают для дальнейших операций. Опыты с плазмидами, способными перенести в клетку чужеродную
генетическую информацию (трансформировать клетку)
положили начало генетической инженерии. Главной операцией в генной инженерии
является введение в клетку и поддержание генетической информации,
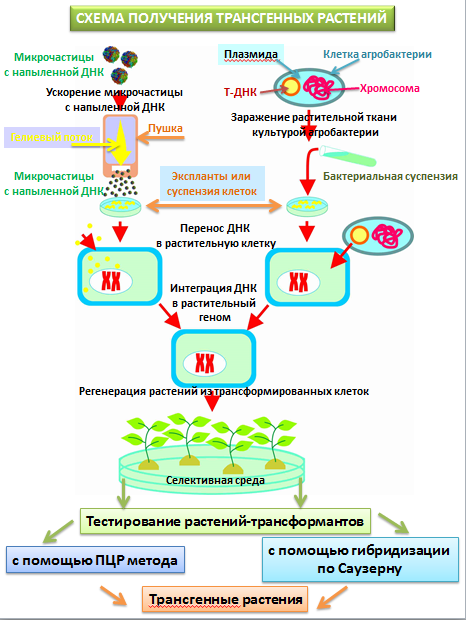
содержащейся в рекомбинантных молекулах ДНК. Для получения трансгенных растений технология генной инженерии
включает следующие этапы: 1) выбор гена и его клонирование; 2) подбор генотипа растения-реципиента; 3) введение гена и его экспрессия в геноме растения-реципиента; 4) регенерация трансформированных клеток и отбор трансгенных
растений. При выборе гена руководствуются необходимостью передачи растению
определенного признака. Для успешной защиты растений от вредных организмов
используют гены, определяющие устойчивость культурных растений к гербицидам,
к вредителям и болезням. В качестве растения-реципиента требуется сорт,
отличающийся высокой урожайностью, устойчивостью к абиотическим факторам, но
имеющий лишь одно отрицательное свойство, например, высокую восприимчивость к
болезням. При введении гена в растение важно обеспечить его
экспрессию в геноме растения-реципиента и стабильное наследование признака
в поколениях. Наконец, регенерация взрослых растений из трансформированных
клеток зависит от тотипотентности клеток. Это свойство лучше проявляется у
клеток двудольных растений, поэтому чаще трудности с регенерацией наблюдаются
у однодольных растений. Основная проблема при получении трансгенных растений - способ введения генов в
хромосомы растений. Существует несколько методов. Использование природной системы трансформации растений. В
природе агробактерии Agrobacterium tumefaciens, внедряясь
в растения, способны вызывать образование корончатых галлов (опухолей). В
качестве векторов
служат плазмиды, которые названы Ti-плазмидами от
английского выражения tumor inducing
(вызывающие опухоли). Ti-плазмиды содержат
гены двух типов: 1) необходимые для метаболизма самой бактерии и 2)
необходимые для трансформации растительной клетки. Часть Ti-плазмиды
переносится в ядро растительной клетки и может встраиваться в растительный
геном. Этот фрагмент плазмиды назван Т-ДНК (transfer - перенос). Наличие этого
фрагмента необходимо, но недостаточно. За вырезание Т-ДНК и перенос ее в
геном растения отвечает vir-область плазмиды со структурными и регуляторными
генами. Поэтому для трансформации растений необходимо выполнение трех
условий: ♦
активация генов на хромосоме агробактерий, кодирующих синтез полисахаридов
для прикрепления к растительной клетке; ♦
активация vir-области Тi-плазмиды; ♦
наличие Т-ДНК. Трансформация растительных клеток путем совместного культивирования с
агробактериями наиболее распространена для двудольных растений. Для этого
векторную конструкцию, содержащую чужеродный для растения ген, встраивают в
Т-ДНК агробактерий. Полученными агробактериями трансформируют растительные
экспланты. В качестве эксплантов обычно используют стерильные листовые диски.
Достаточно 24-48 ч совместного культивирования растительных клеток с такой
агробактерией, чтобы фрагмент Т-ДНК с чужеродным геном встроился в
растительный геном. Далее переносят экспланты на среду с антибиотиком, что
приводит к гибели агробактерий. Подбирают компоненты среды для выживания
только трансформированных (трансгенных) растений. Через 2-5 недель на трансформированном экспланте развиваются побеги.
Это прямой перенос ДНК в растение. В качестве исходного
материала берут каллусную ткань или суспензионные растительные культуры. Суть
метода состоит в том, что на мельчайшие частицы вольфрама, платины или золота
(диаметром 0,6-1,2 мкм) напыляется ДНК вектора, содержащего необходимую
генную конструкцию. Частички, несущие ДНК, помещают внутрь биобаллистической
пушки (специального вакуумного устройства). Каллус или суспензия клеток
помещается под пушкой на расстоянии 10-15 см в чашках Петри. Сначала в пушке
создается вакуум (уменьшение давления до 0,1 атм). А
в момент резкого увеличения давления частички с ДНК с огромной скоростью
выбрасываются и, разрывая клеточные стенки, входят в цитоплазму и ядро
клеток. Трансформированные клетки переносят на среду для дальнейшего
культивирования и регенерации. (рис.
7.1). В некоторых случаях метод можно применять и для двудольных растений.
Рисунок 7.1. Схема получения трансгенных растений
Электропорация заключается
в том, что на растительные протопласты в среде, содержащей ДНК,
кратковременно действуют высоковольтным импульсом (в течение долей секунды).
Через образовавшиеся в мембране протопластов поры проникают молекулы ДНК.
Протопласты затем высевают на соответствующую среду для регенерации. Помимо электропорации можно применять микроинъекцию ДНК в изолированные протопласты. Для
этого их прикрепляют к стеклу и вводят микроиглой ДНК. Эффективность метода
не более 10-15%. Кроме того, для введения в протопласты экзогенного генетического
материала используют упаковку ДНК в липосомы. Липосомы
-
сферические образования, оболочки которых состоят из фосфолипидов. Они
защищают вводимый материал от действия нуклеаз. Но эффективность метода
составляет всего 1%. В последнее время перспективным считается генетическая
трансформация хлоропластов растений (например,
биобаллистическим методом). Каждый
хлоропласт
содержит автономную ДНК. Очень важным преимуществом трансформации
хлоропластов над ядерной (введением ДНК в ядро) является материнское
наследование пластидных генов. Это свойство обеспечивает как предотвращение
передачи нового признака в экосистему, так и возможность опыления близких
видов. Аналогичные функции у животных выполняет митохондриальная
ДНК.
|