Экологический мониторинг и экологическая экспертиза

3.3. Определение растворенного кислорода
|
Йодометрическое определение растворенного кислорода по Винклеру Модификация определения кислорода по Винклеру Укороченный метод определения растворенного кислорода по Винклеру ( по объему кислорода) |
Контроль содержания кислорода в воде имеет значение при оценке качества поверхностных и сточных вод, работы станций биологической очистки. Содержание кислорода является важным показателем загрязненности водоема, его биологического состояния, доминирующих органических веществ, интенсивности самоочищения.
ПДК для растворенного в воде кислорода должна быть не менее 4 мг/л в зимний период и 6 мг/л – в остальное время года. |
Концентрация растворенного кислорода в воде водоемов санитарного водопользования (I и II категории) в пробе, отобранной до 12 ч дня, должна быть не менее 4 мг/л в любой период года. Количество растворенного кислорода в воде имеет большое значение для оценки санитарного состояния водоемов и его снижение указывает на резкое изменение биологических процессов в водоеме, а также на загрязнение водоемов веществами, биохимически интенсивно окисляющимися.
Концентрация растворенного кислорода в воде зависит и от природных факторов – атмосферного давления, температуры воды, содержания в ней растворенных солей.
Йодометрическое определение растворенного кислорода по Винклеру
Метод основан на способности гидроксида марганца (II) окисляться в щелочной среде до гидроксида марганца (IV), количественно связывая при этом кислород. |
В кислой среде гидроксид марганца (IV) вновь переходит в двухвалентное состояние, окисляя при этом эквивалентное связанному кислороду количество йода. Выделившийся йод оттитровывают тиосульфатом натрия. Предел обнаружения растворенного кислорода 0,05 мг/л.
Определению мешают взвешенные и органические вещества, нитриты, двух- и трехвалентное железо, а также другие окисляющие и восстанавливающие вещества. Их влияние устраняют в ходе анализа.

1. Кислородные склянки вместимостью 100-200 мл с притертой пробкой, калиброванные с точностью до 0,1 мл. Калибровка производится взвешиванием. Объем склянки определяют по разности массы склянки, полностью заполненной дистиллированной водой при 20°С и закрытой пробкой, и массы пустой сухой склянки, также закрытой пробкой. Склянки и соответствующие пробки нумеруют. Пригодны и склянки с водяными затворами.

1. Сульфат или хлорид марганца (II), раствор.
Растворяют 400 г MnSО4 ‒ 2H2О (или 480 г MnSО4 + 4H2О, или 364 г MnSО4 + H2O, или 425 г MnCI2 + 4H2О) в дистиллированной воде и доводят объем до 1 л. Фильтруют через бумажный фильтр или сливают через сифон после полного отстаивания осадка.
Разбавленный раствор в кислой среде при добавлении йодида калия не должен выделять свободного йода.
2. Щелочный раствор йодида калия:
а) растворяют 150 г йодида калия в 100 мл дистиллированной воды; при подкислении разбавленный раствор не должен выделять йода;
б) растворяют 500 г гидроксида натрия или 700 г гидроксида калия в 500 мл дистиллированной прокипяченной (для удаления диоксида углерода) воды. Оба раствора смешивают и доводят объем до 1 л.
3. Хлористоводородная кислота, разбавленный 2:1 раствор.
4. Серная кислота пл. 1,84 r/см3 и разбавленный 1:4 раствор.
5. Ортофосфорная кислота пл. 1,7 г/cм3.
6. Тиосульфат натрия, 0,02 н. раствор.
7. Йод, 0,02 н. раствор в насыщенном растворе NaCl.
8. Йодид калия. При подкислении не должен выделять йода.
9. Азид натрия, 0,5%-й раствор.
10. Крахмал, 0,5%-й раствор.
11. Сульфаминовая кислота или мочевина, 40% -й раствор.
12. Роданид калия. В 200 мл 25% сульфата натрия растворяют 2 г KCNS.
13. Смешанный раствор гипохлорита и сульфата натрия.
В 1 л дистиллированной воды растворяют 250 г Na2SО4 + 10Н2О.
Этот раствор (200 мл) смешивают с 30 мл 3% NaClO и хранят в темной склянке; 1 мл раствора соответствует 4-5 мл 0,02 н. тиосульфата натрия. Концентрация активного хлора в этом растворе убывает медленно, но периодически необходимо добавлять каплю гипохлорита натрия
14. Ацетат натрия или калия, насыщенный раствор.

При взятии пробы на кислород соблюдают все меры предосторожности против попадания в пробу атмосферного воздуха. Пробу берут в калиброванную склянку на 100-200 мл с притертой пробкой.
При взятии пробы на кислород с помощью батометра резиновую трубку опускают до дна склянки, пропуская несколько объемов воды, и наполняют так, чтобы вода переливалась через край.
Можно отбирать пробу следующим образом. Склянку с грузом и закрытой пробкой опускают на требуемую глубину, открывают пробку шнуром, привязанным к пробке, и держат на намеченной глубине до прекращения выхода пузырьков воздуха. Вынутая склянка должна быть наполнена до краев.
Кислород фиксируют на месте тотчас же после отбора пробы. Для этого в нее вводят пипеткой 1 мл сульфата или хлорида марганца и 1 мл щелочного раствора йодида калия на 100-150 мл пробы. После введения реактивов закрывают склянку пробкой, следя за тем, чтобы в ней не осталось пузырьков воздуха. Затем содержимое тщательно перемешивают многократным резким перевертыванием склянки. Пробу можно оставить для транспортировки, но не больше чем на 1 сутки.
Перед титрованием (осадок должен хорошо осесть) приливают 5 мл хлористоводородной кислоты (2:1), при этом часть жидкости сливается через край, что не имеет значения для определения. Склянку закрывают пробкой (воздуха под пробкой не должно быть) и содержимое тщательно перемешивают.
Осадок гидроксида марганца, выпавший в щелочной среде, растворяется, окисляет йодистые соединения, выделившийся йод окрашивает раствор в желтый цвет. После этого всю пробу переливают в колбу на 250-300 мл и быстро титруют 0,02 н. тиосульфатом натрия при непрерывном помешивании до слабо-желтого цвета, после чего прибавляют 1 мл 0,5%-го крахмала и продолжают по каплям титровать до исчезновения синей окраски. Окраска должна исчезнуть от одной капли тиосульфата.
Содержание растворенного кислорода в воде (мг/л) рассчитывают по формуле
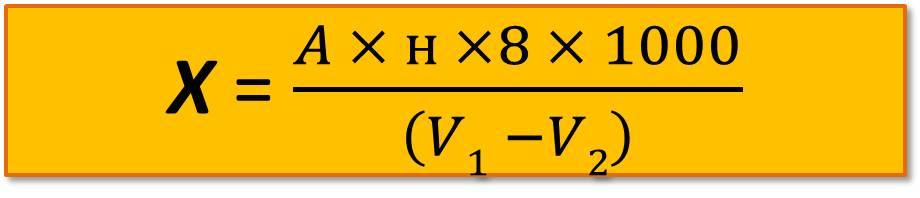
где А – объем тиосульфата, пошедшего на титрование пробы, мл;
н – нормальность тиосульфата с учетом поправки;
8 – эквивалентная масса кислорода, соответствующая 1 мл 1 н. тиосульфата;
V1 – объем пробы в склянке, мл;
V2 – объем воды, вылившейся при введении реактивов для фиксации кислорода, мл.
Кроме абсолютного значения количества растворенного кислорода, вычисляют насыщение воды по отношению к нормальному содержанию кислорода при данной температуре и давлении в процентах. Для этого пользуются табл. 5.18, где дано нормальное содержание кислорода при различной температуре, давлении 760 мм рт. ст. и общей минерализации воды до 1000 мг/л.
Таблица 5.18 - Концентрации кислорода при атмосферном давлении 760 мм рт. ст. (1013 гПа)
Темпе ратура, °С |
Растворенный кислород, мг/л |
|||||||||
0,0 |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
0,8 |
0,9 |
|
0 |
14,65 |
14,61 |
14,57 |
14,53 |
14,49 |
14,45 |
14,41 |
14,37 |
14,33 |
14,20 |
1 |
14,25 |
14,21 |
14,17 |
14,13 |
14,09 |
14,05 |
14,02 |
13,98 |
13,94 |
13,90 |
2 |
13,86 |
13,82 |
13,79 |
13,75 |
13,71 |
13,68 |
13,64 |
13,60 |
13,56 |
13,53 |
3 |
13,49 |
13,46 |
13,42 |
13,38 |
13,35 |
13,31 |
13,28 |
13,24 |
13,20 |
13,17 |
4 |
13,13 |
13,10 |
13,06 |
13,03 |
13,00 |
12,96 |
12,93 |
12,80 |
12,86 |
12,82 |
5 |
12,79 |
12,76 |
12,72 |
12,69 |
12,66 |
12,52 |
12,59 |
12,56 |
12,53 |
12,49 |
6 |
12,46 |
12,43 |
12,40 |
12,36 |
12,33 |
12,30 |
12,27 |
12,24 |
12,21 |
12,18 |
7 |
12,14 |
12,11 |
12,08 |
12,05 |
12,02 |
11,99 |
11,96 |
11,93 |
11,90 |
11,87 |
8 |
11,84 |
11,81 |
11,78 |
11,75 |
11,72 |
11,70 |
11,67 |
11,64 |
11,61 |
11,58 |
9 |
11,55 |
11,52 |
11,49 |
11,47 |
11,44 |
11,41 |
11,38 |
11,35 |
11,33 |
11,30 |
10 |
11,27 |
11,24 |
11,22 |
11,19 |
11,16 |
11,14 |
11,11 |
11,08 |
11,06 |
11,03 |
11 |
11,00 |
10,98 |
10,95 |
10,93 |
10,90 |
10,87 |
10,85 |
10,82 |
10,80 |
10,77 |
12 |
10,75 |
10,72 |
10,70 |
10,67 |
10,65 |
10,62 |
10,60 |
10,57 |
10,55 |
10,52 |
13 |
10,50 |
10,48 |
10,45 |
10,43 |
10,40 |
10,38 |
10,36 |
10,33 |
10,31 |
10,28 |
14 |
10,26 |
10,24 |
10,22 |
10,19 |
10,17 |
10,J5 |
10,12 |
10,10 |
10,08 |
10,06 |
15 |
10,03 |
10,01 |
9,99 |
9,97 |
9,95 |
9,92 |
9,90 |
9,88 |
9,86 |
9,84 |
16 |
9,82 |
9,79 |
9,77 |
9,75 |
9,73 |
9,71 |
9,69 |
9,67 |
9,65 |
9,63 |
17 |
9,61 |
9,58 |
9,56 |
9,.54 |
9,52 |
9,50 |
9,48 |
9,46 |
9,44 |
9,42 |
18 |
9,40 |
9,39 |
9,36 |
9,34 |
9,32 |
9,30 |
9,29 |
9,27 |
9,25 |
9,23 |
19 |
9,21 |
9,19 |
9,17 |
9,15 |
9,13 |
9,12 |
9,10 |
9,08 |
9,06 |
9,04 |
20 |
9,02 |
9,00 |
8,98 |
8,97 |
8,95 |
8,93 |
8,91 |
8,90 |
8,88 |
8,86 |
21 |
8,84 |
8,82 |
8,81 |
8,79 |
8,77 |
8,75 |
8,74 |
8,72 |
8,70 |
8,68 |
22 |
8,67 |
8,65 |
8,63 |
8,62 |
8,60 |
8,58 |
8,56 |
8,55 |
8,53 |
8,52 |
23 |
8,50 |
8,48 |
8,46 |
8,45 |
8,43 |
8,42 |
8,40 |
8,38 |
8,37 |
8,35 |
24 |
8,33 |
8,32 |
8,30 |
8,29 |
8,27 |
8,25 |
8,24 |
8,22 |
8,21 |
8,19 |
25 |
8,18 |
8,16 |
8,14 |
8,13 |
8,11 |
8,11 |
8,08 |
8,07 |
8,05 |
8,04 |
26 |
8,02 |
8,01 |
7,99 |
7,98 |
7,96 |
7,95 |
7,93 |
7,92 |
7,90 |
7,89 |
27 |
7,87 |
7,86 |
7,84 |
7,83 |
7,81 |
7,80 |
7,78 |
7,77 |
7,75 |
7,74 |
28 |
7,72 |
7,71 |
7,69 |
7,68 |
7,66 |
7,65 |
7,64 |
7,62 |
7,61 |
7,59 |
29 |
7,58 |
7,56 |
7,55 |
7,54 |
7,52 |
7,51 |
7,49 |
7,48 |
7,47 |
7,45 |
30 |
7,44 |
7,42 |
7,41 |
7,40 |
7,38 |
7,37 |
7,35 |
7,34 |
7,32 |
7,31 |
Насыщение воды кислородом рассчитывают по формуле

где А – количество кислорода, мг/л, по анализу;
Н – нормальное количество кислорода при данной температуре и давлении (P1) 760 мм рт. ст., или 1013 гПа;
Р2 – давление фактическое, мм рт. ст. или гПа.
Определение в присутствии мешающих веществ
Если вода содержит много органических веществ или минеральных восстановителей, то необходимо вводить поправку на их йодопотребление.
Для этого исследуемую воду отбирают в две склянки одинакового объема и затем пипетками с длинными носиками вносят в каждую по 3-5 мл 0,02 н. йода в насыщенном растворе хлорида натрия.
Склянки закрывают пробками, перемешивают и через 5 мин вносят по 1 мл щелочного раствора йодида калия в обе склянки, а затем в склянку «а» – 1 мл соли марганца, в склянку «б» – 1 мл дистиллированной воды. Закрывают пробками и перемешивают.
После оседания осадка в обе склянки вносят в одинаковом количестве кислоту и оттитровывают тиосульфатом йод.
Содержание растворенного кислорода (мг/л) рассчитывают по формуле
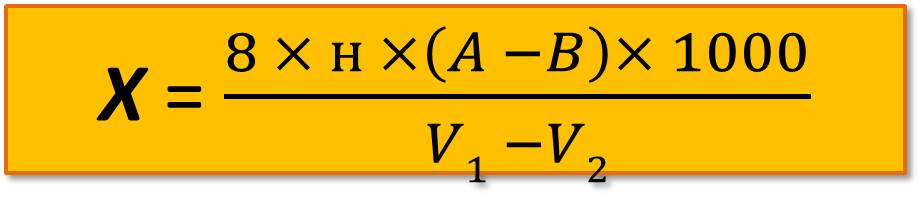
где В – объем 0,02 н. раствора тиосульфата, пошедшего на титрование раствора в склянке «б», мл;
А – то же для склянки «а»;
н – нормальность раствора тиосульфата с учетом поправки;
8 – эквивалентная масса кислорода, соответствующая 1 мл 1н. тиосульфата;
V1 – объем кислородной склянки, мл;
V2 – объем всех реактивов, внесенных в воду для осаждения кислорода, мл.
Если склянки неодинакового объема, необходимо вносить соответствующие поправки в расчеты.
В присутствии восстановителей кислород определяют по Россу: в кислородную склянку прибавляют сначала 0,5 мл серной кислоты (1:4), затем 0,5 мл смешанного реактива – гипохлорит и сульфат натрия, после этого ее закрывают пробкой, взбалтывают и ставят в темное место на 30 мин.
Для устранения избытка гипохлорита натрия добавляют 1 мл роданида калия и перемешивают. Через 10 мин приступают к определению кислорода.
При содержании железа (III) менее 1 мг/л его влиянием можно пренебречь. При концентрации 1-50 мг/л для растворения осадка необходима ортофосфорная кислота пл. 1,70 г/см3.
При содержании азота нитритов более 0,05 мг/л определить растворенный кислород прямым методом Винклера затруднительно, так как нитриты в кислой среде, действуя как катализатор, способствуют окислению йодида до йода кислородом воздуха, что приводит к повышенному расходу тиосульфата и мешает окончанию титрования, поскольку синяя окраска индикатора восстанавливается.
Для устранения мeшающего влияния нитритов можно применить один из следующих приемов:
1) перед растворением осадка в кислоте следует внести в склянку несколько капель 5%-го азида натрия;
2) вместо азида натрия можно использовать 40%-ю мочевину или сульфаминовую кислоту. В этом случае меняется порядок прибавления реактивов: гидроксид марганца осаждают 70%-м гидроксидом калия или 50%-м гидроксидом натрия, растворяют осадок в кислоте, добавляют 0,15 мл 40%-й сульфаминовой кислоты или мочевины и затем 15%-й йодид калия. Далее продолжают определение;
3) при содержании азота нитритов не более 1-2 мг/л правильные результаты можно получить, если после растворения осадка в кислоте быстро повысить активную реакцию среды до рН 4, добавляя буферный раствор ацетата калия или натрия.
Необходимое количество ацетатного раствора зависит от объема склянок, количества прибавляемых реактивов и кислоты, поэтому его можно установить для одних и тех же склянок постоянным. Для этого после оттитровывания йода (специальный холостой опыт) в колбу вносят несколько капель индикатора бромфенолового синего и из пипетки прибавляют в колбу при помешивании раствор ацетата калия до перехода окраски из желтой в синевато-голубую (рН около 4). Установленное таким образом количество раствора ацетата калия вносят предварительно в колбу, в которую затем переносят пробу для титрования.
Модификация определения кислорода по Винклеру
Метод основан на количественном связывании кислорода гидратом закиси марганца в щелочной среде, подкислении раствора для перевода окисленного марганца в двухвалентное соединение и окисление при этом эквивалентного (связанному кислороду) количества йода. Выделившийся йод определяется титрованием тиосульфатом натрия. Конец титрования определяется по исчезновению синей окраски, образуемой при добавлении водного раствора крахмала.
Определению мешают взвешенные и органические вещества, например, двух- и трехвалентное железо, а также другие окисляющие и восстанавливающие вещества. Метод точен, ошибка не превышает 0,5%.

1. Щелочной раствор йодистого калия: 70 г КОН + 15г КI растворить в 100 мл дистиллированной воды.
2. Хлорид или сульфат марганца (II), раствор.
Растворяют 425 г MnCl2 + 4H2O, или 400 г MnCl2 + 2H2O, или 480 г MnSO4 + 4H2O, или 364 г MnSO4 + 2H2O в дистиллированной воде и доводят объем до 1л. Фильтруют через бумажный фильтр или сливают через сифон после полного отстаивания осадка.
3. Тиосульфат натрия 0,01 н. раствор. Исходный раствор тиосульфата натрия (Na2S2O3 + 5H2O) готовят из фиксанала в охлажденной дистиллированной воде. К полученному раствору тиосульфата натрия добавляют карбонат натрия из расчета 0,2 г на 1л воды. Раствор оставляют стоять на 10-15 дней.
Хранят растворы в темных склянках.
4. Крахмал, 0,5%-й раствор. На 0,5 г растворимого крахмала добавляют 5 мл дистиллированной воды и 95 мл кипящей дистиллированной воды.
5. Концентрированная серная или соляная кислота.

1. Колбы мерные вместимостью 1000 мл.
2. Цилиндры мерные вместимостью 50 или 100 мл.
3. Колбы конические вместимостью 200 или 250 мл.
4. Бюретки вместимостью 25 мл.
5. Стаканчик для взвешивания (бюкс).
6. Весы аналитические.

Определение кислорода ввиду зависимости его содержания от температуры воды необходимо проводить при обязательном измерении температуры воды.
При определении кислорода склянку с притертой пробкой (объем 100-200 мл) ополаскивают водой и наполняют так, чтобы вода переливалась через край.
Сразу же вводят пипеткой 1 мл MnCl2 или MnSO4 и 1 мл KI + KOH для фиксации растворенного кислорода. После введения реактивов закрывают склянку пробкой, следя за тем, чтобы в склянке не оставалось пузырьков воздуха, и содержимое тщательно перемешивают многократным резким перевертыванием.
Перед титрованием приливают 1 мл концентрированной соляной или серной кислоты (2-3 капли); при этом часть жидкости сливается через край. Склянку закрывают пробкой, и содержимое тщательно взбалтывают. Осадок растворяется, жидкость становится желтой от выделения йода. Затем пробу переливают в колбу (250-300 мл), к ней добавляют 2-3 капли крахмала и титруют 0,05 н. раствором тиосульфата натрия до исчезновения окраски.

Пересчет мг О2 на 1 л воды проводится по формуле
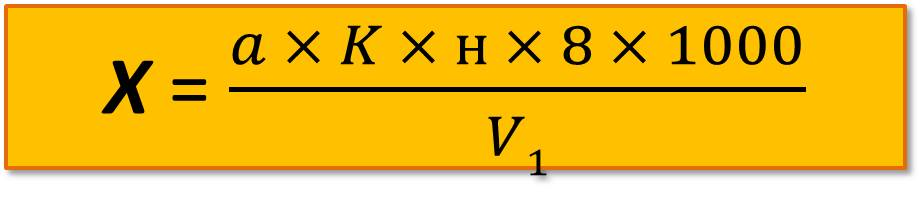
где н – нормальность раствора тиосульфата натрия (обычно 0,01 н.);
а – количество раствора тиосульфата натрия, пошедшего на титрование, мл ;
V1 – объем склянки, в которой фиксировалась проба, мл;
К – поправка для приведения концентрации растворенного тиосульфата натрия к точно используемой нормальности.
Укороченный метод определения растворенного кислорода по Винклеру (по объему кислорода)

1. Кислородные склянки вместимостью 50 и 200 мл с притертой пробкой. Склянки и соответствующие пробки нумеруют.

1. Хлорид марганца (II), раствор. Растворяют 4 г в дистиллированной воде и доводят объем до 10 мл. Фильтруют через бумажный фильтр или сливают через сифон после полного отстаивания осадка.
2. Щелочный раствор йодида:
а) растворяют 2 г КI в 5 мл дистиллированной воды;
б) растворяют 3,3 г гидроксида натрия в 5 мл дистиллированной прокипяченной (для удаления диоксида углерода) воды. Оба раствора смешивают и доводят объем до 1 л.
3. Хлористоводородная кислота (HCl).
4. Тиосульфат натрия (Na2S2O3 + 5Н2О), 0,01М раствор.
5. Крахмал, 0,5%-й раствор.

Пробу берут в склянку на 200 мл с притертой пробкой, чтобы вода переливалась через край. Вынутая склянка должна быть наполнена до краев.
Кислород фиксируют на месте тотчас же после отбора пробы. Для этого в нее вводят пипеткой 2 мл хлорида марганца и 2 мл щелочного раствора йодида калия на 200 мл пробы. Конец пипетки должен касаться дна бутылки.
Осадок должен хорошо осесть. После этого пробу в 50 мл переливают в другую колбу и титруют 0,01 М тиосульфатом натрия при непрерывном помешивании до слабо-желтого цвета. Прибавляют 1 мл 0,5%-го крахмала и продолжают по каплям титровать воду до исчезновения синей окраски. Окраска должна исчезнуть от одной капли тиосульфата. Записывают объем тиосульфата по каждой пробе.
Содержание растворенного кислорода в воде (см3/л) рассчитывают по формуле, учитывая, что 1мл 0,01 М раствора тиосульфата соответствует 0,056 мл кислорода:

где А – объем тиосульфата, пошедшего на титрование 50 см3 воды, мл.
