Тема 1
ОБЩАЯ И АКТИВНАЯ КИСЛОТНОСТЬ РАСТВОРОВ. ПОНЯТИЕ ВОДОРОДНОГО ПОКАЗАТЕЛЯ
Студент должен уметь рассчитать численную концентрацию ионов при известном отрицательном логарифме их молярной концентрации; пересчитать численную (количественную) концентрацию в массовую концентрацию ионов.
Общая кислотность раствора показывает общее количество кислотореагирующих веществ, находящихся в растворе, и не зависит от степени их диссоциации. Эквивалентные по концентрации растворы любых кислот имеют одинаковую общую кислотность. Общая кислотность двух эквивалентных по концентрации растворов сильной и слабой кислот зависит не от природы кислоты, а от ее концентрации в растворе. Она выражается количеством грамм-эквивалентов щелочи, идущих на титрование 1 л исследуемого раствора.
Исходя из уравнения Nк · Vк = Nщ · Vщ, расчет общей кислотности проводят по формуле:
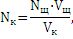
где Nк – количество грамм-эквивалентов кислоты;
Nщ – количество грамм-эквивалентов щелочи;
Vщ – объем щелочи, мл;
Vк – объем кислоты, мл.
Общая кислотность обычно определяется параллельно с определением активной кислотности раствора.
Под активной кислотностью понимают кислотность, обусловленную концентрацией свободных ионов водорода в растворе. Активная кислотность зависит от степени диссоциации находящихся в растворе кислот или других кислотореагирующих веществ и характеризуется величиной рН.
Активная кислотность определяется двумя методами (методы могут иметь разновидности) — колориметрическим и потенциометрическим (электрометрическим).
Понятие водородного показателя. Вода является слабым электролитом и лишь в незначительной степени диссоциирует на ионы:
Н2О↔Н++ОН–.
В 1 л воды только 10–7 моль молекул распадается на ионы, образуя соответственно 10–7 моль ионов водорода и 10–7 моль гидроксил-ионов. Значит, концентрация ионов водорода и концентрация гидроксил-ионов в чистой воде соответственно равны [Н+]=10–7 моль/л и [ОН-]=10–7 моль/л.
Для воды, как и для любого водного раствора, произведение концентраций ионов Н+ и ОН– – величина постоянная, равная 10-14. Эта постоянная называется ионным произведением воды и обозначается КВ:
КВ=[Н+][ОН–]=10 –14.
Растворы, в которых концентрация ионов водорода равна концентрации ионов гидроксила, называются нейтральными.
Если к воде добавить кислоту, то концентрация ионов водорода станет больше, чем 10–7, а концентрация ионов гидроксила меньше 10–7 моль/л.
В кислой среде
[Н+]>[ОН–]
При добавлении к воде щелочи увеличивается концентрация ионов гидроксила. Таким образом, в щелочной среде
[ОН–]>[Н+]
Однако как бы не изменялись значения [Н+] и [ОН–], их произведение всегда остается равным 10–14. Если известно [Н+], легко подсчитать [ОН–] и наоборот. Например, если в водном растворе
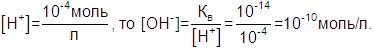
Десятичный логарифм концентрации ионов водорода с обратным знаком называют водородным показателем и обозначают pH:
pH= – lg[H+]
Аналогично, логарифм концентрации ионов гидроксила с обратным знаком называют гидроксильным показателем и обозначают pOH:
рOH = –lg[OH–].
Если уравнение [H+]•[OH-]=10-14 прологарифмировать и изменить у логарифмов знаки на обратные, то получим: -lg[H+]+ -lg[OH-]=14 или рН+рОН=14
На практике кислотность или щелочность растворов выражают через концентрацию ионов водорода. Так, если:
[Н+]=10 –7, то раствор нейтральный;
[Н+]>10–7, то раствор кислый;
[Н+]<10–7, то раствор щелочной.
На схеме (рис. 1) видно, что нейтральный раствор имеет рН=7,0, в кислой среде рН<7,0, а в щелочной среде рН>7,0.
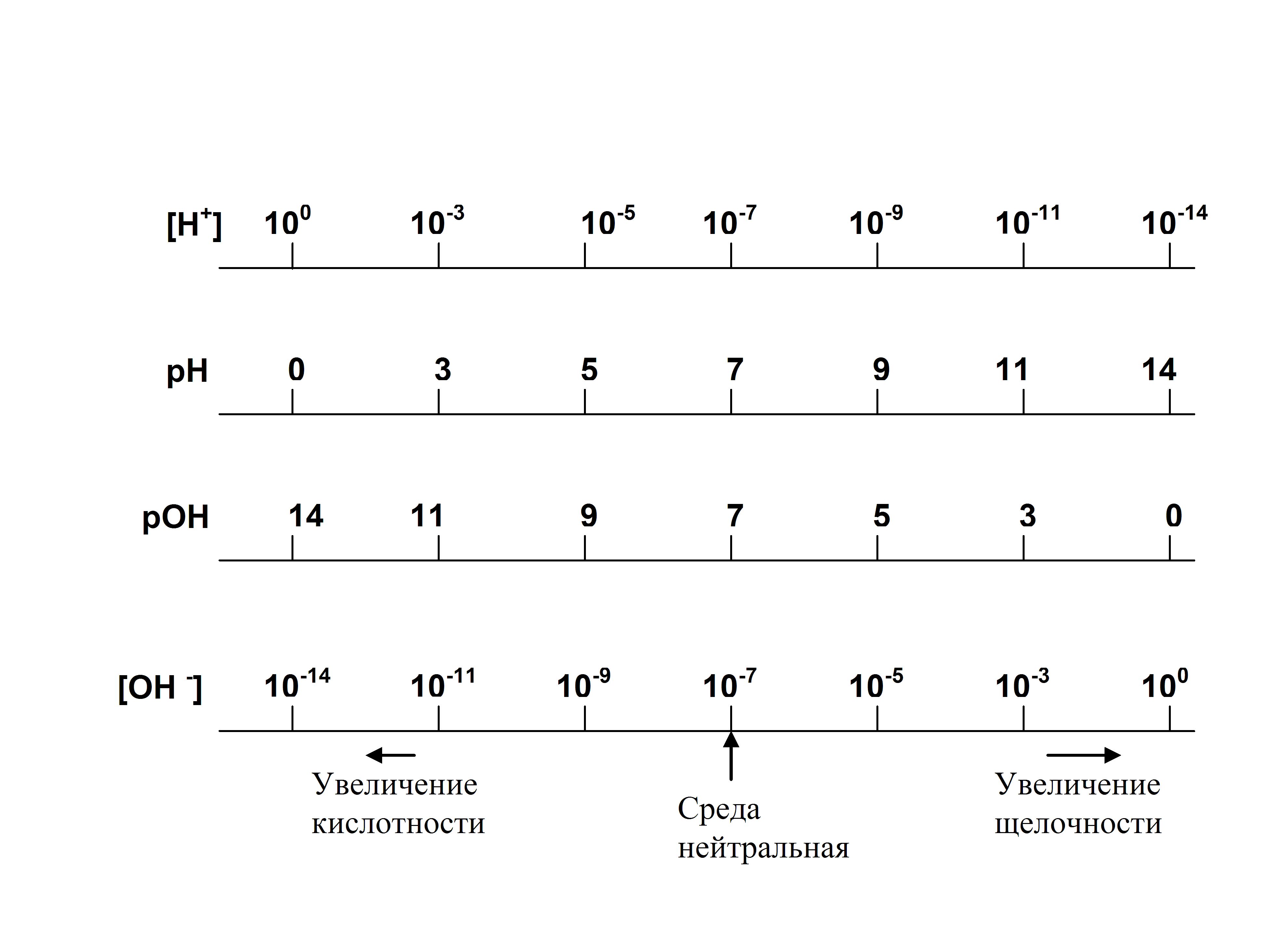
Рис. 1. Шкала водородного показателя
В растворах количественный водородный показатель вычисляется через отрицательный десятичный логарифм от концентрации ионов водорода: рН = –lg[Н+]. Если в раствор ввести некоторое количество сильной кислоты, которая полностью ионизируется, то концентрация ионов водорода будет равна концентрации кислоты. Например, раствор хлороводорода, содержащий 36,5 мг НСl в 1 л, т.е. 10-3 моль/л НСl, будет иметь концентрацию ионов водорода 10–3 моль/л и, следовательно, рН 3,0. В растворе, содержащем 40 мг/л NaOH, т.е. имеющем концентрацию щелочи 10–3 моль/л, концентрация ионов водорода равна 10–14/10–3=10–11 и, следовательно, рН 11,0.
|
- Работа 1.1. Вычисление рН раствора с известным отрицательным логарифмом концентрации ионов водорода и гидроксила - Работа 1.2. Переход от величины концентраций ионов к рХ и наоборот |