Организация самостоятельной работы
Приложение 8
Электрофорез
Электрофорез представляет собой одну из модификаций хроматографии, применяемую для разделения молекул, несущих заряды. В хроматографической среде под влиянием приложенного электрического поля одна сторона оказывается заряженной положительно, а другая – отрицательно. Отдельные молекулы в разделяемой смеси движутся к той или другой стороне в зависимости от их относительных масс и зарядов. Электрофорез широко применяется для выделения и идентификации аминокислот, ферментов и белков. Дальнейшее усовершенствование методики достигается регулированием рН среды. В растворе между электродами ток обусловлен ионами буфера и образца, а в остальной части цепи – электронами. Ток в цепи поддерживается за счет электролиза, происходящего на электродах, каждый из которых погружен в большую буферную камеру. В процессе электролиза на катоде образуются ионы гидроксила и молекулярный водород, а на аноде – молекулярный кислород и ионы водорода:
Катод Анод
2ē + 2Н2О + 2ОН– + Н2↑ Н2О → 2Н+ + ½О2↑ + 2 ē
Образование на катоде гидроксильных ионов приводит к увеличению диссоциации компонента буферной смеси (НА), представляющего собой слабую кислоту. Вследствие этого возрастает количество ионов А –, проводящих ток к аноду. На аноде ионы А – соединяются с протонами, при этом снова образуется НА, а электроны поступают в электрическую цепь.
Существует много различных типов носителей: листы хроматографической бумаги, тонкие слои окиси кремния или алюминия, крахмальные, агаровые и полиакриламидные гели, которые насыщают соответствующим буфером. Разделяемые вещества движутся в виде отчетливых зон, которые легко обнаружить соответствующим аналитическим методом.
Факторы, влияющие на подвижность молекул образца
Электрофоретическая подвижность заряженных молекул зависит от ряда факторов.
Заряд. Подвижность возрастает с увеличением суммарного заряда. Величина заряда обычно зависит от рН.
Размеры. Чем крупнее молекулы, тем меньше их подвижность. Это связано с возрастанием сил трения и электростатических взаимодействий крупных молекул с окружающей средой по сравнению с маленькими молекулами.
Форма. Молекулы одинакового размера, но различной формы, например фибриллярные и глобулярные белки, обладают разной подвижностью, что обусловлено различиями в силе трения и электростатическом взаимодействии.
Электрическое поле. Согласно закону Ома, сила тока в амперах (I), напряжение в вольтах (V) и сопротивление в омах (R) связаны следующим соотношением: I = V/ R. На разделение ионов в электрическом поле влияют все три фактора.
Сила тока. Ток в растворе между электродами обусловлен исключительно переносом ионов буфера и образца. Скорость перемещения ионов и буфера, и образца пропорциональна силе тока. Длина пути, пройденного ионами, будет пропорциональна времени протекания тока. Для максимальной воспроизводимости результатов сила тока в процессе электролиза не должна меняться. Ток должен быть постоянным.
Напряжение. Миграция молекул пропорциональна падению напряжения в поддерживающей среде, или градиенту напряжения, выражаемому в вольтах (В·см–1) (приложенное напряжение, деленное на длину слоя носителя). Используются как низкие (100–500 В), так и высокие (500–10000 В) напряжения с градиентами до 20 и 200 В · см–1 соответственно. Высокие напряжения применяют в основном для разделения низкомолекулярных веществ.
Сопротивление. Скорость миграции обратно пропорциональна сопротивлению. Сопротивление, в свою очередь, зависит от типа и размеров носителя и от ионной силы буфера. Сопротивление возрастает с увеличением длины слоя носителя и уменьшается при увеличении его ширины, а также с возрастанием концентрации буферных ионов.
В ходе электрофореза выделяется тепло, количество которого в единицу времени равно I2R Вт, при этом сопротивление уменьшается. При постоянном напряжении такое нагревание приведет к увеличению силы тока и усиленному испарению растворителя. Для обеспечения стабильности используют стабилизированные источники питания, которые автоматически поддерживают на постоянном уровне либо напряжение, либо силу тока несмотря на изменение сопротивления. Аппарат помещается под воздухонепроницаемую крышку и в него встраивается охлаждающая система.
Буфер. Буфер создает и стабилизирует рН носителя, а также самым различным образом влияет на скорость миграции веществ.
Применяемые буферы – ацетатный, цитратный, фосфатный, трис, ЭДТА и пиридиновый. Буферы служат для образцов растворителями, концентрация от 0,05 до 0,1 М.
Носители. Бумага – самый простой и наиболее широко применяемый электрофоретический носитель.
Тонкие слои: окиси кремния, кизельгура, окиси алюминия или целлюлозы наносят на стеклянные пластинки, как и при тонкослойной хроматографии. Пластины помещают в аппарат горизонтально. Можно проводить двухмерную разгонку.
Гели – агаровые, крахмальные, полиакриламидные и др. готовят непосредственно перед использованием. Наиболее широко используют полиакриламидные гели:
– размер пор у них можно варьировать в широких пределах;
– их можно формовать в калиброванных трубках и, следовательно, получать воспроизводимые результаты;
– их можно применять с самыми разными буферами;
– разделение проходит очень быстро;
– адсорбция и электроосмос низки;
– они не поглощают ультрафиолетовый свет при 270 нм и, значит, местоположение белков после разделения можно определить по поглощению при этой длине волны;
– после разделения макромолекулы можно окрашивать и определять количество вещества с помощью денситометра.
Полиакриламидные гели получают при сополимеризации акриламида:
О
║
–СН2–С–NН2
и его производных, обеспечивающих поперечные связи в присутствии катализатора, содержащих аммоний.
Наиболее широко используется диск-электрофорез.
Разделение белков электрофорезом в полиакриламидном геле
Электрофорез в полиакриламидном геле обладает высокой чувствительностью и хорошей разделяющей способностью. С помощью этого метода можно продемонстрировать многообразие белковых фракций, выделить индивидуальные белки, а в сочетании со специфическими реактивами получить зимограммы, показывающие изоферментный состав того или иного фермента.
Микроварианты метода дают возможность анализировать небольшие (50-100 мкг) образцы белков с минимальной затратой реактивов.
Метод горизонтального электрофореза дает возможность наблюдать одновременную картину разделения анионных и катионных белков, тогда как вертикальный микроэлектрофорез позволяет видеть отдельно либо анионные, либо катионные белки.
Электрофоретическим методом можно исследовать очищенные препараты белков и неочищенные экстракты из тканей. Целесообразно использовать свежеполученные белковые экстракты или нативные препараты белков из разных органов растений. Для сохранения растительного материала для последующих электрофоретических исследований его фиксируют жидким азотом или твердой углекислотой и высушивают лиофилизацией.
Принцип метода. Электрофорез – движение заряженных частиц в растворе под влиянием электрического поля. Движение частиц при электрофорезе зависит от размеров, формы, концентрации электрического заряда, степени гидратации и степени диссоциации самих частиц, от вязкости, рН, температуры и ионной силы среды, от напряженности электрического поля, продолжительности электрофореза и длины пути, пройденного частицей.
Соотношения между электрофоретической подвижностью, скоростью передвижения, напряженностью поля, величиной рН и ионной силой одинаковы для свободного электрофореза и для электрофореза в носителе. В последнем случае на подвижность и четкость разделения влияют также адсорбция, неоднородность вещества носителя и его ионообменные свойства, электроосмос, капиллярный эффект, повышение температуры и разбавление. Полиакриламидный гель обладает тем преимуществом, что при использовании его в качестве носителя влияние адсорбции и электроосмоса исключается.
Для аналитического разделения растительных белков чаще применяют диск-электрофорез. Диск-электрофорез (от английского слова discontinues — прерывистый) — метод разделения, в котором используется неоднородная («прерывистая») разделяющая система с полиакриламидным гелем в качестве носителя. При диск-электрофорезе используют пары буферов разного состава и с разными значениями рН, а носитель состоит из отдельных слоев геля, отличающихся по размерам пор. Разделяемые вещества концентрируются сначала в узкой стартовой зоне, что обеспечивает четкое разделение смеси.
Высокая разделяющая способность диск-электрофореза основывается на двух физических явлениях:
1) эффекте концентрирования, в основе которого лежит выведенное Кольраушем соотношение, называемое регулирующей функцией; он состоит в том, что смеси перед разделением на компоненты концентрируются в четко ограниченной зоне;
2) эффекте молекулярного сита — отдельные молекулы разделяются при электрофорезе не только по их общему электрическому заряду, но также и по величине (что определяется молекулярной массой) и по форме молекул, которая зависит от третичной структуры белков.
При разделении растворимых компонентов смесь сначала концентрируется в узкой полосе крупнопористого полиакриламидного геля, а затем в мелкопористом геле ее компоненты распределяются по величине, форме и заряду молекул.
Аппаратура. Для вертикального микроэлектрофореза необходимы электродные сосуды, набор стеклянных трубок, подставка для трубок, источник питания и приспособление для охлаждения электрофоретической камеры.
В качестве нижнего электродного сосуда может служить цилиндрический химический стакан емкостью 1 л, верхний сосуд можно изготовить из полиэтиленовой банки (рис. 8.1).
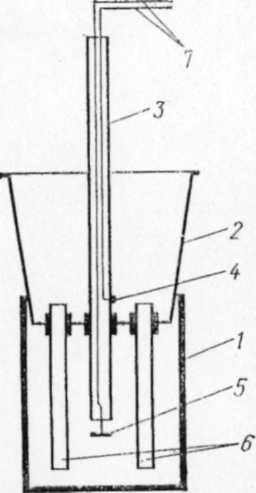
Рис. 8.1. Схема электрофоретической камеры:
1 – нижний электродный сосуд; 2 – верхний электродный сосуд; 3 – стеклянная трубка с платиновыми электродами; 4 – верхний электрод; 5 – нижний электрод; 6 – электрофоретические трубки; 7 – провода для соединения с источником питания
Для этого в дне банки просверливают отверстия: одно в центре и 9-12 — по окружности для установки электрофоретических трубок. В центральном отверстии с помощью резиновой муфты укрепляют длинную стеклянную трубку с нижним и верхним платиновыми электродами, которые припаивают к концам проводов с полихлорвиниловой изоляцией (места спаев тщательно изолируют). Платиновые электроды изготовляют в виде колец. Верхний электрод устанавливают на высоте 1 см от дна банки, нижний — на расстоянии 7 см от верхнего.
Электрофоретические трубки с внутренним диаметром 5 мм и длиной 75 мм укрепляют в отверстиях в дне верхнего сосуда при помощи отрезков резинового шланга.
Трубки точно подбирают по размерам, концы их слегка отшлифовывают. Перед работой трубки промывают хромовой смесью, тщательно ополаскивают дистиллированной водой и высушивают.
Подставка для трубок представляет собой полоску из плексигласа с высверленными отверстиями, диаметр которых несколько больше внешнего диаметра стеклянных трубок.
В качестве источников питания для электрофореза применяют выпрямители типа УИП-1 или стабилизированные выпрямители, имеющие устройство для поддержания заданной силы тока.
Верхний и нижний электродные сосуды заполняют буферным раствором. В собранном виде верхний сосуд не должен пропускать буферный раствор, что необходимо для нормального протекания процесса электрофореза. Для лучшего охлаждения трубок электрофоретическую камеру помещают в холодильник или в сосуд, заполненный водой со льдом.
Реактивы. Гели для электрофореза готовят непосредственно в электрофоретических трубках путем смешивания нескольких запасных растворов, которые содержат необходимые реактивы и могут сохраняться в течение 3-4 месяцев при температуре +4°С.
В зависимости от свойств подлежащих разделению белков готовят щелочной или кислый гель с различной концентрацией акриламида. Ниже приводится состав растворов для приготовления 7,5%-го полиакриламидного геля.
Состав запасных растворов и электродного буфера для электрофореза в щелочном геле.
Раствор А(Щ) (рН 8,9) – 1 н. НCl 48 мл, трис-оксиметиламинометан 36,6 г, тетраметилэтилендиамин 0,23 мл, вода до 100 мл.
Раствор Б(Щ) (рН 6,7) – 1 н. НС1 48 мл, трис-оксиметиламинометан 5,98 г, тетраметилэтилендиамин 0,46 мл, вода до 100 мл.
Раствор В – акриламид 30 г, N, N'-метилен-бисакриламид 0,8 г, вода до 100 мл.
Раствор Г – акриламид 10 г, N, N'-метилен-бисакриламид 2,5 г, вода до 100 мл.
Раствор Д – рибофлавин 4 мг, вода до 100 мл.
Раствор Е – сахароза 40 г, вода до 100 мл.
Раствор персульфата аммония – ПСА(Щ) (свежеприготовленный) – аммоний надсернокислый 0,14 г, вода до 100 мл.
Электродный буферный раствор (рН 8,3) – трис-оксиметиламинометан 6,0 г, глицин 28,8 г, вода до 1 л (перед использованием буфер разбавляют в 10 раз).
Индикатор – бромфеноловый синий 1 мг, вода до 100 мл.
Состав запасных растворов и электродного буфера для электрофореза в кислом геле.
Раствор А(к) (рН 4,3) – 1 н. КОН 48 мл, ледяная уксусная кислота 17,2 мл, тетраметилэтилендиамин 4,0 мл, вода до 100 мл.
Раствор Б(к) (рН 6,8) – 1 н. КОН 48 мл, ледяная уксусная кислота 2,87 мл, тетраметилэтилендиамин 0,46 мл, вода до 100 мл.
Растворы В, Г, Д, Е – как указано для щелочного геля.
Раствор персульфата аммония – ПСА(К) (свежеприготовленный) – аммоний надсернокислый 0,28 г, вода до 100 мл.
Электродный буферный раствор (рН 4,5) – β-аланин 31,2 г, ледяная уксусная кислота 8 мл, вода до 1 л (перед использованием буфер разбавляют в 10 раз).
Индикатор – метиловый зеленый 0,1 г, вода до 100 мл.
Все реактивы готовят на б и д и с т и л л и р о в а н н о й воде.
Приготовление гелей. Подготовленные к работе электрофоретические трубки имеют два слоя геля: в верхнем (крупнопористом) происходит концентрирование разделяемых веществ, а в нижнем (мелкопористом) – их разделение.
Трубки снизу заклеивают лейкопластырем и устанавливают вертикально в отверстия на подставке. Затем готовят рабочий раствор для синтеза мелкопористого геля (таблица).
Рабочие растворы для синтеза гелей
|
Гели для разделения в щелочной среде |
Гели для разделения в кислой среде |
||
|
Мелкопористый (рН 8,9) |
1 часть р-ра А(Щ) 2 части р-ра В 1 часть воды 4 части р-ра ПСА(Щ) |
Мелкопористый (рН 4,3) |
1часть р-ра А(к) 2 части р-ра В 1 часть воды 4 части р-ра ПСА(к) |
|
Крупнопористый (рН 6,7) |
1часть р-ра Б(Щ) 2 части р-ра Г 1 часть р-ра Д 4 части р-ра Е |
Крупнопористый (рН 6,8) |
1часть р-ра Б(к) 2 части р-ра Г 1 часть р-ра Д 4 части р-ра Е |
Смесь осторожно перемешивают и быстро заливают в электрофоретические трубки. В каждую трубку наливают по 1 мл геля, затем капилляром наслаивают сверху слои воды 5-10 мм и оставляют на 30-40 мин. В течение этого времени происходит полимеризация геля. Конец полимеризации устанавливают по образованию хорошо видимой границы раздела между гелем и слоем воды. После полимеризации воду осторожно стряхивают и ополаскивают 0,1-0,2 мл раствора крупнопористого геля. Затем в каждую трубку приливают по 0,15 мл этого же геля и наслаивают на него воду. Трубки выставляют на солнечный или люминесцентный свет для фотополимеризации. Через 20-30 мин образуется заметно опалесцирующий верхний гель. Воду из трубок осторожно стряхивают.
Ход анализа водо- и солерастворимых белков. Электрофоретические трубки присоединяют к верхнему электродному сосуду, вводя их в верхний сосуд на 1 см. Лейкопластырь с нижних концов трубок снимают. В нижний электродный сосуд наливают соответствующий электродный буферный раствор, разбавленный в 10 раз, и трубки полностью погружают в него. Чтобы на нижних концах трубок не осталось пузырьков воздуха, на них предварительно навешивают по капле буферного раствора. В установленные таким образом трубки вносят по 0,1-0,2 мл исследуемого раствора, содержащего около 0,1 мг белка. Для того чтобы внесенный раствор не перемешивался с буферным раствором в верхнем сосуде, в него перед внесением в трубки добавляют сахарозу до конечной концентрации 20-40%.
Исследуемый раствор готовят на воде или трис-глициновом буфере (рН 8,3), который используют в качестве электродного буферного раствора.
Легкорастворимые белки можно извлекать из семян и вегетативных органов растений трис-глициновым или 0,005 М фосфатным (рН 7,4) буфером.
Для очистки белков от низкомолекулярных веществ проводят их диализ против буферного раствора, которым они извлекались. Окисление фенольных веществ в экстрактах, полученных из вегетативных органов, предупреждают добавлением аскорбиновой кислоты (0,1-1%) и диэтил-дитиокарбамата натрия (0,05%).
После внесения исследуемого раствора трубки осторожно заполняют электродным буфером. Затем наливают буферный раствор в верхний электродный сосуд и приливают 1 мл соответствующего индикатора, чтобы следить за процессом разделения. Собранную электрофоретическую камеру помещают в холодильник.
При разделении белков в щелочном геле нижний электрод присоединяют к положительному, а в кислом геле – к отрицательному полюсу выпрямителя. В первые 15 мин пропускают ток силой 2 мА на трубку. После того как белки войдут в нижний гель, силу тока увеличивают до 4 мА. Напряжение обычно бывает 400-600 В.
Опыт заканчивают, когда зона индикаторной краски достигнет 3 мм от нижнего конца гелей (для этого требуется около 1 ч). Буферные растворы из нижнего и верхнего электродных сосудов можно употреблять при последующем электрофорезе, но их нельзя смешивать друг с другом.
Гели извлекают из трубок шприцем и фиксируют, погружая на 30 мин в пробирки с 7%-й трихлоруксусной кислотой, отмывают трижды по 10 мин в воде, а затем помещают в 1%-й раствор красителя амидо-шварц 10-В в 7%-й уксусной кислоте.
Через 30 мин красящий раствор сливают и гели отмывают от избытка красителя 7%-й уксусной кислотой, в которой они могут храниться длительное время.
Фотографирование. Отмытые электрофореграммы фотографируют в проходящем свете под слоем растворителя.
Идентификация белков на электрофореграммах. Белковые зоны на электрофореграммах характеризуют на основании их относительной электрофоретической подвижности (ОЭП).
Положение каждой зоны сравнивают с положением зоны краски-индикатора. Отсчет производят при помощи прозрачной линейки с точностью до 0,5 мм, начиная от старта (верхнего края мелкопористого геля) и до середины соответствующей зоны. ОЭП расчитывают по формуле
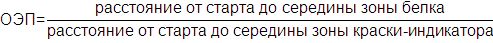
Полученные данные выражают десятичной дробью. При достаточном навыке и правильном измерении подвижности зон воспроизводимость величины ОЭП хорошая, ошибка составляет менее 1,5-2%.
Идентичными могут быть признаны зоны, ОЭП которых отличается менее чем на 2%. Продвижение краски-индикатора на сравниваемых электрофореграммах должно быть одинаковым, отличаясь не более чем на 2 мм.
Отдельные полосы электрофореграммы обычно называют следующим образом: главными наиболее интенсивно окрашенные, средними – с более слабой окраской иминорными – наименее окрашенные.
Полуколичественные определения содержания белков можно проводить путем денситометрических измерений интенсивности окраски отдельных белковых зон.
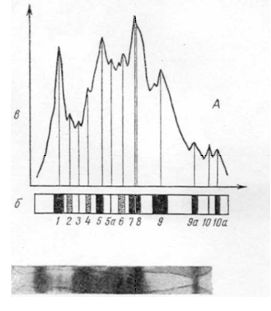
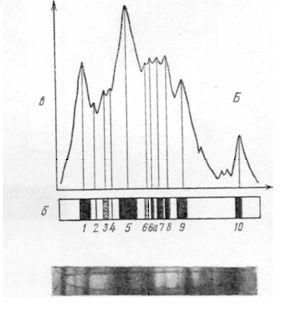
На рис.8.2 представлены фотографии, схемы и денситограммы альбуминов, выделенных из зерна ячменя сорта Московский 121 и высоколизинового ячменя Хайпроли.
|
|
|
Рис. 8.2. Фотография (внизу), рисунки (б) и денситограммы (в) электрофореграмм альбуминов зерна ячменя сорта Московский 121 (А) и высоколизинового голозерного ячменя Хайпроли (Б):
1-10а - зоны отдельных белковых компонентов
Электрофорез проламинов. Для изучения биохимических и генетических особенностей злаковых культур широкое распространение получил метод электрофоретического разделения проламинов, который показывает, что эта фракция белков имеет сложный компонентный состав. Так, например, при сравнительном изучении запасных белков пшеницы установлено, что каждый вид и сорт имеют характерный электрофоретический спектр глиадинов.
Проламины извлекают из семян 70%-м этиловым спиртом после удаления водо- и солерастворимых белков. Для анализа используют свежеразмолотую навеску муки. Полученный спиртовой экстракт ставят на диализ против 0,1М раствора уксусной кислоты. Диализ проводят при температуре 2-4°С в течение 32-36 ч. После диализа в белковый раствор добавляют акриламид и мочевину до конечной концентрации соответственно 6 и 12%. Подготовленные таким образом растворы белков сразу же используют для электрофоретического разделения.
Для электрофореза проламинов применяют 7,5 %-й кислый гель.
Состав запасных растворов для синтеза геля.
Раствор А акриламид 10 г, N, N'-метилен-бисакриламид 0,27 г, мочевина 30 г, ледяная уксусная кислота 46,7 мл, вода до 100 мл.
Раствор Б аммоний надсернокислый 1,5, мочевина 30 г, вода до 100 мл.
Раствор В тетраметилэтилендиамин.
Запасные растворы смешивают в следующем соотношении: 3 части раствора А, 1 часть раствора Б и 0,02 части раствора В. Полученную смесь осторожно перемешивают и быстро заливают в подготовленные электрофоретические трубки по 1,2 мл. Сверху капилляром наслаивают по 5-10 мл воды. Гели синтезируют при температуре 50-60°С в течение часа. Затем трубки с гелями вставляют в верхний электродный сосуд. В нижний сосуд наливают электродный буферный раствор, так, чтобы в него погрузились только нижние концы электрофоретических трубок (на 1 см). В качестве электродного буфера используют 0,013 М раствор уксусной кислоты. Затем трубки и верхний сосуд также заполняют раствором уксусной кислоты и проводят предварительный электрофорез гелей для удаления персульфата аммония, который мешает разделению проламинов.
Нижний электрод электрофоретической камеры подключают к отрицательному полюсу выпрямителя.
Предварительный электрофорез проводят при силе тока 3 мА на трубку в течение 2 ч до установления постоянного напряжения. Во время электрофореза необходимо охлаждение, чтобы температура буферного раствора в нижнем сосуде была не выше 4-5°С.
После предварительного электрофореза буферный раствор в электродных сосудах меняют. В трубки вносят по 0,1-0,2 мл раствора, содержащего 0,2-0,25 мг белка. В течение первого часа электрофореза пропускают ток силой по 2 мА на трубку.
Последующее разделение проводят при силе тока 4 мА на трубку и напряжении 300-400 В. Разделение глиадинов пшеницы длится 5-6 ч.
По окончании электрофореза гели из трубок быстро извлекают с помощью шприца и фиксируют в 7%-й трихлоруксусной кислоте.
|
|
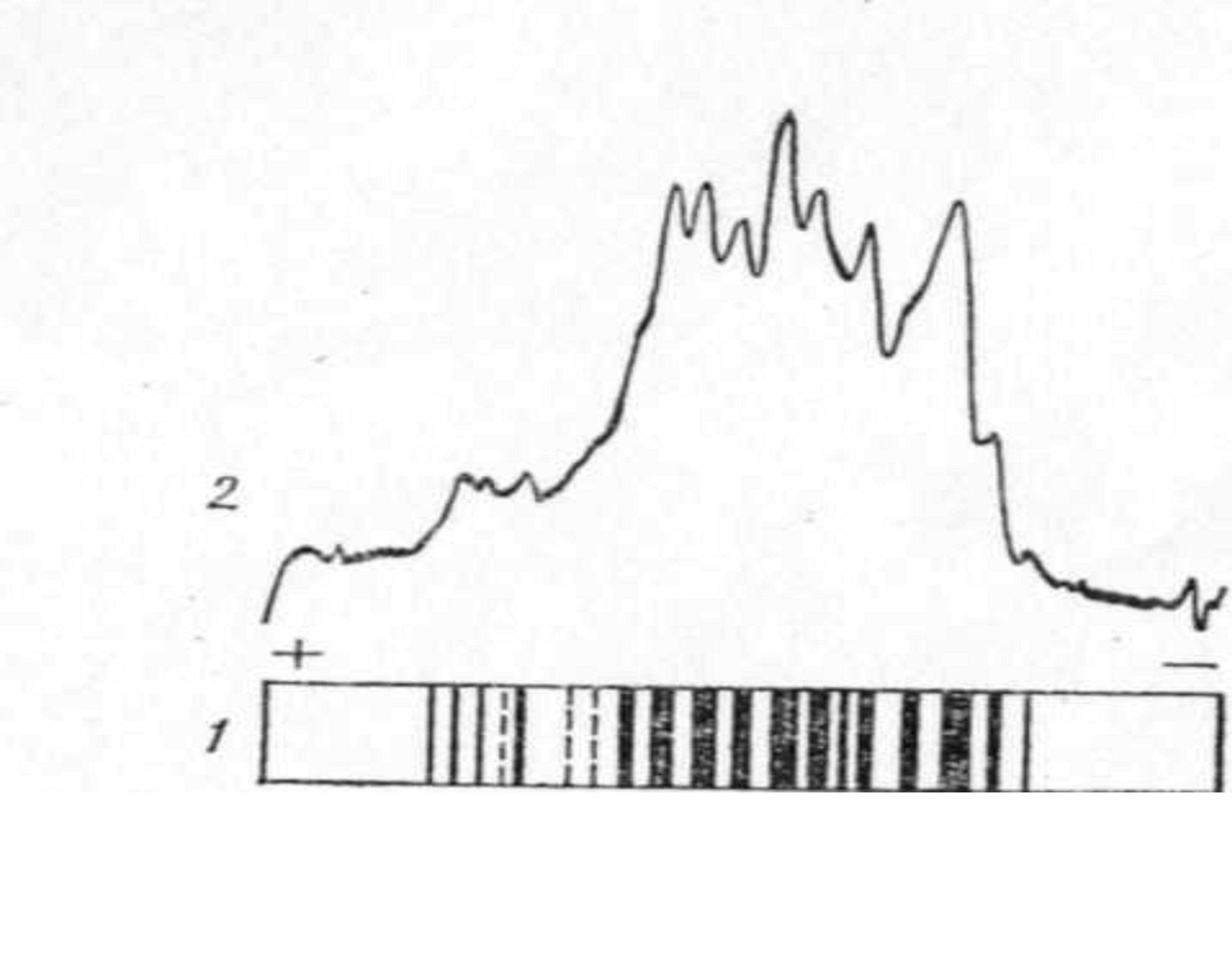
Рис. 8.3. Электрофореграмма (1) и денсинтограмма (2) гладианов пшеницы сорта Московская 2453
Белковые зоны проявляются в виде белых опалесцирующих дисков. Окрашивание проводят 1%-м раствором амидо-шварц 10-В в 7%-й уксусной кислоте. После отмывки избытка красителя столбики гелей фотографируют в проходящем свете или денситометрируют. Схема электрофоретического разделения глиадинов представлена на рис. 8.3.
Оборудование и реактивы:
1) электрофоретическая камера, электрофоретические трубки, подставки для электрофоретических трубок, выпрямитель тока, холодильник, термостат, лейкопластырь, целлофан, мерные колбы емкостью 100 мл, набор градуированных пипеток, капилляр, шприц, отрезки резиновой трубки, пробирки;
2) набор запасных растворов для электрофореза, электродный буферный раствор, сахароза, мочевина, акриламид, индикаторы (бромфеноловый синий и метиловый зеленый), амидо-шварц 10-В, трихлоруксусная кислота 7%-я, уксусная кислота 7%-я, уксусная кислота 0,013 М.