Работа 6.8
Подготовка веществ к анализу - озоление растительного вещества.
Определение азота и зольных элементов
При определении азота и зольных элементов в растениях используют как свежий, так и сухой материал. Озоление осуществляют двумя способами:
- сухим способом при высокой температуре, при этом азот не определяют;
- мокрым способом, в основном концентрированными кислотами:
H2SO4 + катализаторы; H2SO4 + HNO3; HNO3 + HNO2; H2SO4 + KC1O3; K2SO4 + HC1O4; H2SO4 + KMnO4; H2SO4 + H2O2 и др.
Сухим озолением в золе определяют фосфор, калий, кальций, магний, железо, алюминий, кремний, марганец и некоторые тяжелые металлы.
При определении в золе фосфора, калия и натрия озоление проводят с большой осторожностью, не допуская высокой температуры в муфельной печи. При температуре свыше 500°С фосфорная кислота с углем может восстанавливаться до свободного фосфора, а калий и натрий в форме хлоридов - улетучиваться.
Преимущество сухого озоления состоит в том, что не требуется использование концентрированных кислот и солей.
Навеску измельченного на мельнице материала (в среднем 3-5 г) неплотно укладывают в просушенный и взвешенный тигель и накрывают крышкой. На первой стадии сжигание в вытяжном шкафу проводят при температуре примерно 180°С, а после прекращения выделения продуктов перегонки, по истечении 30 мин, приоткрыв крышку, тигель ставят в муфельную печь до полного озоления. Оптимальной температурой считается 400-500°С. Иногда при длительном прокаливании зола сохраняет темный цвет. Это происходит потому, что соли золы обволакивают частицы угля и задерживают сжигание. В таком случае после охлаждения тигля к золе приливают 10-15 капель воды или 5-6 капель 30%-го пероксида водорода. При слабом подогревании выпаривают жидкость и продолжают сжигание до получения светлой золы. После озоления тигель прикрывают крышкой, охлаждают в эксикаторе и взвешивают. Содержание золы в процентах рассчитывают по формуле:
![]()
где а - масса золы, г;
100 - коэффициент для выражения результатов в процентах;
б - навеска сухого вещества, г.
Для ускорения озоления и предотвращения потерь фосфора к анализируемой навеске рекомендуют прибавлять в небольших количествах ацетат кальция, оксид кальция, оксид магния, ацетат магния и др. В результате сухого озоления получают так называемую «сырую» золу, потому что в ней остается небольшое количество углистых частиц. При сухом озолении органического вещества кальций, магний, калий, натрий образуют карбонаты, а фосфор - однозамещенный фосфат кальция.
Для ускорения озоления Н. Проскуряков, С. Темерин в 30-е годы XX в. предложили к навеске 1-1,5 г приливать 1,5 мл спиртоглицериновой смеси. Озоление заканчивается примерно через 2 ч после помещения тигля в муфель. Ускорить озоление можно добавлением по 5-6 капель пероксида водорода, однако при этом возможны незначительные потери фосфора и калия. Полученную сырую золу растворяют в 20 мл 10%-й соляной кислоты, раствор фильтруют, выпаривают досуха и осадок снова растворяют в соляной кислоте и фильтруют. Так повторяют четыре раза. Выделившуюся кремнекислоту отфильтровывают, фильтр промывают горячей водой, подкисленной несколькими каплями крепкой соляной кислоты, фильтрат доводят в мерной колбе на 200-250 мл дистиллированной водой до метки и перемешивают. Из мерной колбы берут определенные объемы раствора для определения вышеуказанных элементов.
Озоление растений мокрым способом. Мокрое озоление более универсально, так как улетучивание фосфорной кислоты и других элементов почти исключено.
Наиболее старыми являются методы Меркера и Неймана. Сначала Меркер предложил вести озоление концентрированной H2SO4 с добавлением по каплям HNO3, Нейман - смесью H2SО4 и HNO3, взятых в равных объемах. Однако и в том и другом случае происходили потери фосфора.
В начале XX в. в Петербургской сельскохозяйственной химической лаборатории и лаборатории Всероссийского общества сахарозаводчиков также использовали H2SO4 и HNO3 в разных соотношениях.
А.Н. Лебедянцев сравнил все методы, выявил условия потери фосфора в процессе озоления и предложил свой метод. В полученной золе можно определить Р, К, Са, Mg, Na, Fe, Mn, Al. A.H. Лебедянцев предложил навеску обрабатывать 68%-й азотной кислотой с удельной массой 1,41. На 2-3 г вещества ее берут 10-15 мл, после выпаривания добавляют еще 2-4 мл. После осветления прибавляют на 1 г вещества 1 мл концентрированной серной кислоты с удельной массой 1,84. По мере испарения азотную кислоту добавляют по 1-1,5 мл. Азотная и серная кислоты являются сильными окислителями. При высокой температуре они распадаются:
2HNO3 → Н2О + 2NO2; 2H2SO4 → 2Н2О + 2SO2 + О2
Выделившийся кислород окисляет углерод до СО2, водород - до Н2О, а сульфгидрильную группу (SH) - до сульфата (SO4).
После окончания озоления колбу охлаждают и приливают до половины дистиллированной воды. Иногда раствор приобретает зеленоватую окраску, это значит, что сжигание не закончено или в растворе имеются оксиды азота. После 20-30 - минутного кипячения содержимое в колбе должно быть бесцветным. Если раствор остается желтым или зеленым, его выпаривают, добавляют 3-5 капель азотной кислоты и продолжают озоление.
После полного озоления и охлаждения приливают воду и фильтруют в мерную колбу на 250-500 мл, добавляют до метки воды, перемешивают. Такого объема достаточно, чтобы определить все зольные элементы.
Мокрое озоление по Лебедянцеву позволяет определить только зольные элементы. Одним из основных его недостатков является длительность озоления. На сжигание навески тратится не менее 8-10 ч при температуре 330°С, а при более низкой температуре - до суток.
Отечественные ученые еще в 30-е годы XX в. предпринимали попытки разработать методики озоления, позволяющие определять одновременно азот и зольные элементы. Впервые В. Пиневич в этих целях предложил использовать концентрированную H2SO4 и 30%-й Н2О2. По его методике навеску растительного материала 0,5-1,0 г в колбе Кьельдаля заливают 5-10 мл H2SО4 и 1-2 мл Н2О2. Озоление проводят на электрических плитках в течение 2 ч. Оно считается законченным, если жидкость в колбе не темнеет и при добавлении 1-2 капель Н2О2 при подогреве интенсивно выделяются белые пары. Метод Пиневича совершенствовали А.М. Мещеряков, Н.М. Майборода, В.Т. Куркаев и др.
Предложенные модификации отличаются друг от друга незначительно, в основном последовательностью приливания Н2О2 и посудой для озоления. А.М. Мещеряков предлагал навеску 0,1 г в пробирке заливать 2 мл H2SO4 и после подогревания добавлять по 5-6 капель Н2О2. Н.М. Майборода предлагает одновременно навеску обрабатывать 2 мл H2SO4 и 2 мл Н2О2. Модификации относятся к микрометодам, так как берется небольшая аналитическая навеска и малообъемная посуда.
Наиболее точные результаты при ускоренном озолении получают при озолении растительного материала по К.Е. Гинзбургу.
Гинзбург предложил для сжигания использовать концентрированную серную кислоту удельной массой 1,84 и 60%-ю хлорную кислоту (5 мл H2SO4 + 0,4 мл НСlО4) для сжигания одной навески (0,1-0,2 г). После прибавления смеси кислот колбы оставляют на 30-60 мин, затем проводят слабое нагревание в течение 5-7 мин до образования однородной коричнево-бурой массы. После этого температуру повышают и озоление продолжают до полного обесцвечивания, которое наступает примерно через 15-25 мин. Если озоление не произошло, то необходимо добавить еще 1-2 капли НСlО4 и продолжить его.
При определении общего и белкового азота широко используют сжигание по Кьельдалю. Метод стандартизирован (ГОСТ 10846-64) и является наиболее надежным, так как потери азота при сжигании исключены. Этот метод был предложен в 1883 г. и считается классическим.
По Кьельдалю навеску 0,5-2,0 г переносят в кьельдалевские колбы для озоления разного объема - от 50 до 750 мл и заливают в зависимости от массы навески 10-25 мл крепкой H2SO4 c удельной массой 1,84. Колбу нагревают до обугливания навески. Так как озоление навески происходит медленно, для ускорения процесса применяют катализаторы: Гунина - металлическую ртуть или медь и K2SO4 для повышения температуры кипения; Шедда - Nа2SO4; Клеемана - Н2О2; Шерера - селен в порошке и т.д. Основа осталась, она заключается в переводе всего азота навески в аммиак. При использовании катализатора и температуры 300 °С сжигание заканчивается за 5-8 ч.
Химические реакции при сжигании сложны. Их можно представить лишь схематически. Серная кислота при нагревании в присутствии органических веществ распадается на оксид серы, воду и кислород:
2H2SО4 → 2SO2 + 2Н2О + О2
Кислород, обладающий высокой окислительной способностью, окисляет углерод и водород органических веществ:
С + О2 = СО2; 2Н2 + О2 = 2Н2О
Под влиянием серной кислоты белок распадается на аминокислоты, взаимодействие их можно представить следующим образом:
NH2 • СН2 - СООН + 3H2SO4 = NH3 + 2СО2 + 3SO2 + 4Н2О
Получившиеся при этом диоксид углерода, оксид серы и вода улетучиваются, а аммиак связывается серной кислотой, которую для озоления берут в небольшом избытке:
2NH3 + H2SO4 = (NH4)2SO4
Безазотистые органические вещества также разрушаются с образованием диоксида углерода и воды, например:
С6Н12О6 + 12H2SO4 = 6СО2 + 18Н2О + 12SO2
Освобождающаяся сера при распаде белка окисляется:
S + 2H2SO4 = 3SO2 + 2Н2О.
Как отмечалось, для повышения температуры кипения серной кислоты и ускорения сжигания (окисления) применяют катализаторы. Катализаторы легко окисляются серной кислотой с выделением активного кислорода, который ускоряет процесс окисления. Химизм показан на примере селена:
2H2SO4 + Se = 2SO2 + H2SeO3 + H2O.
Образовавшаяся селенистая кислота распадается на диоксид селена и воду:
H2SeO3 → SeO2 + Н2О.
Диоксид селена отдает кислород на окисление восстановленных веществ в растении, а освободившийся металлический селен снова взаимодействует с серной кислотой, и процесс повторяется:
SeO2 → Se + О2.
На 1 мл серной кислоты достаточно 0,005 г селена, чтобы ускорить сжигание.
Затем содержимое колбы [(NH4)2SO4] переносят в отгоночную (перегонную) колбу, приливают 30-40%-й раствор щелочи (NaOH или КОН) и проводят отгонку в титрированный раствор серной или борной кислот:
(NH4)2SO4 + NaOH = Na2SO4 + 2NH4OH;
2NH4OH → 2NH3 + 2H2O (в отгоночной колбе);
2NH3 + H2SO4 = (NH4)2SO4 (в приемной колбе).
Если в качестве катализатора используют ртуть, то в процессе озоления образуются ртутно-амидные соединения, которые разрушаются водородом; последний образуется в присутствии цинка. Поэтому при приливании щелочи одновременно в отгоночную колбу кладут кусочек цинка. Между цинком и ртутно-амидными соединениями протекает реакция:
Zn + 2NaOH = Zn(ONa)2 + Н2;
(NH2Hg)2SO4 + Н2 = (NH4)2SO4 + 2Hg.
Окончание отгонки устанавливают реактивом Несслера. Для этого из-под носика холодильной трубки набирают около 2 мл раствора и приливают 1 каплю реактива, который дает с аммиаком желтоокрашенное соединение (йодистый меркураммоний). Если такой окраски нет, отгонку следует считать законченной.
Количество оставшейся кислоты (не связанной аммиаком) титруют щелочью такой же концентрации в присутствии индикатора метилоранжа до слабо-розовой окраски.
Азот рассчитывают по формуле:
![]()
где а - мл 0,1 н. H2SО4 в приемной колбе;
К1 - поправка к титру кислоты;
б - мл 0,1 н. NaOH или КОН, пошедшей на титрование кислоты в приемной колбе;
K2 - поправка к титру щелочи;
0,0014 г азота соответствует 1 мл 0,1 н. H2SО4, при использовании 0,2 н. H2SO4 - 0,028 г и т. д.;
100 - коэффициент для выражения результатов в процентах;
н - навеска, г.
Чтобы получить содержание сырого протеина, процент азота умножают на коэффициент 6,25.
Если растительный материал содержит значительное количество нитратов, озоление проводят не серной кислотой, а фенолсерной, так как она при озолении восстанавливает нитраты и нитриты до аммиака. Фенолсерная кислота представляет смесь 40 г фенола (СбН5ОН) в 1 л концентрированной серной кислоты удельной массой 1,84. Метод носит название Кьельдаля-Иодльбауэра. Реакции при сжигании остаются такими же, как и в методике Кьельдаля, восстановление нитратов происходит следующим образом:
C6H4(HSO3)OH + HNO3 = C6H4(NO2)OH + H2SO4,
Фенолсерная кислота Нитрофенол
т. е. нитратный азот переходит в органическую форму.
Нитрофенольный азот восстанавливается до аммиака водородом, который образуется во время озоления при прибавлении цинка:
Zn + H2SO4 = ZnSO4 + Н2;
C6H4(NО2)OH + ЗН2 = C6H4(NH2)OH + 2Н2О.
Нитрофенол Аминофенол
При дальнейшем сжигании аминофенол разрушается серной кислотой с образованием аммиака и связывается до сульфата аммония. Аммиак органических соединений и образовавшийся после восстановления нитратов связывается в сульфат аммония, аммиак которого отгоняется в аппарате Кьельдаля. При ускоренном озолении небольших навесок конечным азотным соединением является также сульфат аммония.
Общее содержание азота определяют колориметрически, в качестве красителя используется реактив Несслера. Для окрашивания из мерной колбы берут от 2 до 10 мл раствора, столько же 2,5%-й щелочи для нейтрализации кислой среды и 2 мл реактива Несслера. Образуется иодид оксидимеркурат аммония желтого цвета, интенсивность окраски зависит от количества аммиака в растворе.
(HgI • 2KI)2 + ЗКОН + NH3 = Hg2NH2IO + 7KI + 2Н2О.
Реактив Несслера Иодид оксиди-меркурат аммония
Аммонийный азот может быть определен колориметрически в виде окрашенного индофенольного соединения, образующегося при взаимодействии аммиака с салицилово-кислым натрием (C7H6O3Na2 2Н2О) и гипохлоритом натрия (NaClO).
Гипохлорит натрия представляет смесь двух солей: СаСl2 + Na2CO3. Образующаяся бирюзовая окраска индофенольной зелени сохраняется в течение 2,5 ч. Формула индофенольной зелени:
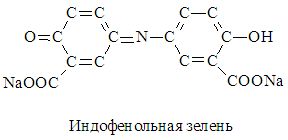
При определении белкового азота в растительном веществе белок вначале осаждают гидратом оксида меди и отмывают от небелковых азотистых соединений. Гидрат оксида меди образуется в самом растворе при прибавлении CuSO4 и NaOH. Щелочь приливают в таком количестве, чтобы реакция была нейтральной. Образуется основная серномедная соль CuSO4 Cu(OH)2. Навеску (1-2 г сухого материала или 5-7 г сырого) заливают 50 мл теплой дистиллированной воды и при помешивании прибавляют 25 мл раствора медного купороса, а затем 25 мл раствора едкого натра. Осадок белка выпадает быстро. Отфильтровав его и освободившись от небелкового азота путем отмывки водой, осадок белка с фильтром подсушивают при температуре не выше 50°С и вместе с фильтром сжигают по Кьельдалю.
Отогнав азот в аппарате Кьельдаля таким же способом, как и при определении общего азота, умножив содержание азота в процентах на коэффициент 5,7, получают содержание белка в процентах.
Контрольные вопросы
1. Назовите отличие сухого озоления от мокрого.
2. Можно ли определить азот после сухого озоления?
3. Какие кислоты в основном применяют при озолении мокрым способом?
4. Какие катализаторы в основном применяют при озолении мокрым способом?
5. Как рассчитать содержание золы в процентах после сухого озоления?