Органическая химия

Тема 2.1. АЛКАНЫ (предельные, насыщенные углеводороды)
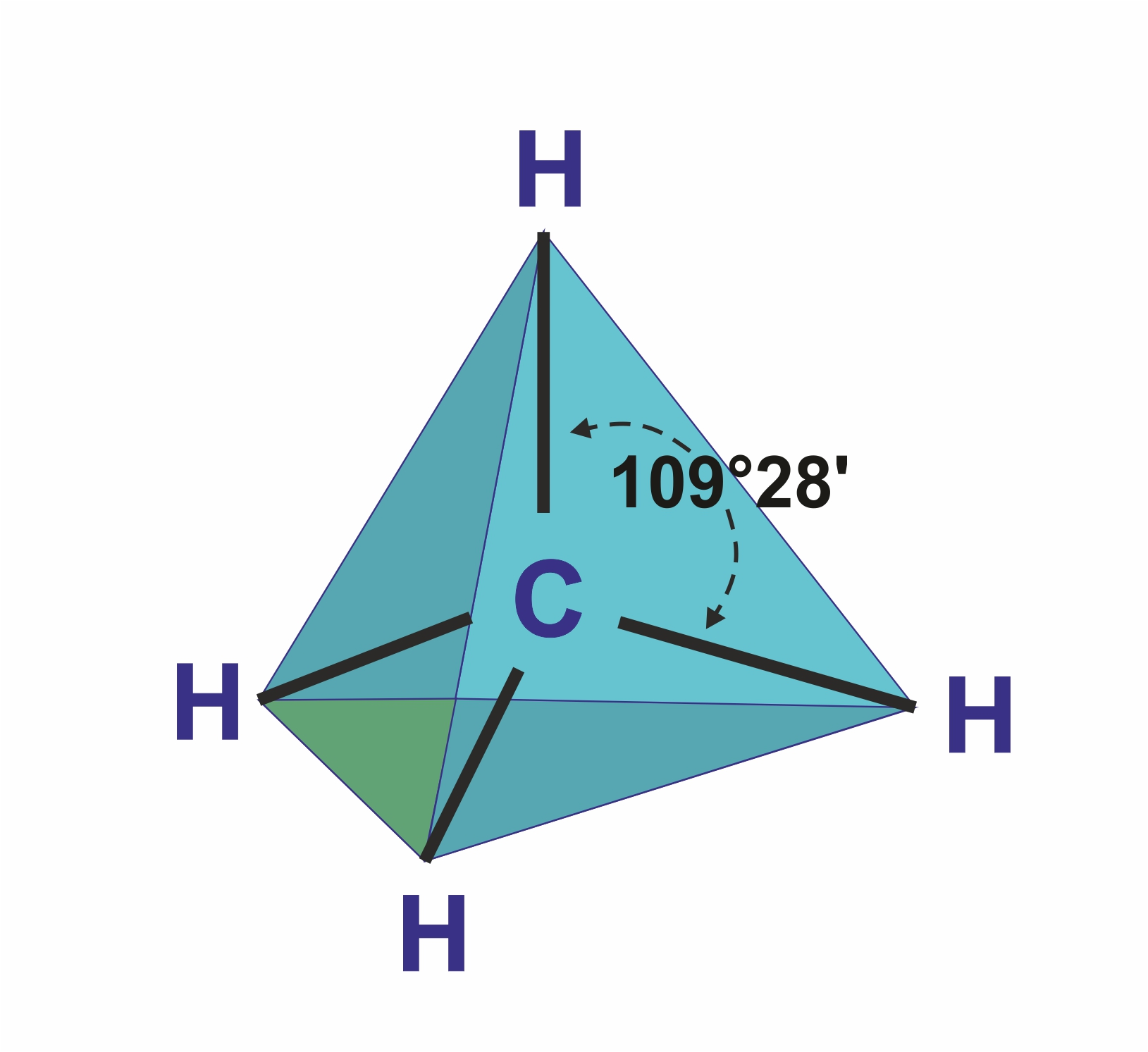
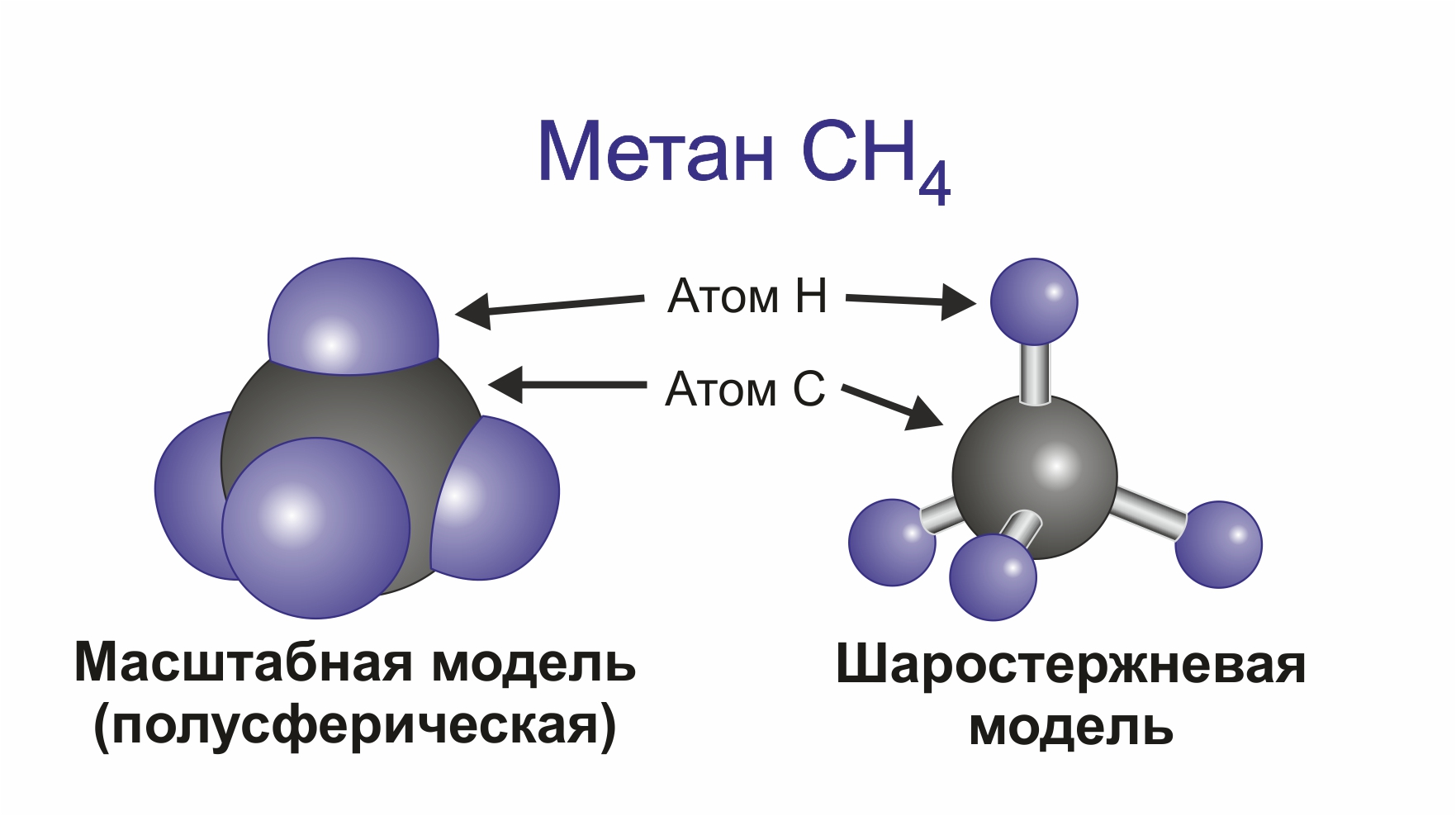
![]() Простейшим представителем алканов служит метан СН4. Атом углерода находится в состоянии sp3 — гибридизации, образуя 4 одинаковые σ-связи с атомами углерода.
Простейшим представителем алканов служит метан СН4. Атом углерода находится в состоянии sp3 — гибридизации, образуя 4 одинаковые σ-связи с атомами углерода.
|
|
Начиная с метана, можно построить гомологический ряд, в котором каждый последующий углеводород отличается от предыдущего на одну группу —СH2—, которая называется гомологическая разность.
Общая формула гомологического ряда алканов СnН2n+2
Если от алкана отщепляется водород, образуется реакционноспособная частица, имеющая неспаренный электрон, которая называется радикал.
Некоторые члены гомологического ряда алканов
Формула алкана |
Название алкана |
Название радикала |
Т пл. о С |
Т кип. о С |
CH4 |
метан |
метил |
-184 |
-162 |
C2H6 |
этан |
этил |
-172 |
-88 |
C3H8 |
пропан |
пропил |
-190 |
-42 |
C4H10 |
бутан |
бутил |
-135 |
-0,5 |
C4H10 |
изобутан |
изобутил |
-140 |
-10 |
C5H12 |
пентан |
пентил |
-132 |
36 |
C5H12 |
изопентан |
изопентил |
-161 |
28 |
C5H12 |
неопентан |
неопентил |
-20 |
10 |
C6H14 |
гексан |
гексил |
-94 |
69 |
C7H16 |
гептан |
гептил |
-90 |
98 |
C10H22 |
декан |
децил |
-30 |
174 |
C15H32 |
пентадекан |
10 |
271 |
|
C20H42 |
эйкозан |
37 |
348 |
Физические свойства
В обычных условиях первые четыре члена гомологического ряда алканов (С1-С4) — газы. Нормальные алканы от пентана до гептадекана (С5-С17) — жидкости, начиная с С18 и выше — твердые вещества. Из таблицы видно, что по мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные. Алканы практически не растворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан и др.
Получение алканов
Промышленные способы:
• |
фракционная перегонка нефти. Основным источником алканов служат нефть и природный газ; |
• |
гидрогенизация угля (сланцев, торфа, каменноугольных смол); |
• |
каталитическое гидрирование оксида углерода (II). |
Лабораторные способы:
• |
гидрирование ненасыщенных углеводородов (при обычных температуре и давлении в присутствии катализаторов – никеля, палладия, платины):
|
• |
восстановление галогенопроизводных алканов (в присутствии катализаторов):
|
• |
|
Химические свойства алканов
При обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями — перманганатом калия КМnО4 и т. п.
Химическая устойчивость алканов объясняется высокой прочностью σ-связей С—С и С—Н, а также их неполярностью. Неполярные связи С—С и С—Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов.
Aлканы вступают в реакции, протекающие по механизму радикального замещения, обозначаемого символом SR (от англ. substitution radicalic).
![]() Легче всего замещаются атомы водорода, находящиеся у третичных, затем у вторичных и первичных атомов углерода.
Легче всего замещаются атомы водорода, находящиеся у третичных, затем у вторичных и первичных атомов углерода.
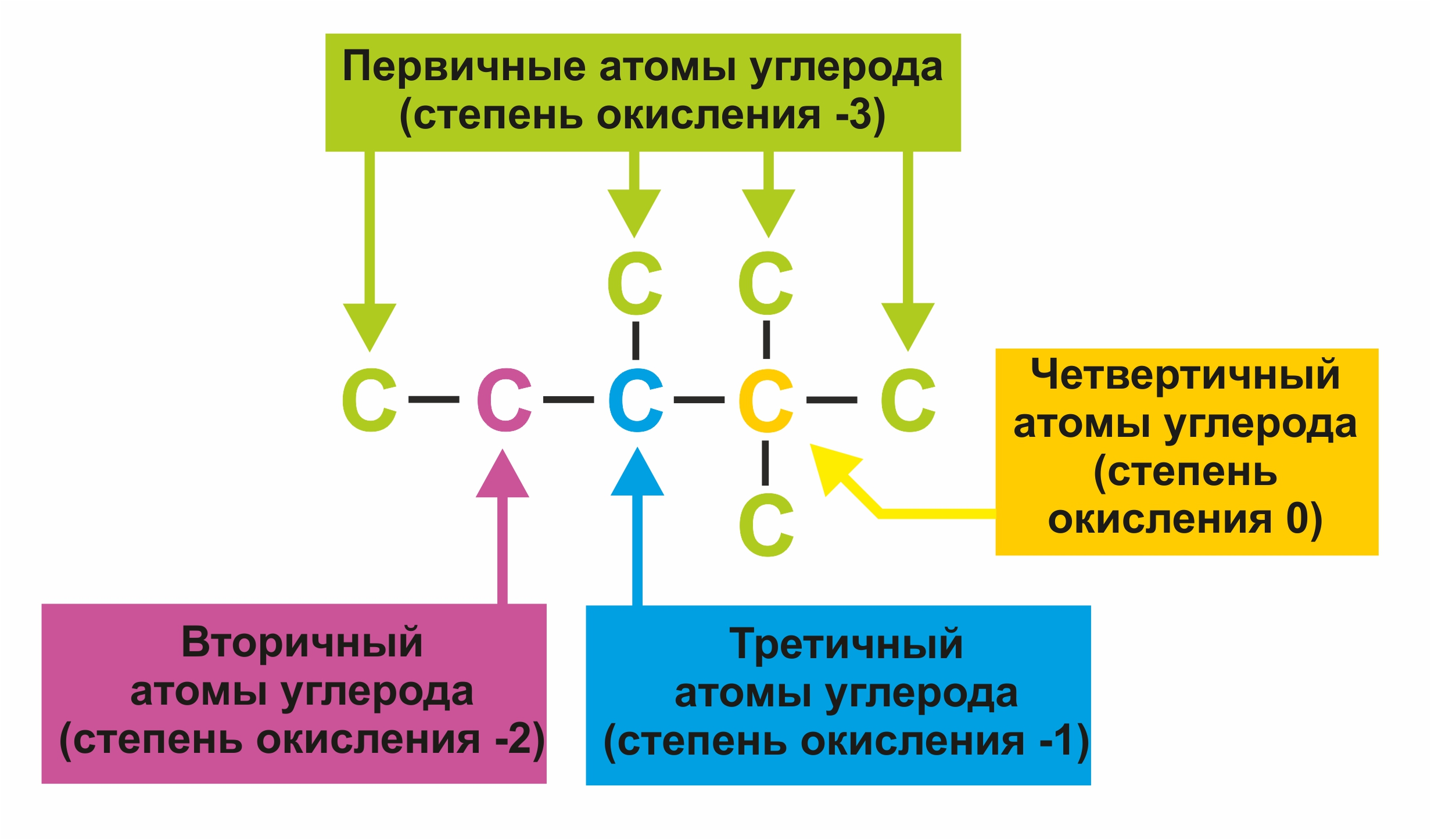
Примеры реакций замещения:
![]() 1. Галогенирование.
1. Галогенирование.
При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогенозамещенных алканов. Общая схема этой реакции показана на примере метана:

Галогенирование алканов
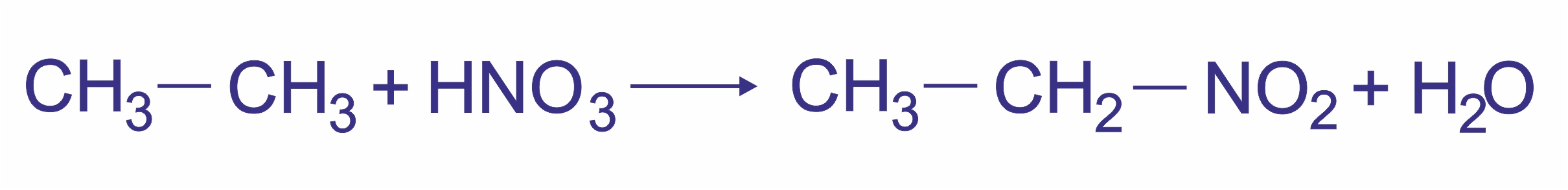
![]() 2. Нитрование (реакция Коновалова).
2. Нитрование (реакция Коновалова).
При действии разбавленной азотной кислоты в присутствии серной кислоты на алканы при 140ºС и небольшом давлении протекает радикальная реакция:
3. Изомеризация.
Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:

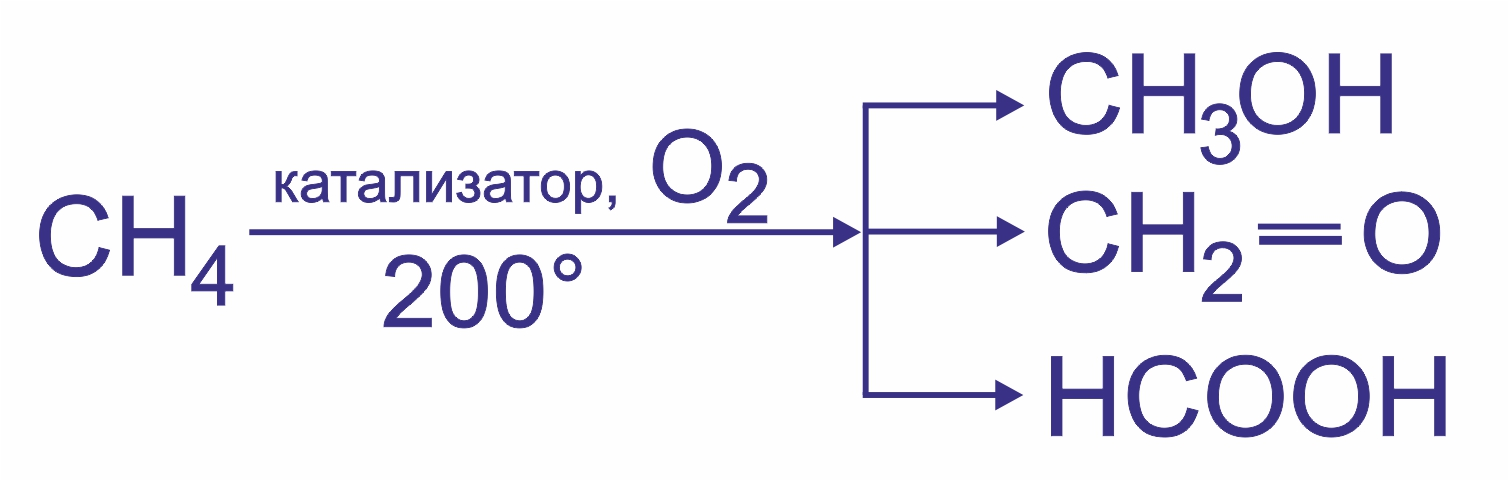
4. Окисление.
При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены: метиловый спирт, формальдегид, муравьиная кислота:
Применение алканов
Благодаря большой теплотворной способности метан в больших количествах расходуется в качестве топлива (в быту — бытовой газ и в промышленности). Широко применяются получаемые из него вещества: водород, ацетилен, сажа. Он служит исходным сырьем для получения формальдегида, метилового спирта, а также различных синтетических продуктов.
Большое промышленное значение имеет окисление высших предельных углеводородов — парафинов с числом углеродных атомов 20-25. Этим путем получают синтетические жирные кислоты с различной длиной цепи, которые используются для производства мыл, различных моющих средств, смазочных материалов, лаков и эмалей.
Жидкие углеводороды используются как горючее (они входят в состав бензина и керосина).
Горение жидких алканов
Алканы также широко используются в органическом синтезе.