Органическая химия

Раздел 1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
Причины выделения органической химии в отдельную науку:
1. Многочисленность органических соединений (неорганических веществ насчитывается около 100 тыс., а органических — 18 млн). 2. Органические соединения играют важную роль в биологических процессах жизнедеятельности организмов. 3. Имеются особенности в свойствах органических соединений по сравнению с неорганическими: горючесть, неустойчивость к воздействию агрессивных сред (кислот, щелочей, окислителей). Причина этих отличий - в преобладании ковалентной связи и способности ковалентно связанного атома углерода образовывать цепи различной длины и циклы.
КЕКУЛЕ (Kekule) фон Штрадониц, Фридрих Август (7.09.1829–13.07.1896) |
В 1859 г. немецкий ученый Ф.А. Кекуле установил, что углерод в органических соединениях 4-валентен.
Основные положения теории химического строения
Сформулировал В 1861 г. русский химик А.М. Бутлеров
1. |
Атомы в молекуле соединены не беспорядочно, а последовательно, согласно их валентности; |
2. |
Свойства веществ зависят не только от того, атомы каких веществ и в каком количестве входят в состав соединения, но также и от их строения. |
Введено понятие изомерия.
Изомеры — вещества, имеющие одинаковый качественный и количественный состав, но разное структурное строение, а значит, и разные свойства. |
Например, этиловый спирт и диметиловый эфир:

• |
структурная изомерия (строение основной цепи), число изомеров резко возрастает с ростом цепи углеводорода: С4Н10 имеет 2 изомера, С13Н28 - 802 изомера; |
• |
изомерия положения двойных и тройных связей; |
• |
изомерия положения функциональных групп; |
• |
пространственная изомерия (оптическая и цис-, транс-изомерия). |
3. |
В реакциях принимает участие не вся молекула, а лишь отдельные ее части. Изучая продукты химических превращений, можно установить строение вещества. |
4. |
Входящие в состав молекулы атомы влияют друг на друга, наибольшее влияние наблюдается у непосредственно связанных атомов. |
Кроме изомерии в органической химии наблюдается явление, не свойственное неорганической химии — гомология.
Гомология – это существование рядов органических соединений, обладающих сходными химическими и постепенно изменяющимися физическими свойствами, а также однотипной структурой, соседние члены которых отличаются на группу -СН2- (гомологическую разность). |
Классификация органических соединений
1. |
Ациклические соединения (жирные, алифатические) с открытой цепью: |
|
а) |
предельные жирные соединения (метан и его гомологи); |
|
б) |
непредельные соединения: этилен, ацетилен, 1,3-бутадиен и их гомологи. |
|
2. |
Изоциклические или карбоциклические соединения с замкнутой цепью, состоящей только из атомов углерода: |
|
а) |
алициклические соединения насыщенные и ненасыщенные (например, циклогексан и циклопентен); |
|
б) |
ароматические соединения (бензол, нафталин). |
|
3. |
Гетероциклические соединения, в состав цикла которых кроме углерода входят и неуглеродные атомы (N, O, S и др.), например, пиперидин, пиридин, фуран, тиофен. |
|
Каждый из перечисленных классов соединений может образовывать производные при замещении водорода на не углеродные атомы или группы атомов: галоген-, гидрокси-, амино-, нитро-, сульфо-, карбонильную, карбоксильную и др. Такие заместители называют функциональными группами. Соединения, которые содержат несколько функциональных групп, называются полифункциональными.
Основные классы монофункциональных производных органических соединений
Функциональная группа |
Название |
Класс соединений |
Общая формула |
-Hal |
Галоген- |
Галогенопроизводные |
R-Hal |
-OH |
Гидрокси- |
R-OH |
|
-O-R |
Алкокси- |
R-O-R |
|
-SO2OH |
Сульфо- |
Сульфокислоты |
R-SO2OH |
-NO2 |
Нитро- |
Нитросоединения |
R-NO2 |
-NH2 , -NH- , -N- |
Амино- |
R-NH2 |
|
=C=O |
Карбонильная |
R-COH R2-C=O |
|
-COOH |
Карбоксильная |
Карбоновые кислоты |
R-COOH |
![]() Номенклатура органических соединений
Номенклатура органических соединений
Тривиальная — названия связаны с источником получения или другого происхождения (муравьиная, уксусная молочная кислоты, ацетон и др.)
Рациональная — соединение рассматривается как производное от простейшего представителя данного класса при замещении водорода у него на радикалы или на неуглеродные атомы или группы атомов.
Международная (систематическая) ИЮПАК — в основу названия соединения положена самая длинная углеродная цепь молекулы, содержащая максимальное число функциональных групп. Начало нумерации цепи определяет наиболее старшая функциональная группа.
Порядок старшинства основных функциональных групп:
![]()
Главная функциональная группа обозначается в названии суффиксом: гидроксильная –ол; альдегидная –аль; кетонная –он и т.д.
В дальнейшем при изучении различных классов соединений детально будут разбираться отдельные примеры названий по номенклатуре ИЮПАК.
Для построения названия в первую очередь определяют тип характеристической группы (если она присутствует). Характеристическая группа — это функциональная группа, связанная с родоначальной структурой.
Когда характеристических групп в соединении несколько, то выделяют старшую характеристическую группу.
Для характеристических групп условно установлен порядок старшинства. В таблице эти группы приведены в порядке убывания старшинства. Затем определяют родоначальную структуру, в которую обязательно должна входить старшая характеристическая группа.
Префиксы и суффиксы для обозначения некоторых характеристических групп:
Характеристическая группа |
Префикс |
Суффикс |
– СООН |
карбокси |
-овая кислота |
– SO3H |
сульфо- |
-сульфокислота |
– СH= O |
___ |
-аль |
|
оксо- |
-он |
– OH |
гидрокси- |
-ол |
– NH2 |
амино- |
-амин |
– NO2 |
нитро- |
___ |
– OR |
алкокси- |
___ |
– F, – Cl, – Br, – I ( – Hal) |
фтор-, хлор-, бром-, иод- (галоген-) |
___ |
Как видно из таблицы, некоторые характеристические группы, а именно галогены, нитро- и алкоксигруппы, отражаются в общем названии только в виде префиксов, например бромметан, этоксиэтан, нитробензол.
Нумерацию атомов углерода в главной цепи начинают с того конца цепи, ближе к которому расположена старшая группа. |
Если таких возможностей оказывается несколько, то нумерацию проводят таким образом, чтобы либо кратная связь, либо другой заместитель, имеющийся в молекуле, получили наименьший номер.
В карбоциклических соединениях нумерацию начинают от того атома углерода, при котором находится старшая характеристическая группа.
Если при этом невозможно выбрать однозначную нумерацию, то цикл нумеруют так, чтобы заместители имели наименьшие номера.
В группе циклических углеводородов особо выделяются ароматические углеводороды, для которых характерно наличие в молекуле бензольного кольца. Некоторые широко известные представители ароматических углеводородов и их производных имеют тривиальные названия, использование которых разрешено правилами ИЮПАК: бензол, толуол, фенол, бензойная кислота.
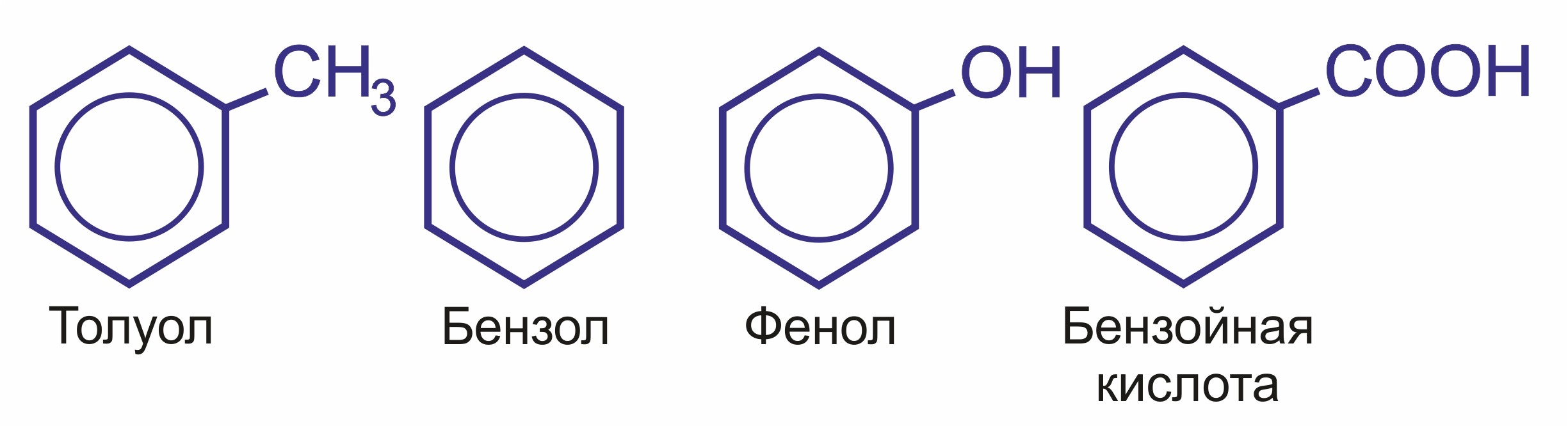
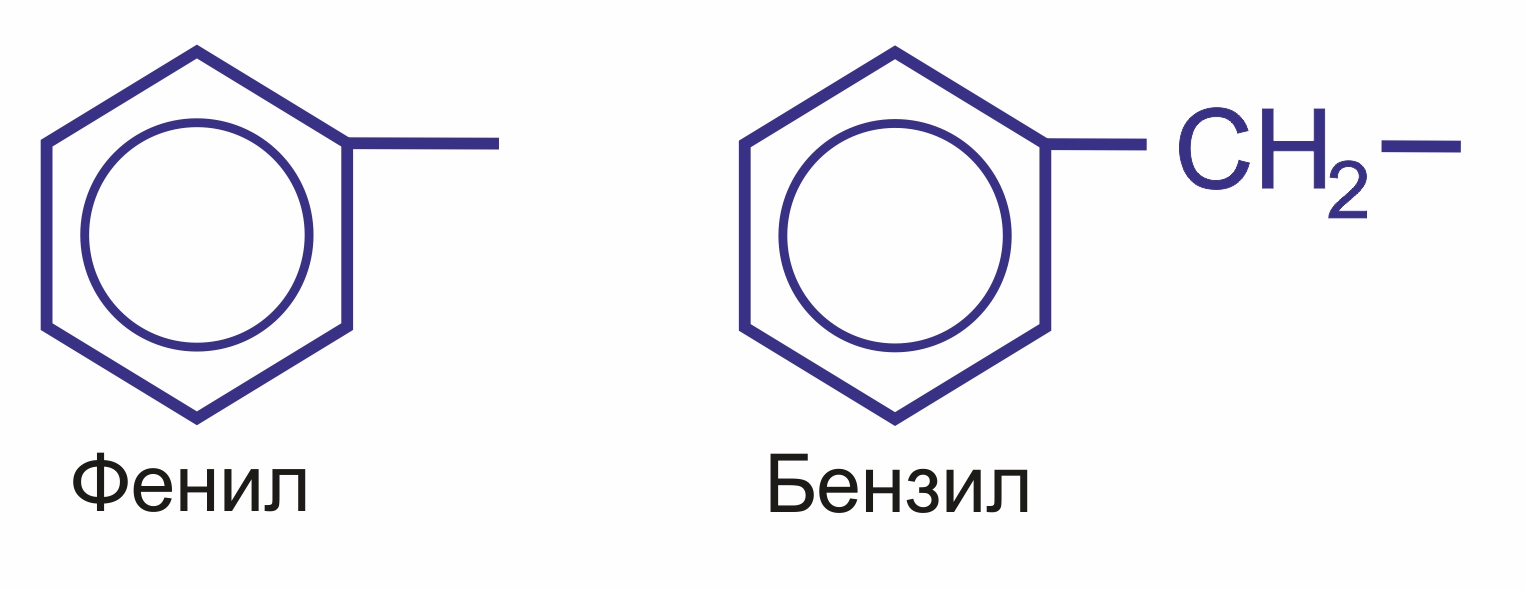
Радикал С6Н5-, образованный из бензола, называется фенил, а не бензил. Бензилом называют радикал С6Н5СН2-, образованный из толуола.
Составление названия органического соединения.
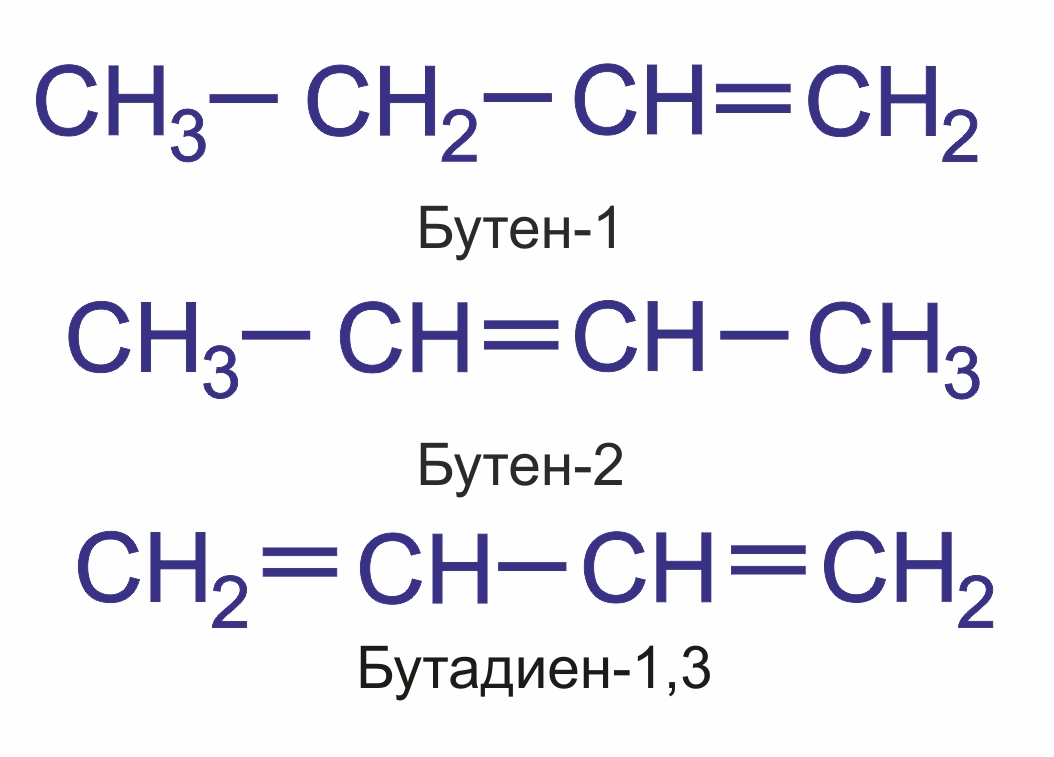
Основу названия соединения составляет корень слова, обозначающий предельный углеводород с тем же числом атомов, что и главная цепь (мет-, эт-, проп-, бут-, пен-, гекс- и т. д.). Затем следует суффикс, характеризующий степень насыщенности, -ан, если в молекуле нет кратных связей, -ен при наличии двойных связей и -ин для тройных связей, (например пентан, пентен, пентин). Если кратных связей в молекуле несколько, то в суффиксе указывается число таких связей: -диен, -триен, а после суффикса обязательно арабскими цифрами указывается положение кратной связи (например, бутен-1, бутен-2, бутадиен-1,3):
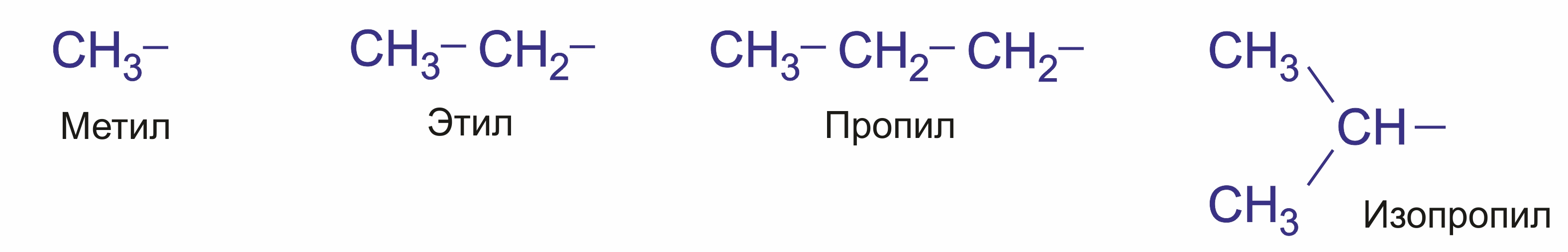
Далее в суффикс выносится название самой старшей характеристической группы в молекуле с указанием ее положения цифрой. Прочие заместители обозначаются с помощью приставок. При этом они перечисляются не в порядке старшинства, а по алфавиту. Положение заместителя указывается цифрой перед приставкой, например: 3-метил; 2-хлор и т. п. Если в молекуле имеется несколько одинаковых заместителей, то перед названием соответствующей группы словом указывается их количество (например, диметил-, трихлор- и т. д.). Все цифры в названиях молекул отделяются от слов дефисом, а друг от друга запятыми. Углеводородные радикалы имеют свои названия.
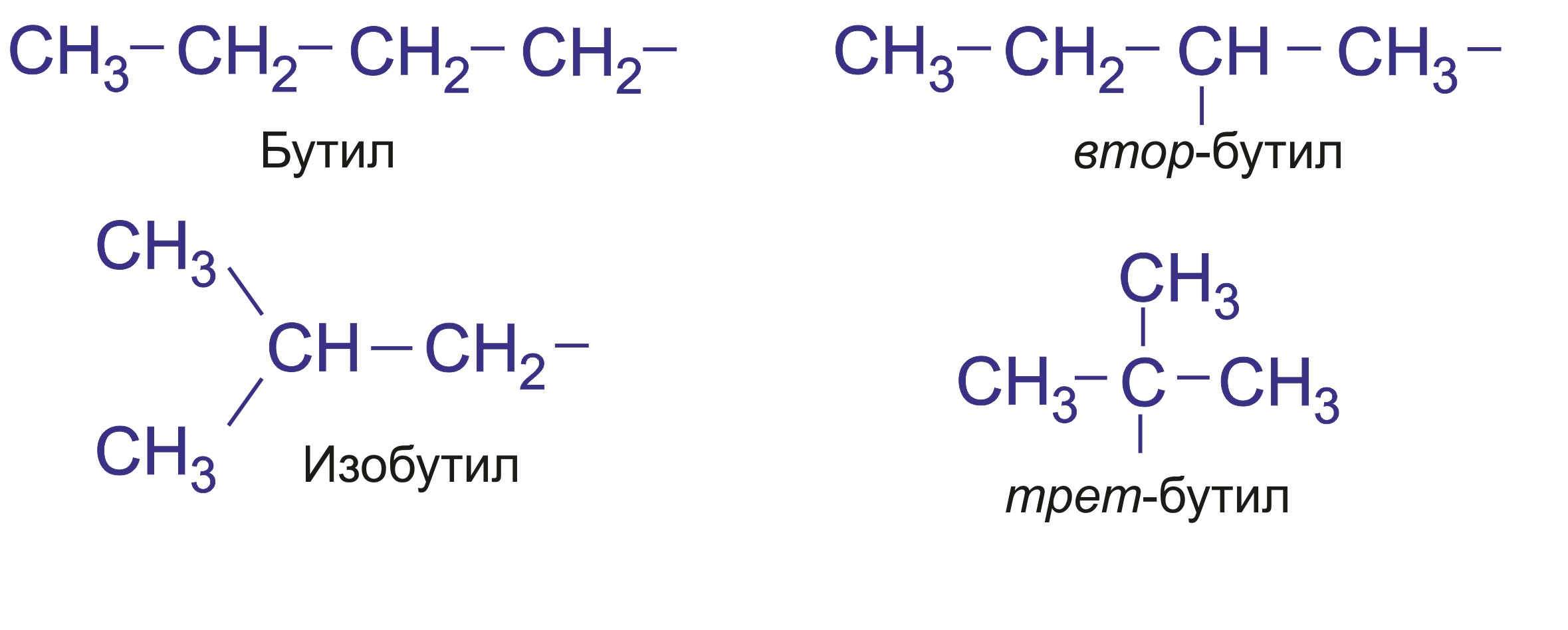
Предельные углеводородные радикалы:
Непредельные углеводородные радикалы:
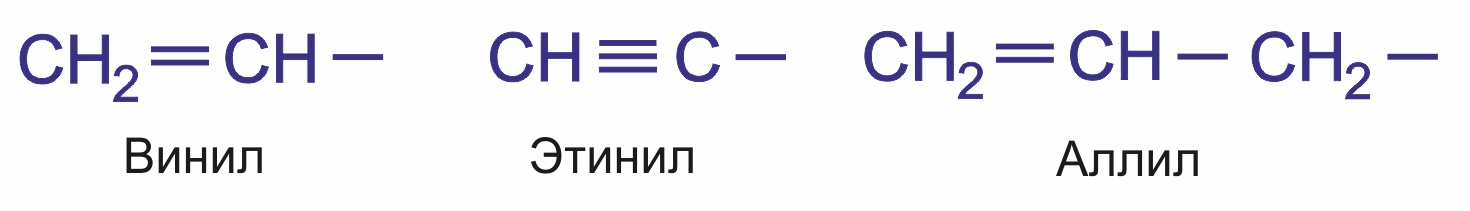
Ароматические углеводородные радикалы:
В качестве примера назовем следующее соединение:
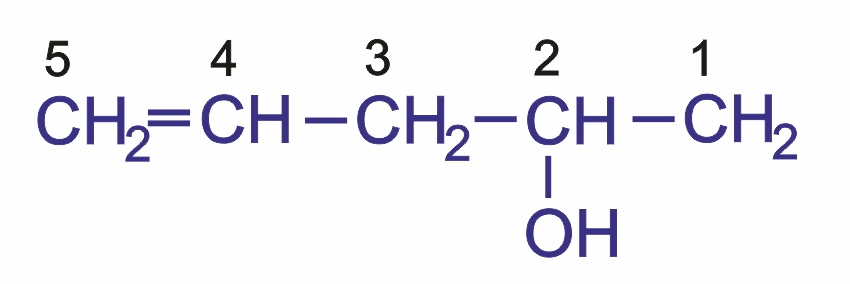
1) Выбор цепи однозначен, следовательно, корень слова — пент; далее следует суффикс -ен, указывающий на наличие кратной связи;
2) порядок нумерации обеспечивает старшей группе (—ОН) наименьший номер;
3) полное название соединения заканчивается суффиксом, обозначающим старшую группу (в данном случае суффикс -ол указывает на наличие гидроксильной группы); положение двойной связи и гидроксильной группы указывается цифрами.
Следовательно, приведенное соединение называется пентен-4-ол-2.
Классификация реакций в органической химии
Органические реакции классифицируют по направлению(1), по механизму(2) и по молекулярности(3):
1. |
По направлению и конечному результату различают следующие реакции: |
● |
реакции присоединения; |
● |
реакции отщепления; |
● |
реакции замещения; |
● |
перегруппировки. |
В органических реакциях различают субстрат и реагент. Реагентом называют молекулу, атакующую субстрат в ходе осуществления реакции.
2. |
По механизму или характеру реагирующих частиц и типу разрыва ковалентной связи реакции делятся на: гомолитические и гетеролитические. |
Гомолитические (радикальные) реакции сопровождаются гомолитическим разрывом ковалентной связи. Реагентами (как и промежуточными частицами) в таких реакциях обычно являются радикалы (частицы с неспаренным электроном) либо молекулы, легко разрушающиеся до радикалов в условиях реакции, или атомы. Новая связь при этом образуется за счет электронов и реагента, и субстрата.
Условия осуществления гомолитических реакций включают газовую фазу или неполярный растворитель, высокие температуры или воздействие светом (излучением) высокой энергии.
Гетеролитические (ионные, полярные) реакции сопровождаются гетеролитическим распадом связи. В отличие от гомолитических такие реакции протекают в полярной среде при умеренных температурах и нередко требуют присутствия катализатора.
Гетеролитические реакции по характеру реагента подразделяются на два типа:
● |
нуклеофильные реакции, в которых образование новой связи осуществляется за счет электронов реагента (нуклеофила); |
● |
электрофильные реакции, в которых образование новой связи осуществляется за счет электронов субстрата; реагент — электрофил. |
Классификация реагентов проводится по наличию сродства к ядру (нуклеофилы); к электронам (электрофилы) или к атомам (радикалы). Первые два типа реагентов имеют четное число электронов, радикалы несут неспаренный электрон.
Нуклеофильные реагенты — это анионы или молекулы со свободными электронными парами (или образующие их в ходе реакции), либо содержащие легко поляризующиеся электронные оболочки (алкены, арены), которые участвуют в реакциях, предоставляя свои электроны для образования новой связи, и атакуют в молекуле субстрата участок с дефицитом электронов (где заряд ядра не полностью скомпенсирован орбитальными электронами):
Типичные нуклеофилы: :OH, :Hal, :CN, :HOH, :NH3 .
Электрофильные реагенты — это катионы или молекулы, содержащие атомы с незаполненными электронными орбиталями, действие которых связано с приобретением электронной пары в ходе реакции. Электрофилы атакуют в субстрате участок с избытком электронной плотности.
Типичные электрофилы - Br+, H+, HCl, Br2, AlCl3, HOBr, H3O+, HNO3(NO2+).
Нуклеофилы — доноры электронов, электрофилы — их акцепторы.
3. |
По молекулярности. Молекулярность органической реакции определяют по числу молекул, в которых происходит реальное изменение ковалентных связей на самой медленной стадии реакции, определяющей ее скорость. Различают следующие виды реакций: |
● |
мономолекулярные — на лимитирующей стадии участвует одна молекула; |
● |
бимолекулярные — таких молекул две и т.д. |