Органическая химия

Тема 2.6. АРЕНЫ (ароматические углеводороды)
Арены, или ароматические углеводороды — это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей. |
Гомологический ряд бензола отвечает общей формуле СnН2n-6 (n ≥ 6).
Простейшие представители:
• |
одноядерные арены:
|
• |
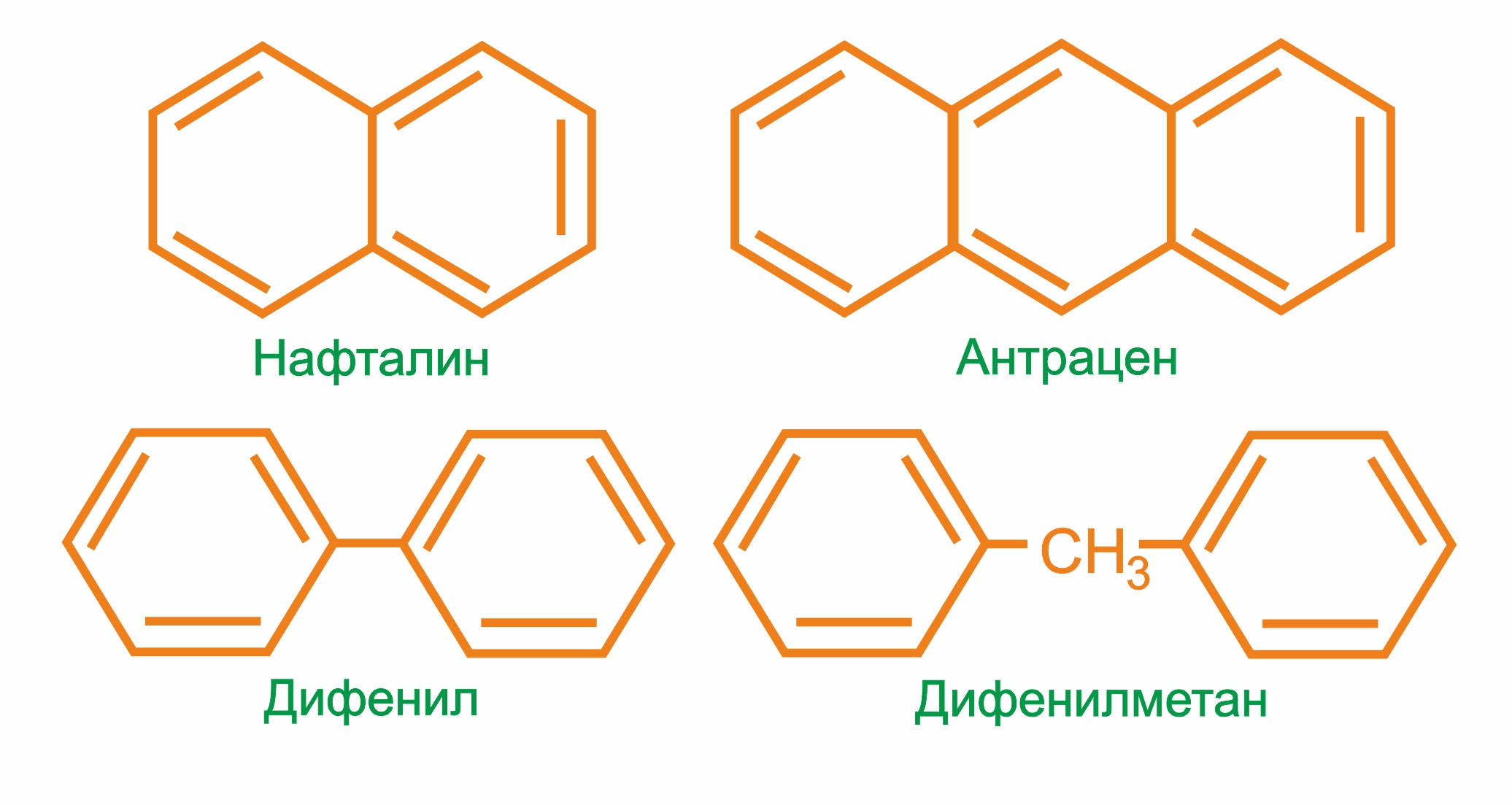
многоядерные арены: нафталин С10Н8, антрацен С14Н10 и др.
|
Термин «ароматические соединения» возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Однако в настоящее время в понятие «ароматичность» вкладывается совершенно иной смысл.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией π-электронов в циклической системе.
Критерии ароматичности аренов:
• |
атомы углерода в sp2-гибридизованном состоянии образуют циклическую систему; |
• |
атомы углерода располагаются в одной плоскости (цикл имеет плоское строение); |
• |
замкнутая система сопряженных связей содержит 4n+2 π-электронов (n – целое число). |
Этим критериям полностью соответствует молекула бензола С6Н6.
Строение бензола
Бензол С6Н6 — родоначальник ароматических углеводородов.
Каждый из шести атомов углерода в его молекуле находится в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой π-связей равны 120º. Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости:
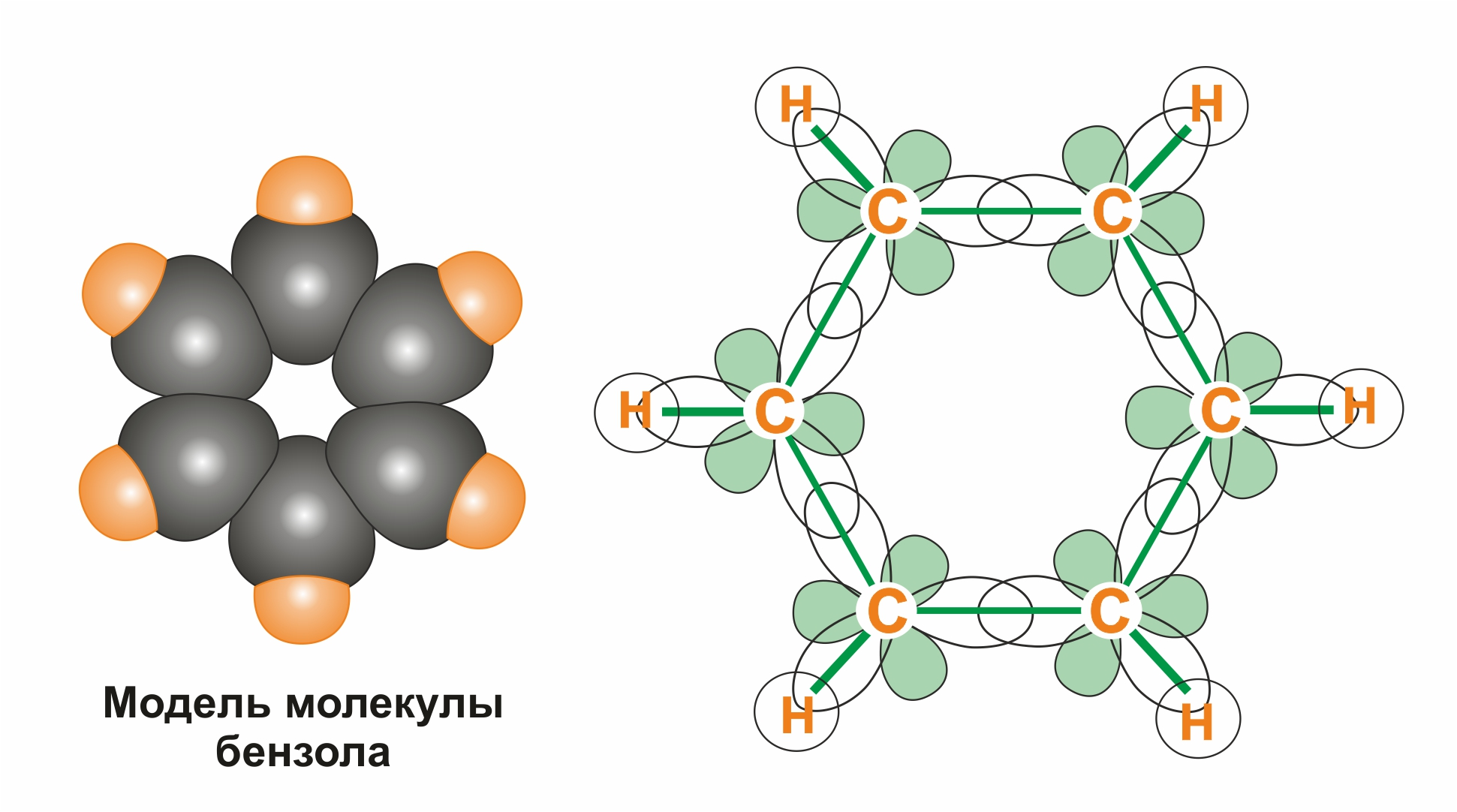
р-электроны всех атомов углерода взаимодействуют между собой путем бокового перекрывания соседних 2р-АО, расположенных перпендикулярно плоскости σ-скелета бензольного кольца. Они образуют единое циклическое π-электронное облако, сосредоточенное над и под плоскостью кольца.

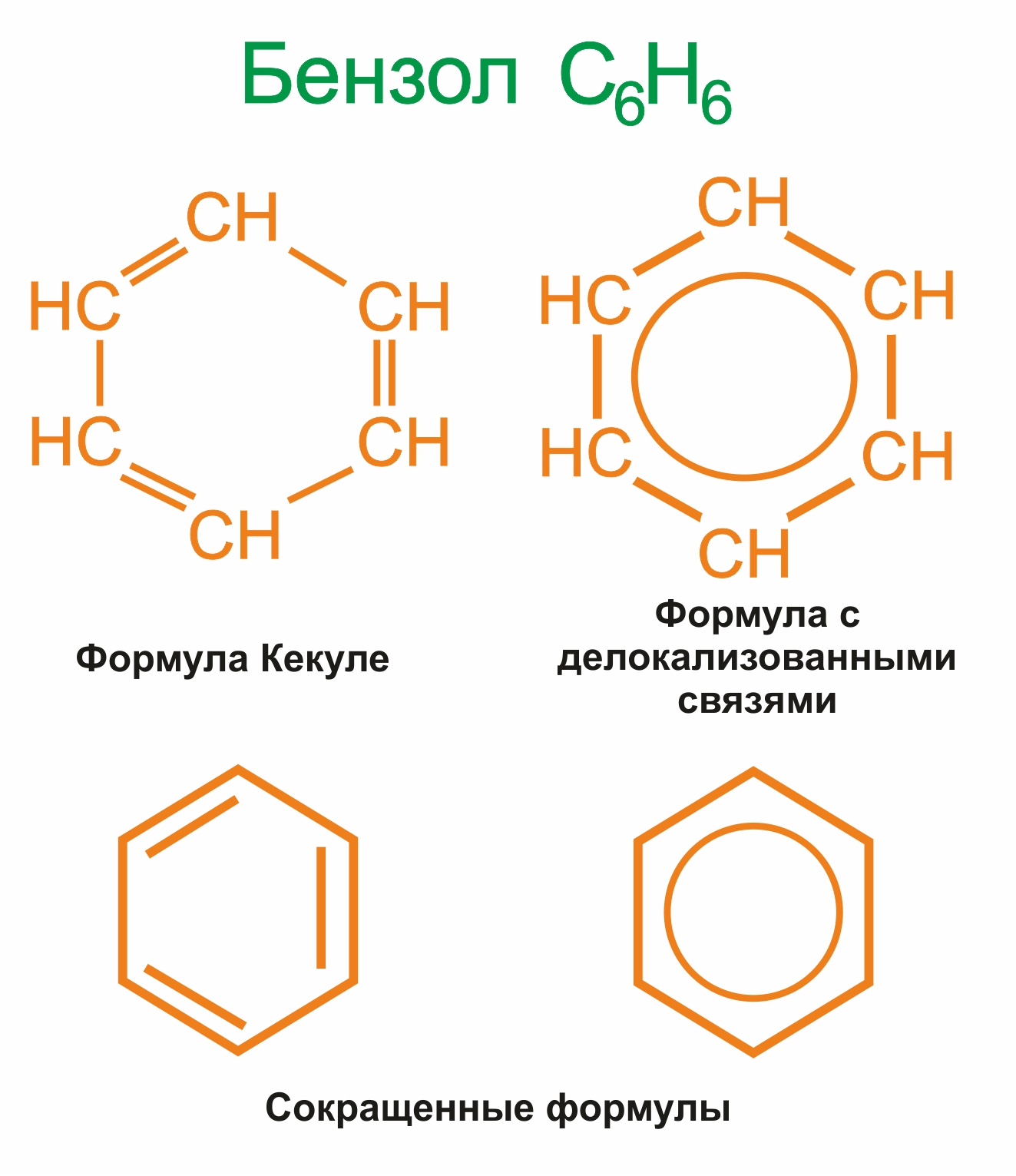
Все связи С–С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф.Кекуле), а все они выравнены (делокализованы). Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (σ-скелет) и кружка внутри него, обозначающего делокализованные π-связи.
Номенклатура аренов
|
Гомологи бензола — соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): |

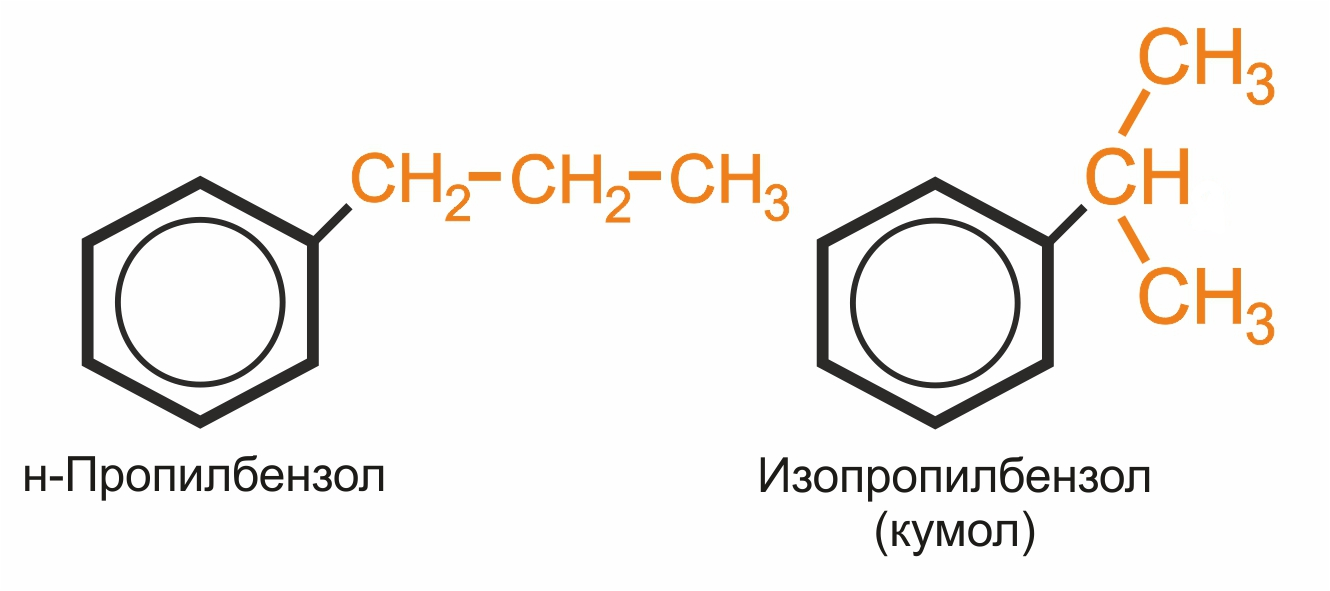
Широко используются тривиальные названия (толуол, ксилол, кумол и т.п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень):
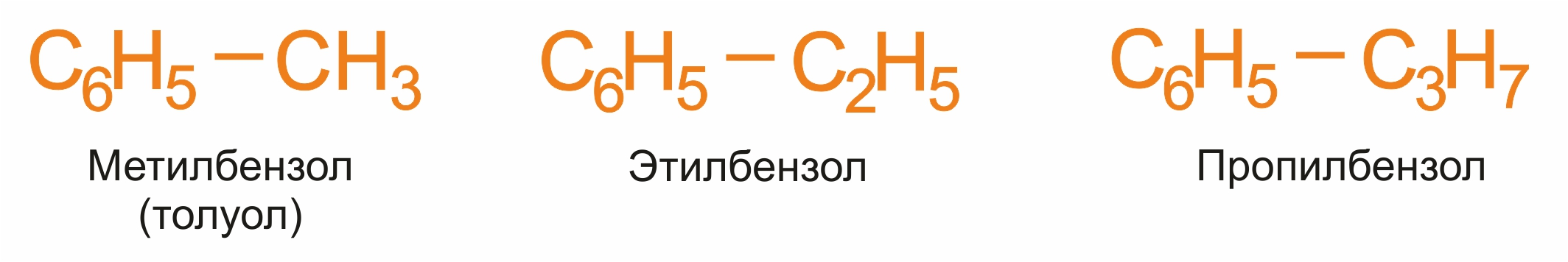
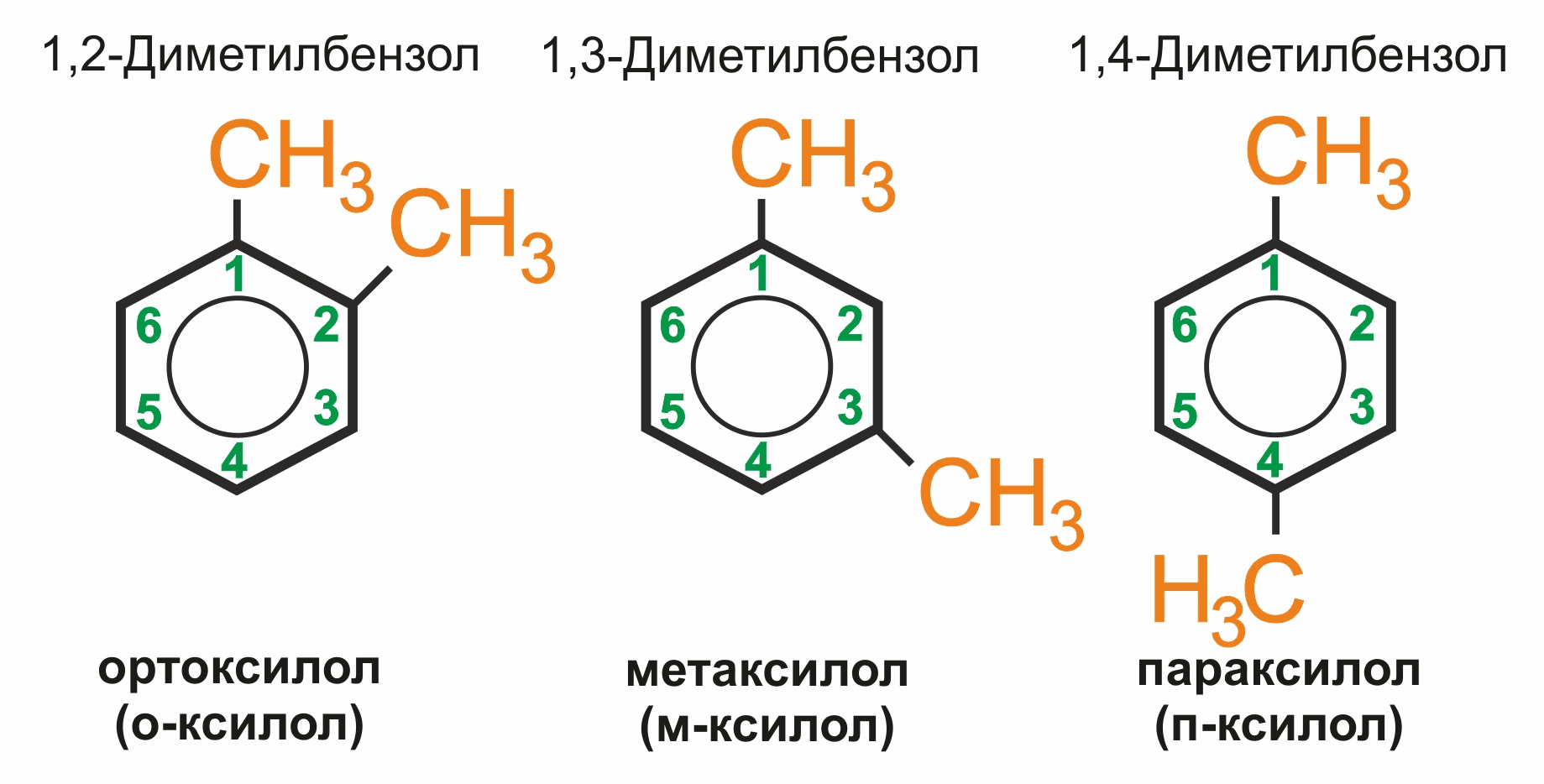
Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими. Дизамещенные производные существуют в виде трех изомеров, различающихся взаимным расположением заместителей.
![]() Положение заместителей указывают цифрами или приставками: 1,2 или орто- (о-); 1,3 или мета- (м-); 1,4 или пара- (п-).
Положение заместителей указывают цифрами или приставками: 1,2 или орто- (о-); 1,3 или мета- (м-); 1,4 или пара- (п-).
Ароматические одновалентные радикалы имеют общее название арил. Из них наиболее распространены в номенклатуре органических соединений два: C6H5- (фенил) и C6H5CH2- (бензил).
Изомерия аренов
1 |
положения заместителей; |
2 |
структура углеродного скелета в боковой цепи, содержащей не менее 3 атомов углерода:
|
3 |
изомерия заместителей R, начиная с R = -С2Н5. |
Молекулярной формуле С8Н10 соответствуют 4 изомера: три ксилола CH3-C6H4-CH3 (о-, м-, п-) и этилбензол C6H5-C2H5.
Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует.
Способы получения аренов
1. |
|
2. |
|
3. |
Сплавление солей ароматических кислот со щелочью:
|
4. |
|
Физические свойства аренов
Бензол и его ближайшие гомологи — бесцветные жидкости со специфическим запахом, не растворимые в воде, но хорошо растворяющиеся во многих органических жидкостях, они легче воды, огнеопасны. Бензол токсичен (поражает почки, печень, костный мозг, кровь).
Физические свойства бензола
Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Химические свойства аренов
Особенностями строения бензольного кольца объясняется отличие химических свойств аренов от предельных и непредельных углеводородов. Делокализация шести π-электронов в циклической системе понижает энергию молекулы, что обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов. Для аренов более характерны реакции, идущие с сохранением ароматической системы, а именно, реакции замещения атомов водорода, связанных с циклом.
Наличие областей повышенной электронной плотности с двух сторон плоского ароматического цикла ведет к тому, что бензольное кольцо является нуклеофилом и в связи с этим склонно подвергаться атаке электрофильным реагентом. Таким образом, для ароматических соединений наиболее типичны реакции электрофильного замещения.
Для аренов возможны и другие реакции (присоединение, окисление). В них участвуют делокализованные углерод-углеродные связи бензольного кольца и нарушается его ароматичность, поэтому они протекают с трудом, при особых условиях.
Примеры реакций электрофильного замещения в бензоле
1. |
Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, AlBr3, FeCl3 и т.п. (кислот Льюиса):
|
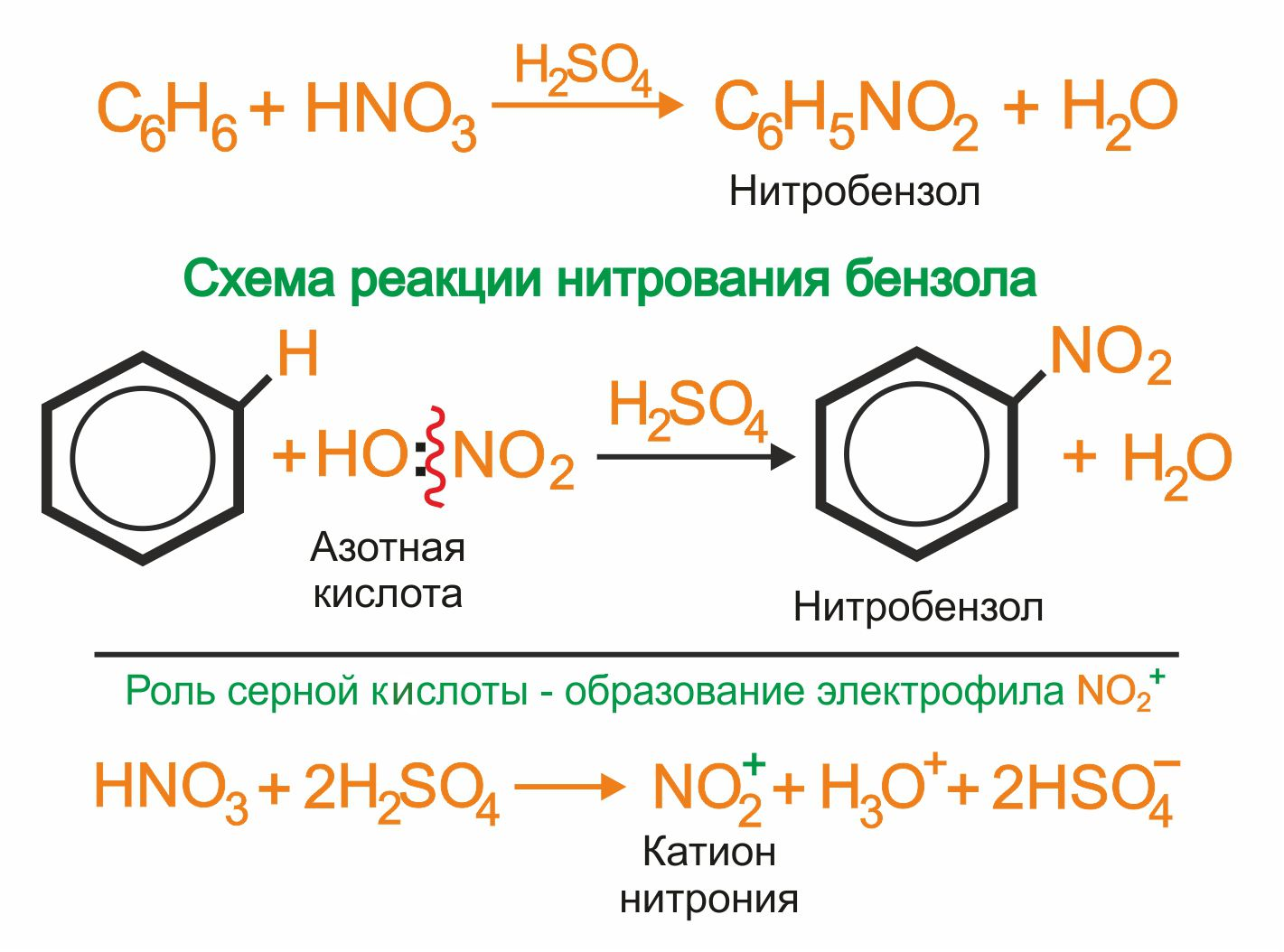
2. |
Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
|
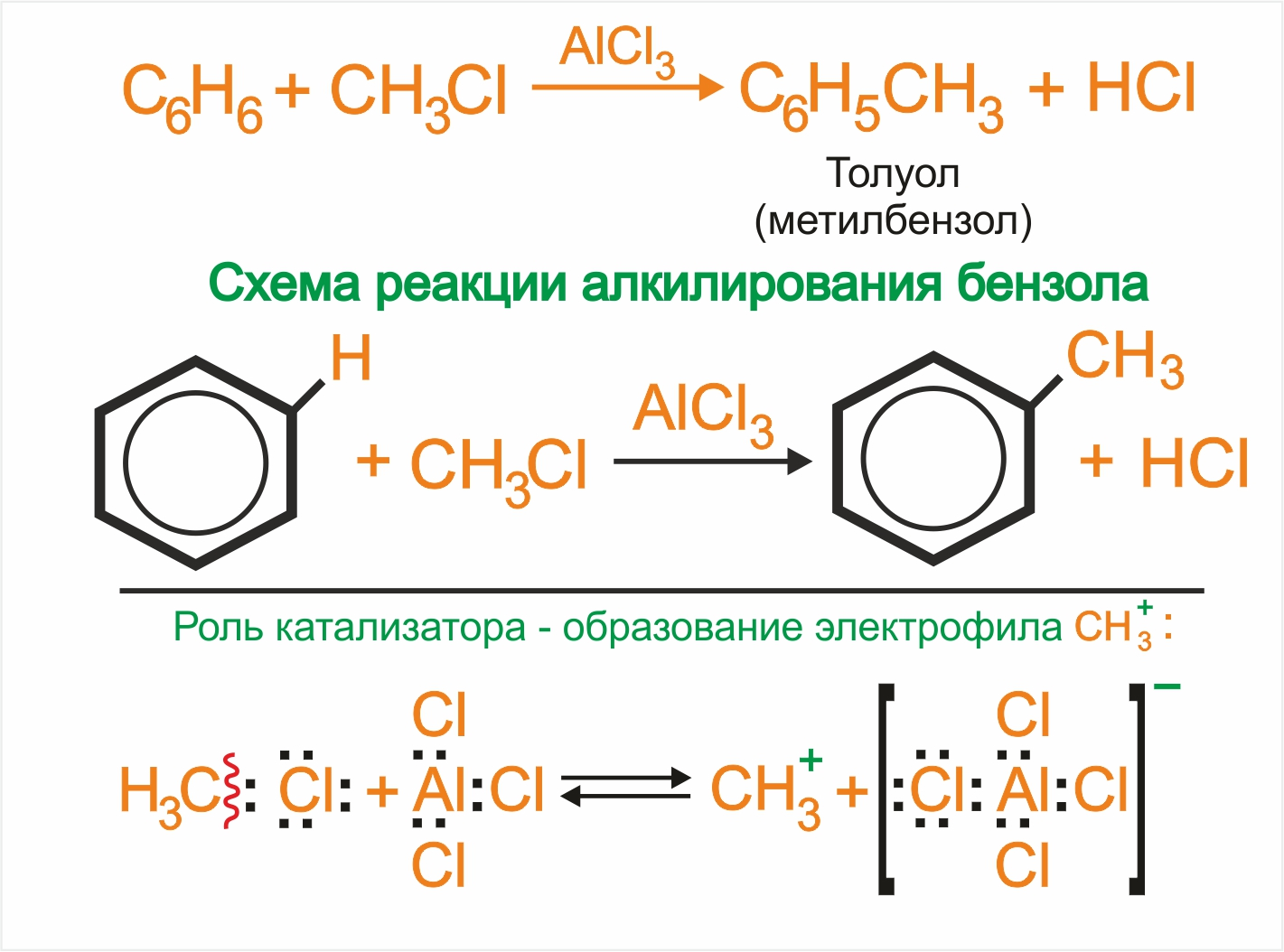
3. |
Замещение атома водорода в бензольном кольце на алкильную группу (алкилирование) происходит под действием алкилгалогенидов (реакция Фриделя-Крафтса) в присутствии катализаторов AlCl3, AlBr3, FeCl3 (кислот Льюиса).
|
Замещение в алкилбензолах
![]() Гомологи бензола (алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом.
Гомологи бензола (алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом.
Например, при нитровании толуола С6Н5CH3 может происходить замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:

![]() Взаимное влияние атомов в молекуле на реакционную способность вещества
Взаимное влияние атомов в молекуле на реакционную способность вещества
С одной стороны, метильная группа –СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6:
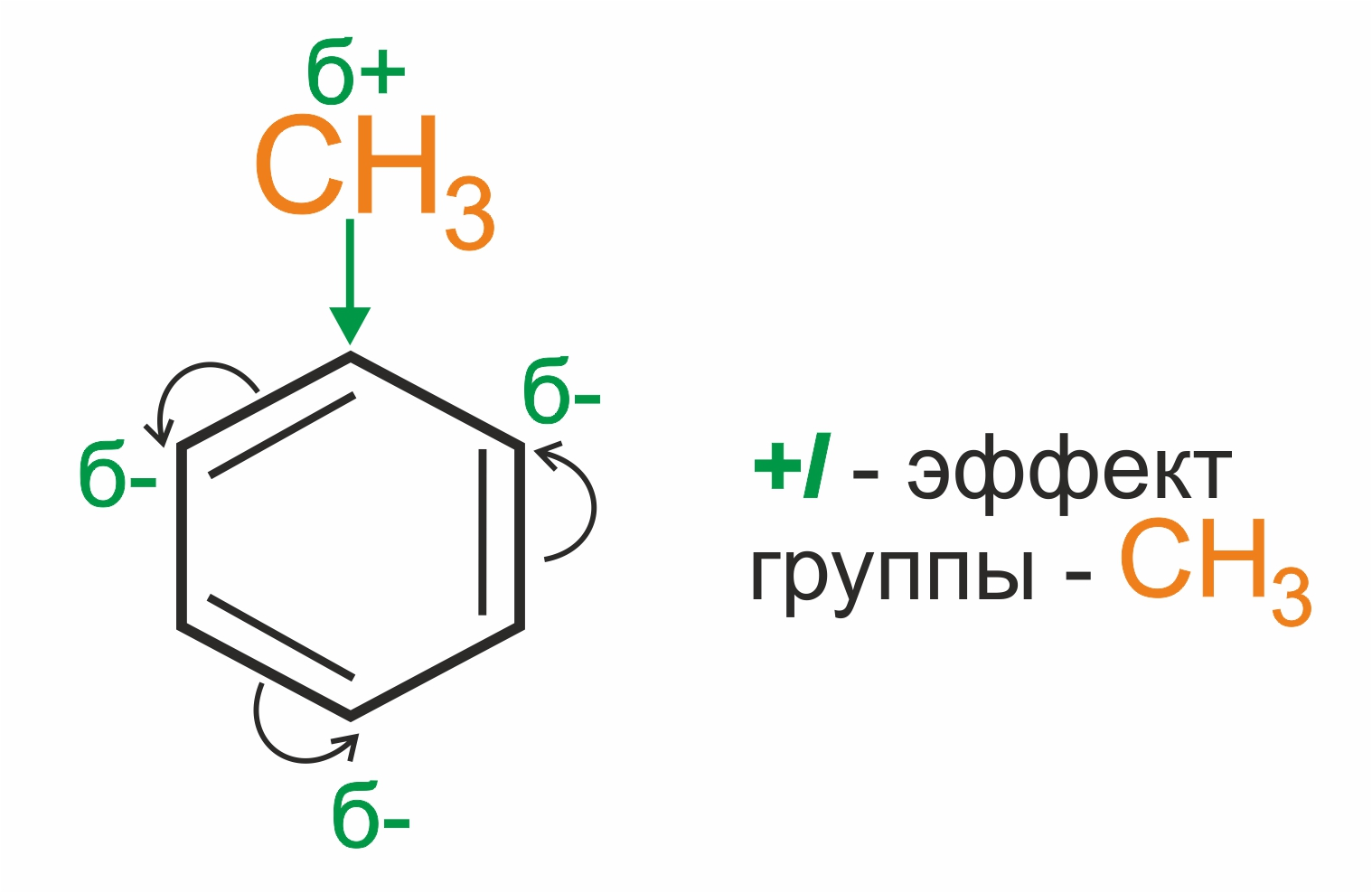
и облегчает замещение именно в этих положениях.
Заместители в бензольном кольце делятся на 2 группы:
• |
ориентанты 1-го рода (-R, -Hal, -OH) направляют заместители в орто- и параположения; |
• |
ориентанты 2-го рода (-NO2 ,-COOH, SO3 H) направляют заместители в метаположение. |
С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4.
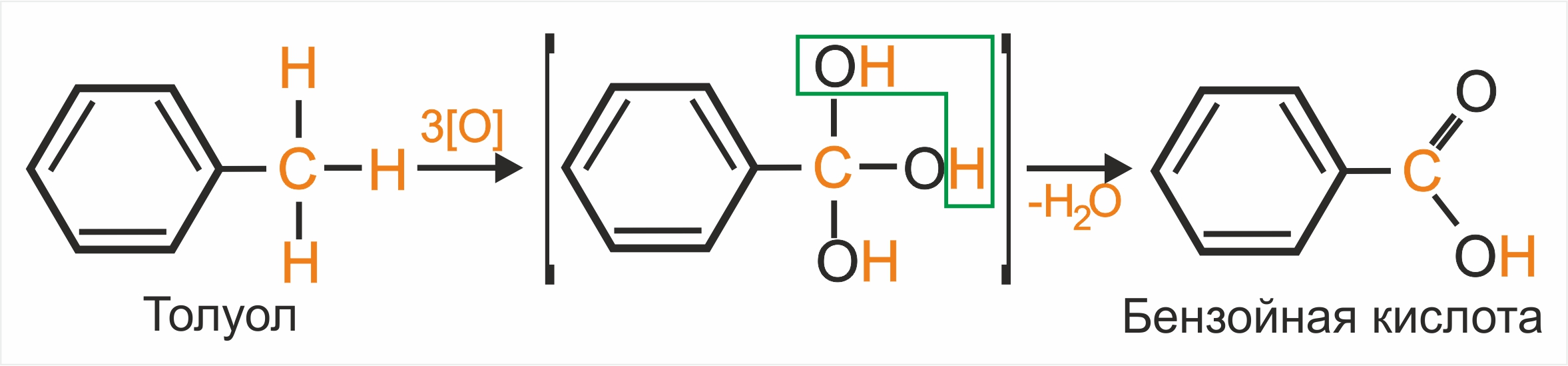
Толуол, в отличие от бензола, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании):
![]() Легче, чем в алканах, протекают реакции радикального замещения в
боковой цепи алкилбензолов:
Легче, чем в алканах, протекают реакции радикального замещения в
боковой цепи алкилбензолов:

Реакции присоединения к аренам
В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом.
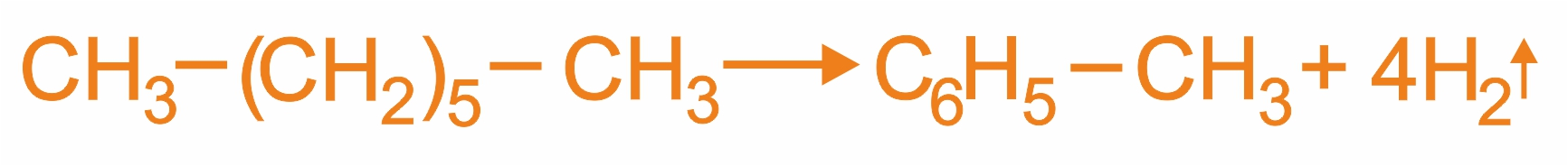
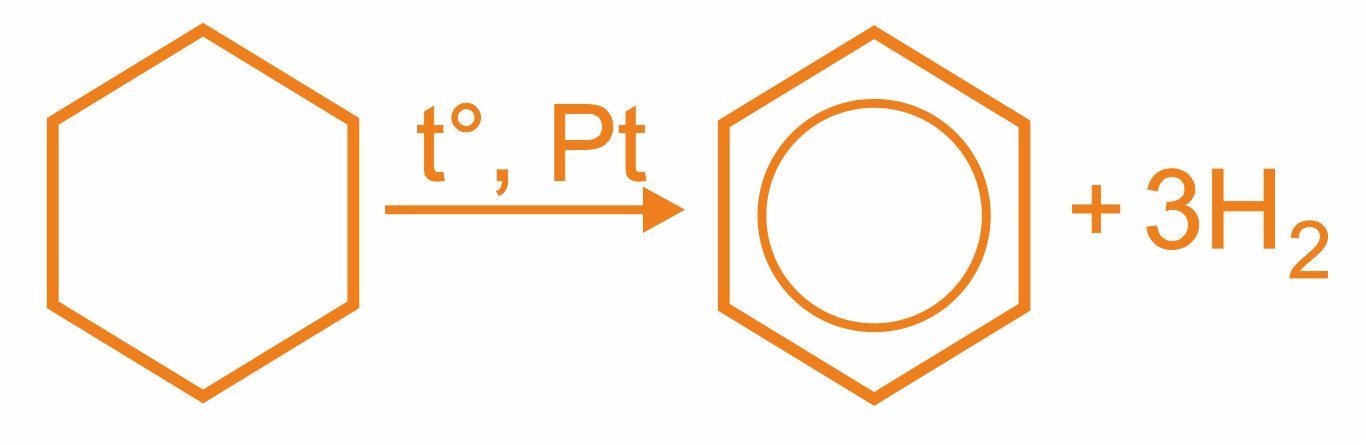
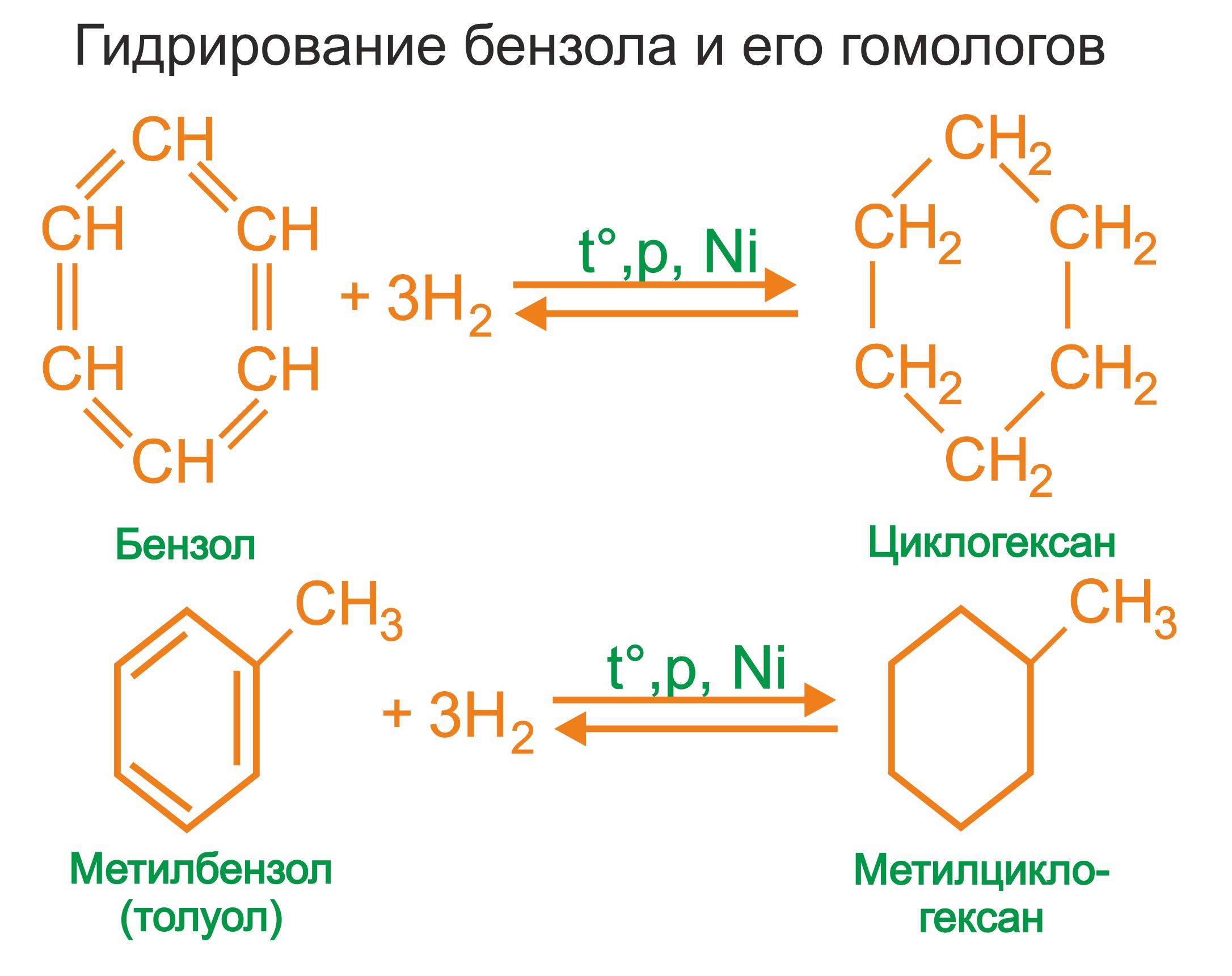
1. |
Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.
|
|
2. |
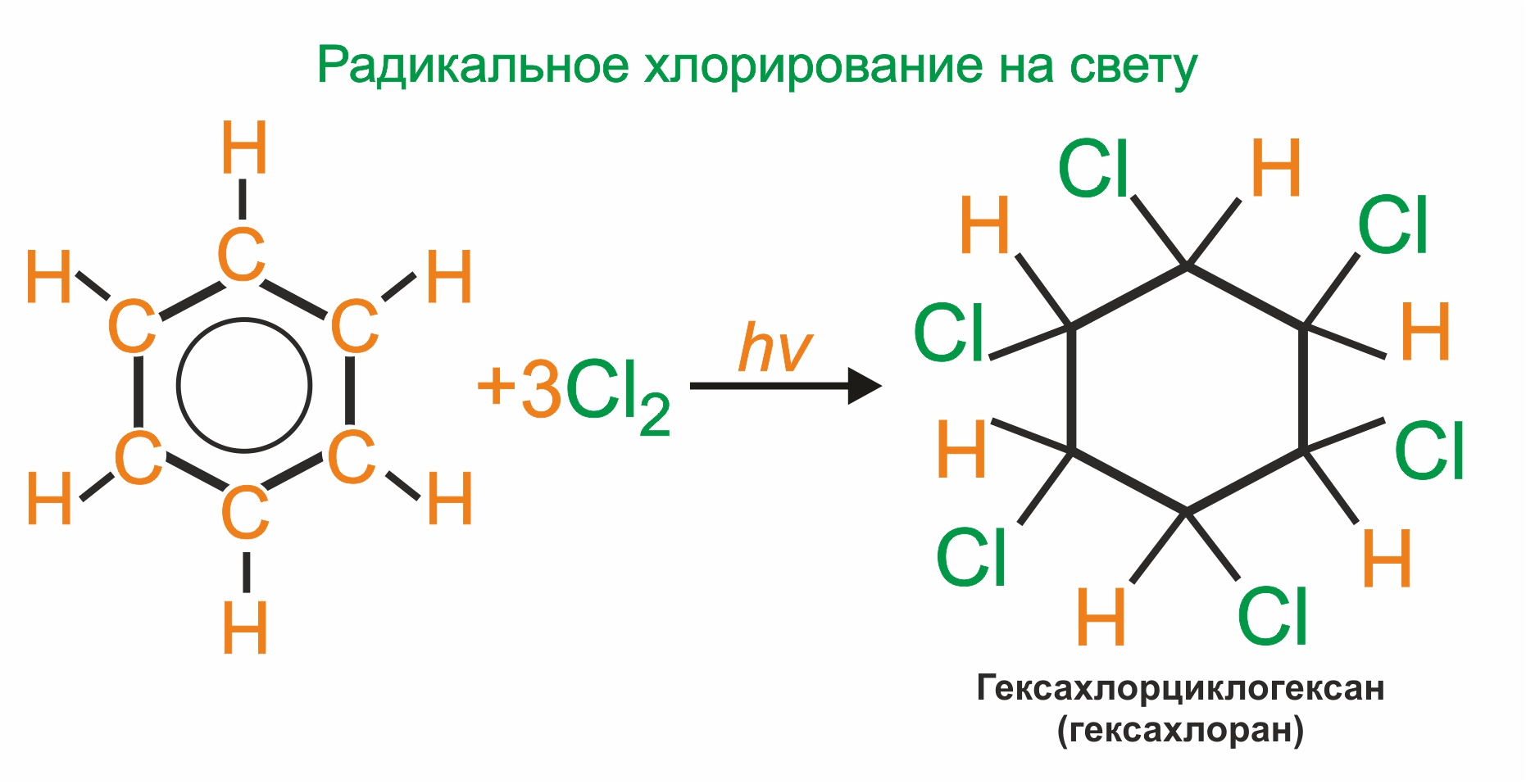
Радикальное хлорирование аренов. В условиях радикальных реакций (ультрафиолетовое облучение, повышенная температура) возможно присоединение галогенов к ароматическим соединениям. При радикальном хлорировании бензола получается гексахлоран (инсектицид — средство борьбы с вредными насекомыми).
|
|
3. |
Реакции окисления аренов. |
|
• |
Бензол при обычных условиях не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). |
|
• |
|
|
• |
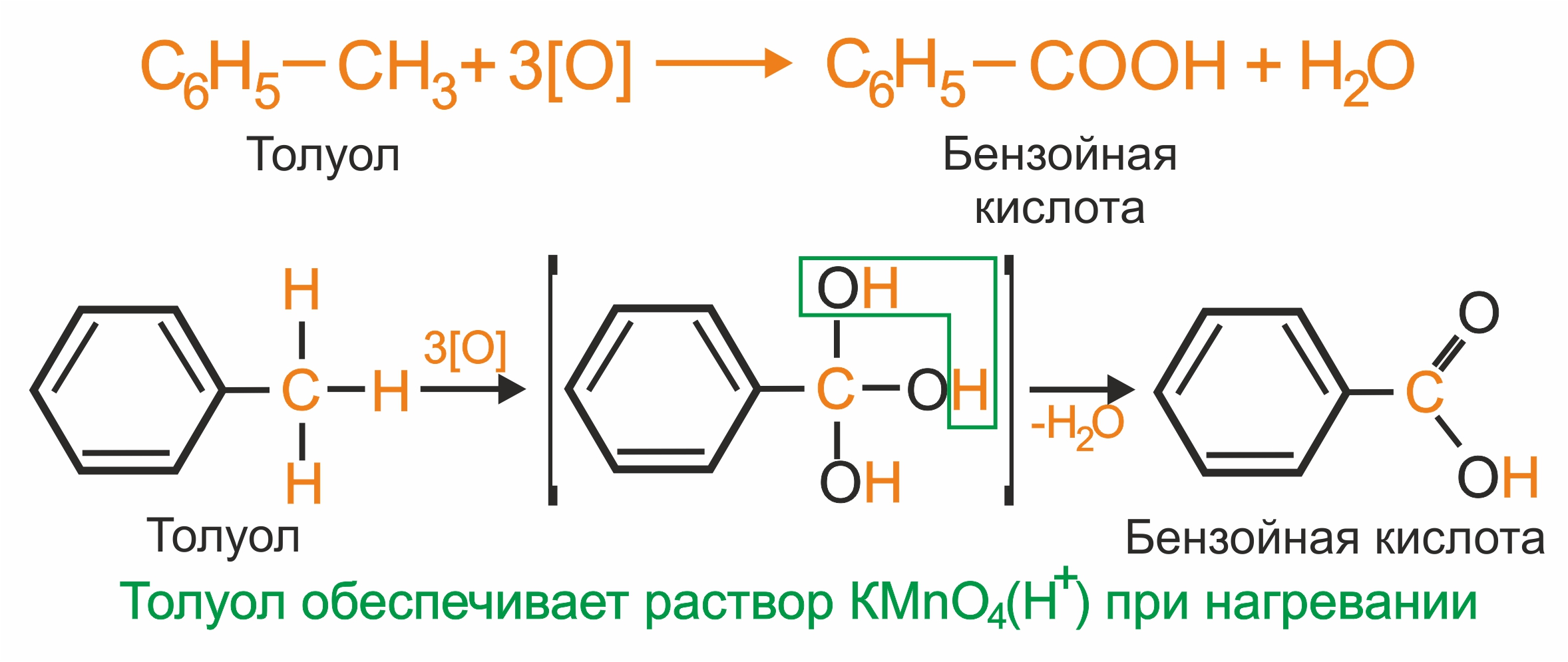
Однозамещенные гомологи бензола (независимо от величины радикала) при окислении образуют бензойную кислоту:
|
|
Двухзамещенные гомологи бензола при окислении образуют фталевые кислоты.
Применение аренов
Бензол С6Н6 используется как исходный продукт для получения различных ароматических соединений — нитробензола, хлорбензола, анилина, фенола — исходного вещества для получения фенолформальдегидных смол; стирола — мономера полистирола и т.д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
Толуол С6Н5–СН3 применяется в производстве красителей, лекарственных и взрывчатых веществ (тротил, тол).
Ксилолы С6Н4(СН3)2 в виде смеси трех изомеров (орто-, мета- и параксилолов) применяются как растворитель и исходный продукт для синтеза многих органических соединений.
Изопропилбензол (кумол) С6Н4-СН(СН3)2 — исходное вещество для получения фенола и ацетона.
Винилбензол (стирол) C6H5-CН=СН2 используется для получения ценного полимерного материала полистирола.