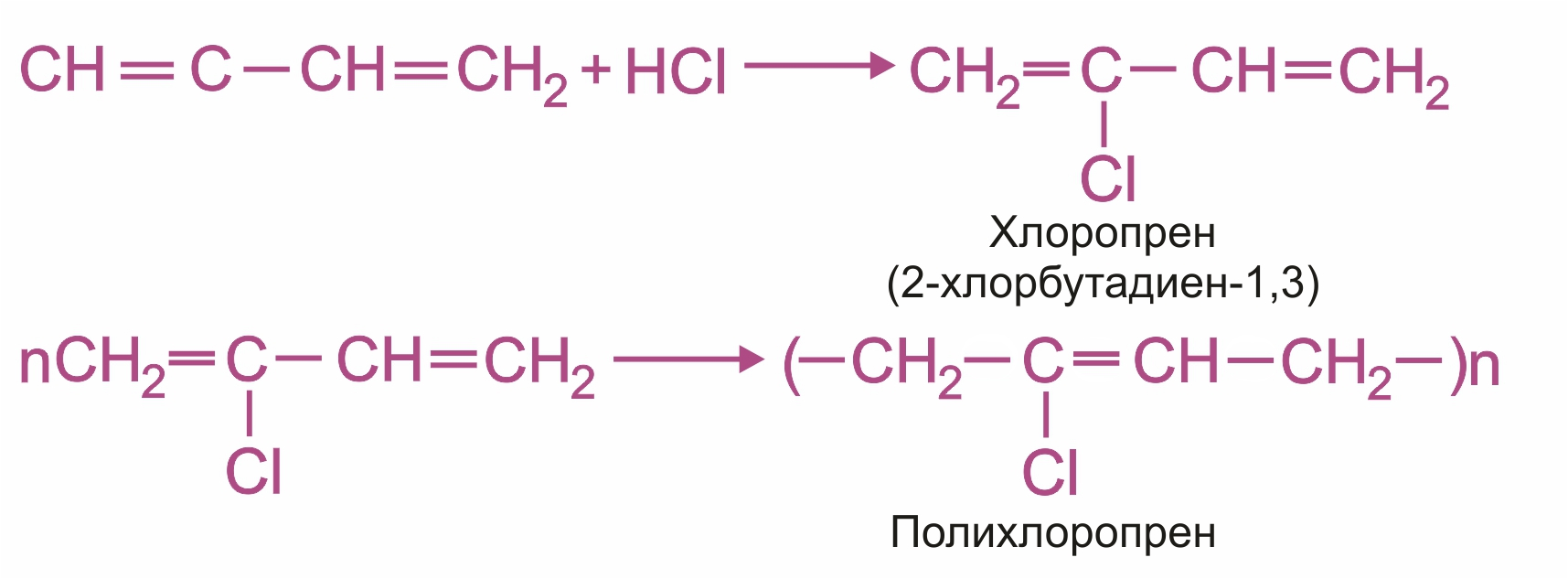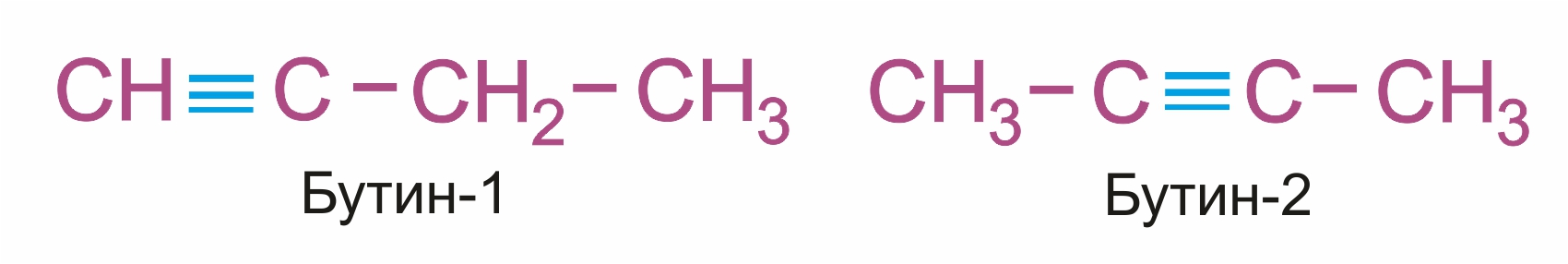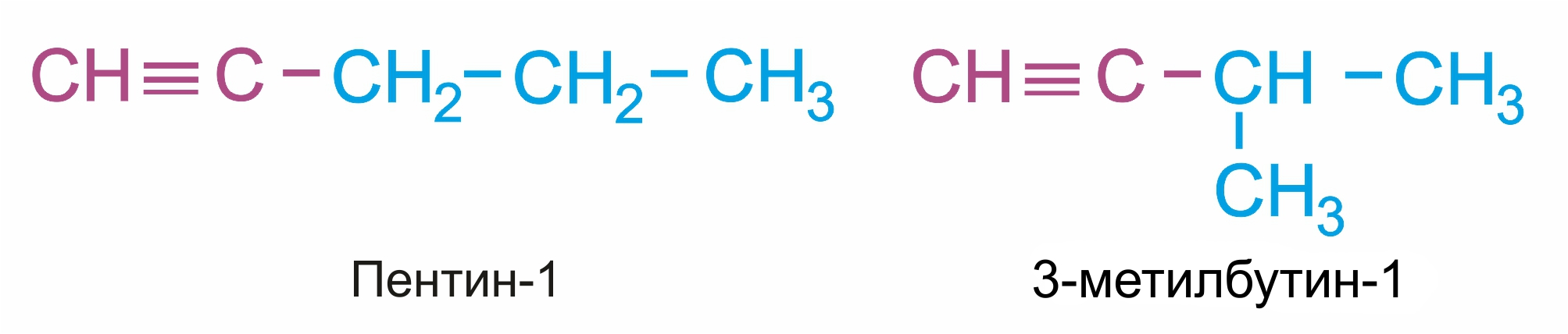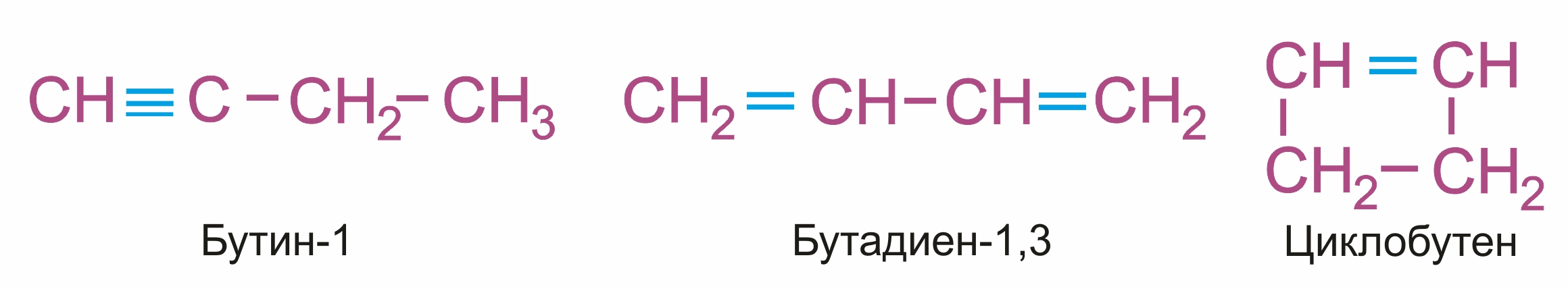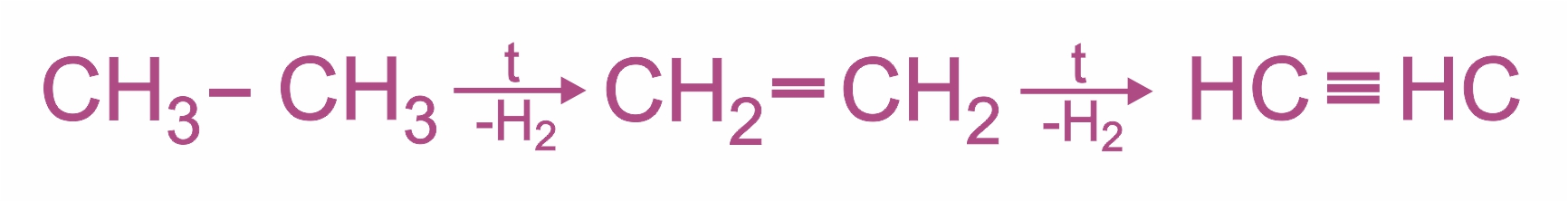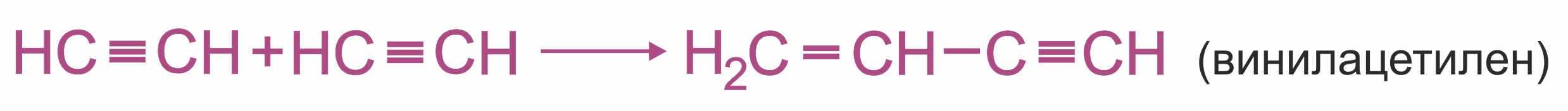Органическая химия

Тема 2.5. АЛКИНЫ (ацетиленовые углеводороды)
|
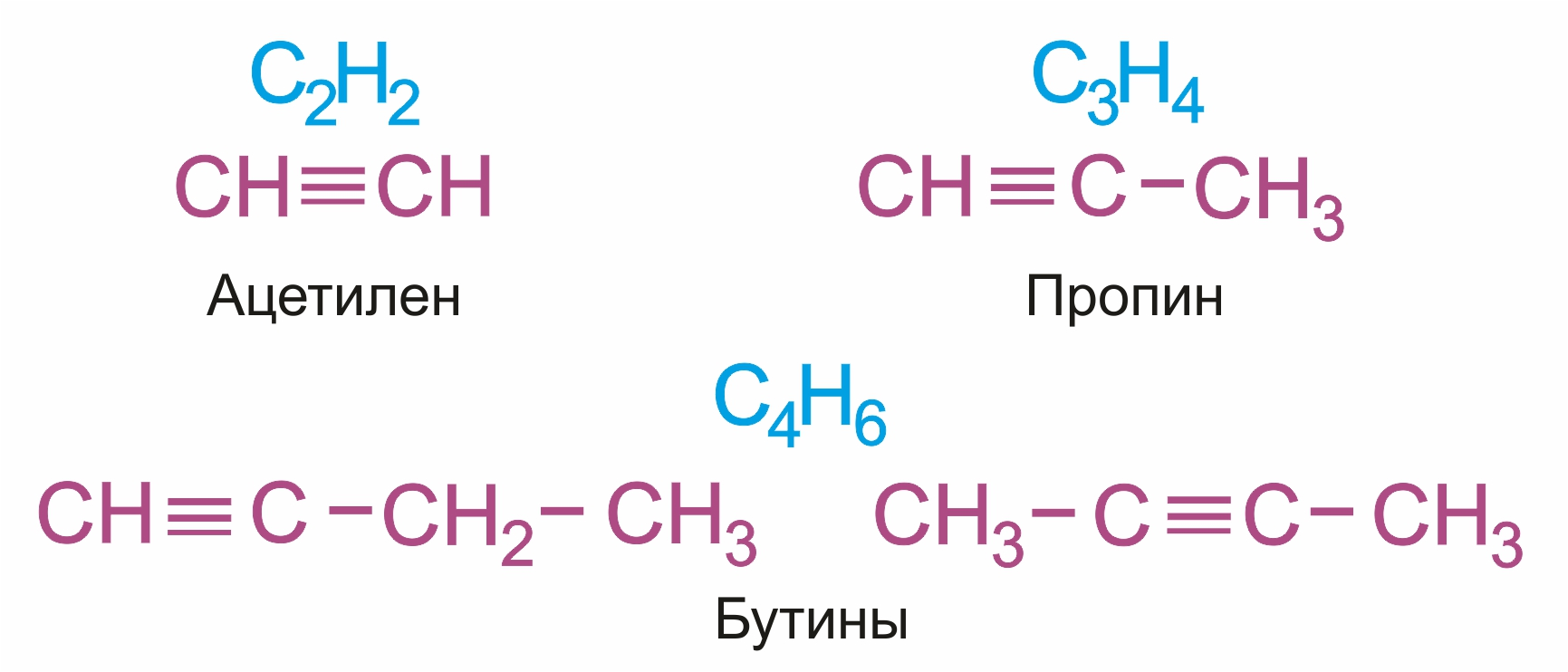
Общая формула гомологического ряда алкинов СnН2n-2.
Простейшие представители:
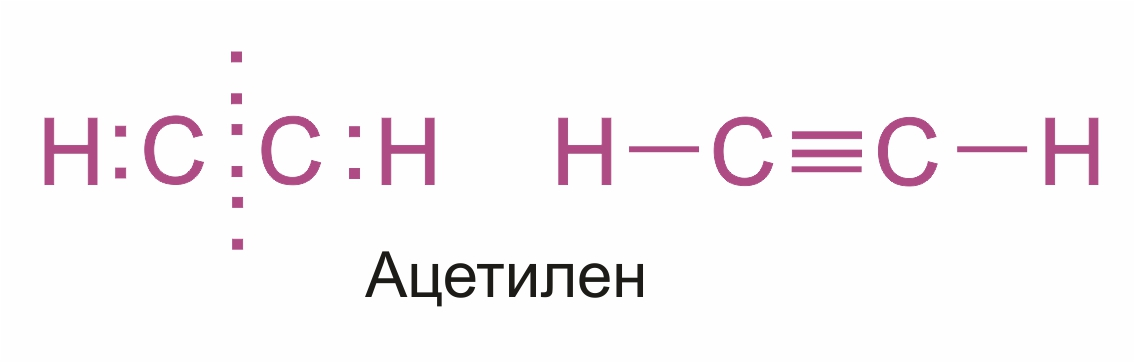
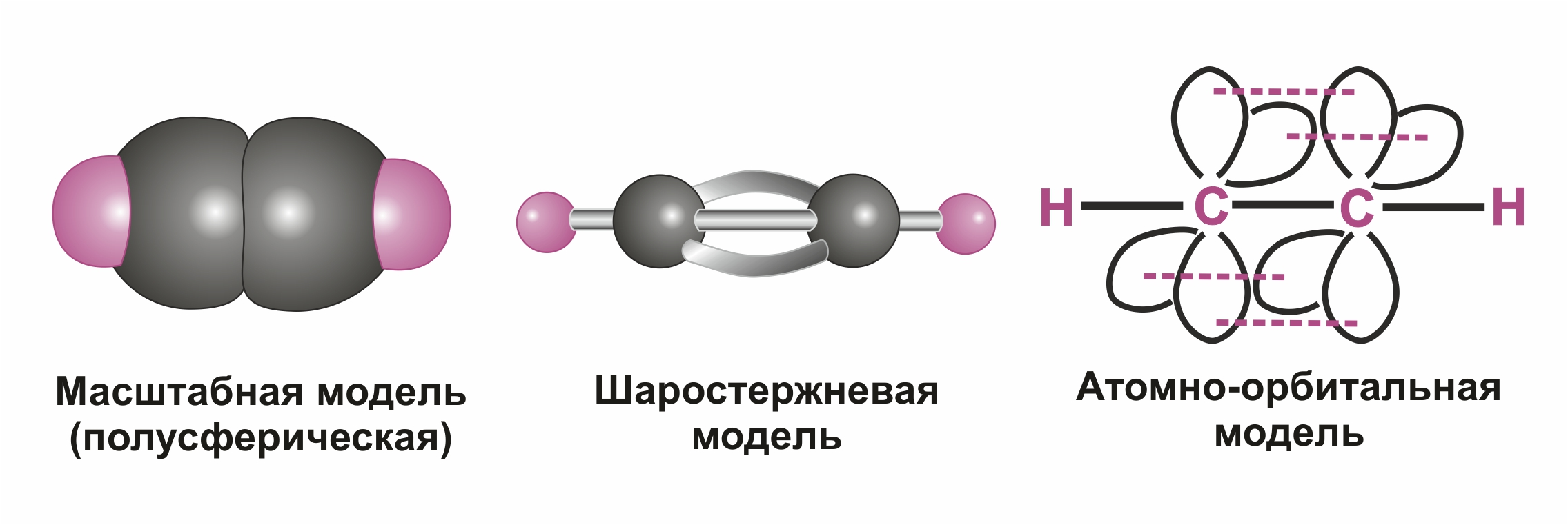
Строение молекулы ацетилена.
Тройную связь C≡C осуществляют 6 общих электронов:
Каждый из атомов углерода имеет по две sp-гибридных орбитали, направленных друг к другу под углом 180º, и две негибридных р-орбитали, расположенных под углом 90º по отношению друг к другу и к sp-гибридным орбиталям.
π-cвязи располагаются во взаимно перпендикулярных плоскостях:
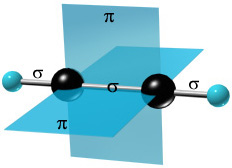
σ-связи, образуемые sp–гибридными орбиталями углерода, располагаются на одной прямой (под углом 180º друг к другу). Поэтому молекула ацетилена имеет линейное строение:
По систематической (международной) номенклатуре ИЮПАК названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ин:
2 атома С → этан → этин; 3 атома С → пропан → пропин и т.д. |
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь (т.е. она может быть не самой длинной).
Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение тройной связи, ставится обычно после суффикса –ин.
Например:
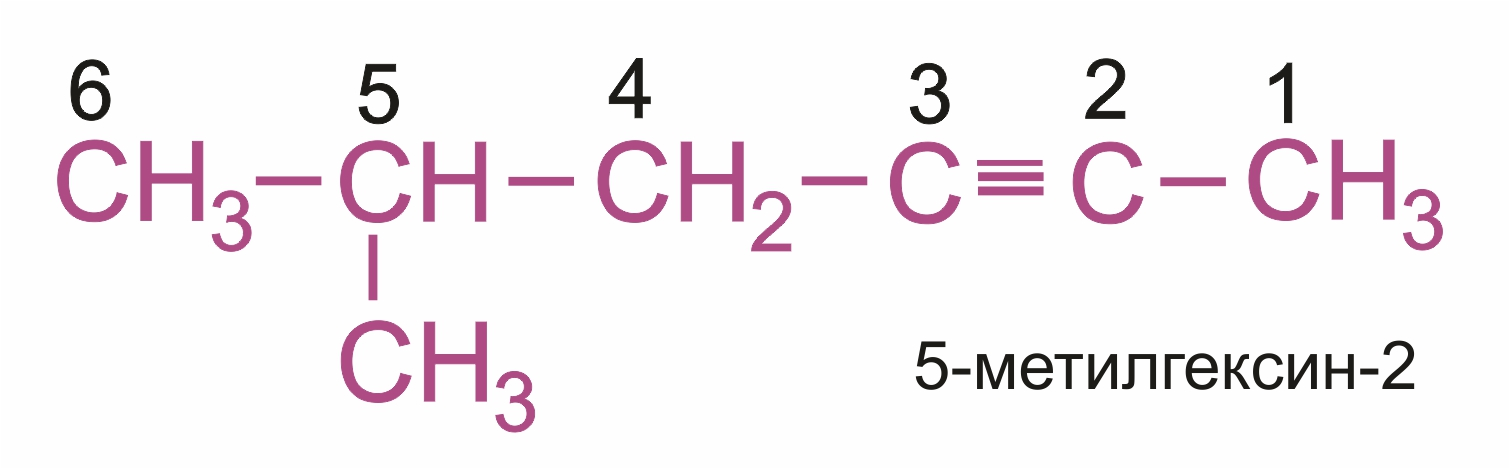
Изомерия алкинов
1. |
Изомерия положения тройной связи (начиная с С4Н6):
|
2. |
Изомерия углеродного скелета (начиная с С5Н8):
|
3. |
Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
|
Пространственная изомерия в алкинах относительно тройной связи не проявляется, т.к. заместители могут располагаться только одним способом – вдоль линии связи.
![]() Ацетилен и его гомологи являются важнейшими исходными продуктами в производстве многих органических веществ и материалов. Их получают в больших количествах, используя ряд промышленных и лабораторных методов.
Ацетилен и его гомологи являются важнейшими исходными продуктами в производстве многих органических веществ и материалов. Их получают в больших количествах, используя ряд промышленных и лабораторных методов.
1. |
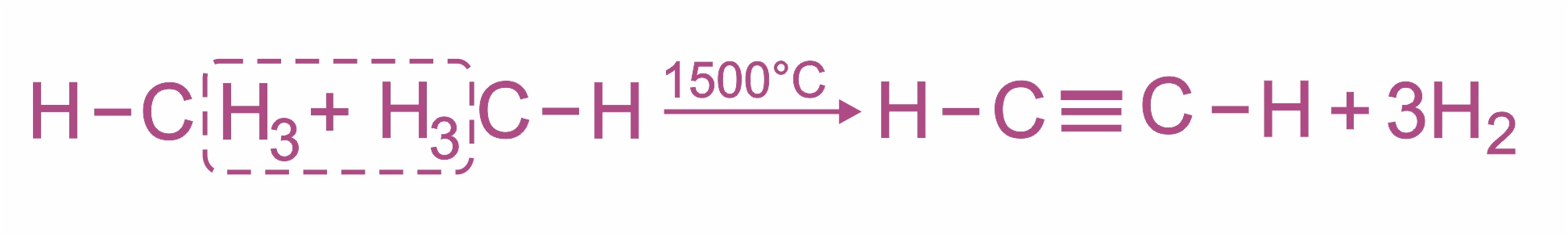
Пиролиз метана:
|
2. |
Пиролиз этана или этилена:
|
3. |
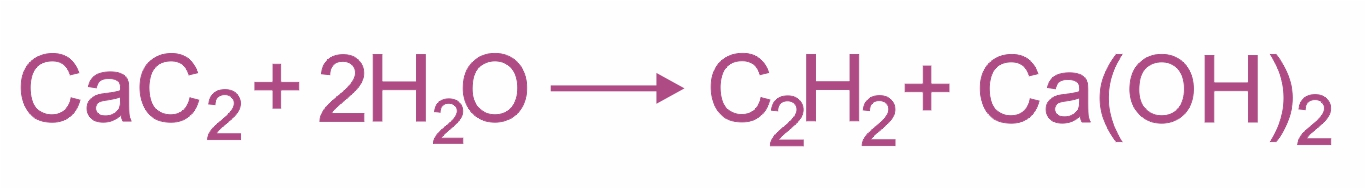
Гидролиз карбида кальция:
|
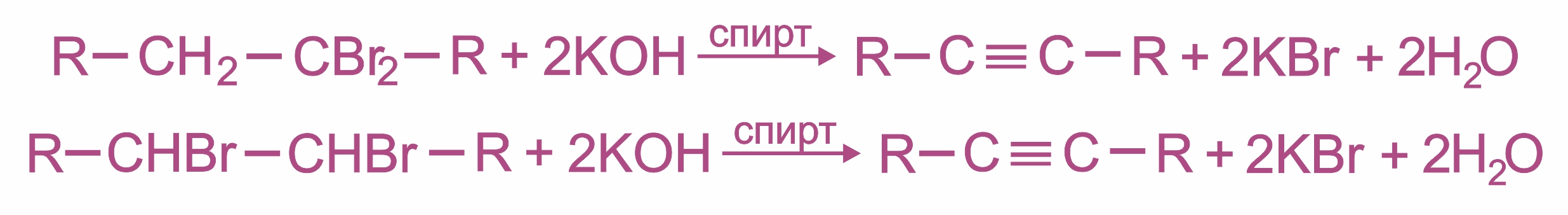
4. |
|
5. |
Удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами:
|
Физические свойства алкинов
Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2Н2-С4Н6 — газы, С5Н8-С16Н30 — жидкости, с С17Н32 — твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов. Алкины плохо растворимы в воде, лучше — в органических растворителях.
Свойства алкинов сходны со свойствами алкенов, что обусловлено их ненасыщенностью, поэтому для них характерны реакции электрофильного присоединения.
Примеры реакций присоединения к алкинам.
1. |
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая π-связь), а затем алканов (разрывается вторая π-связь):
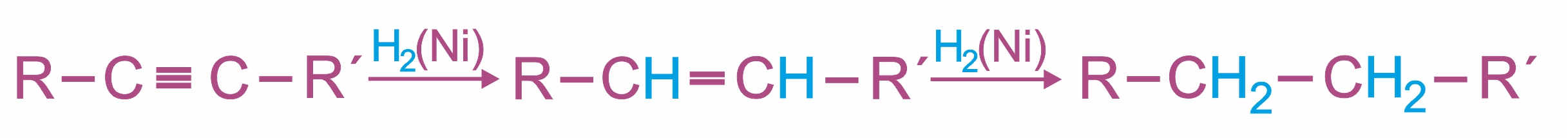
2. |
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая π-связь разрывается труднее, чем вторая):
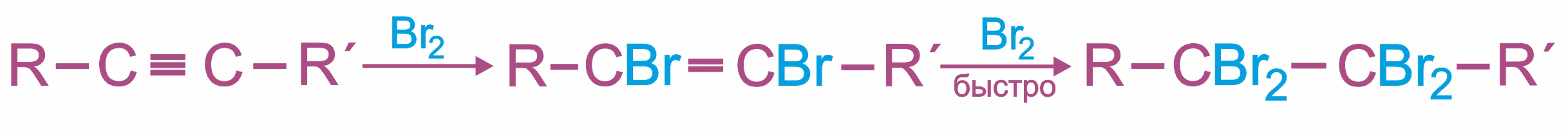
Алкины обесцвечивают бромную воду (качественная реакция на кратную связь).
3. |
Гидрогалогенирование. |
Присоединение к несимметричным алкинам определяется правилом Марковникова:
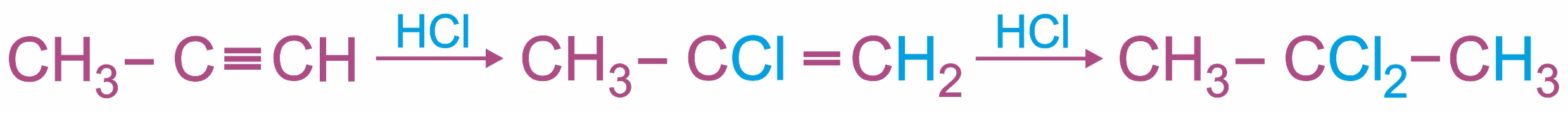
Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида:
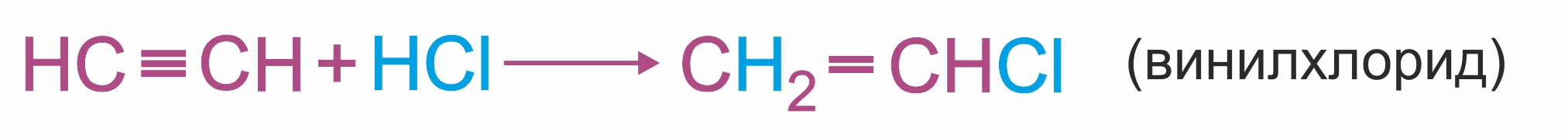
Винилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ).
Особые реакции алкинов
1. |
Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена):
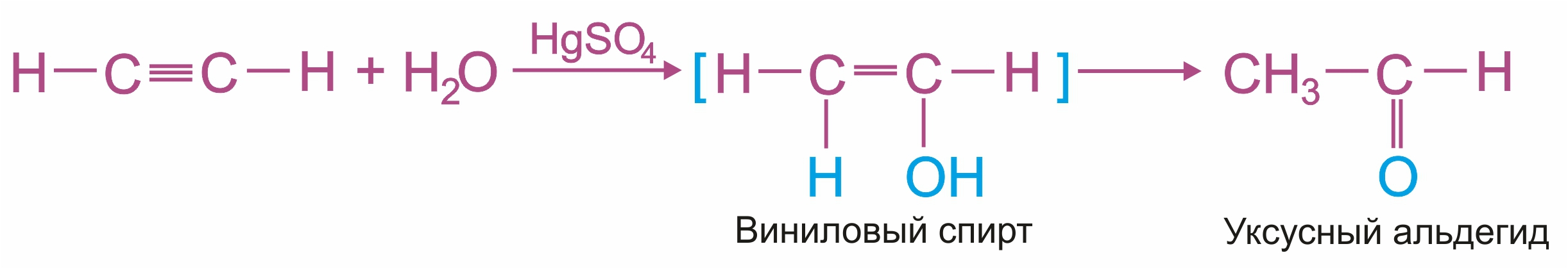
или в кетон (в случае других алкинов):
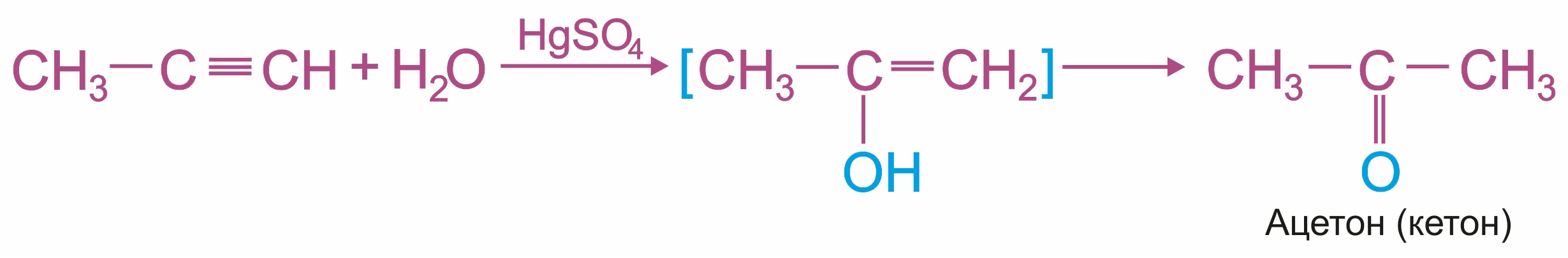
2. |
|
• |
Димеризация под действием водно-аммиачного раствора CuCl:
|
• |
|
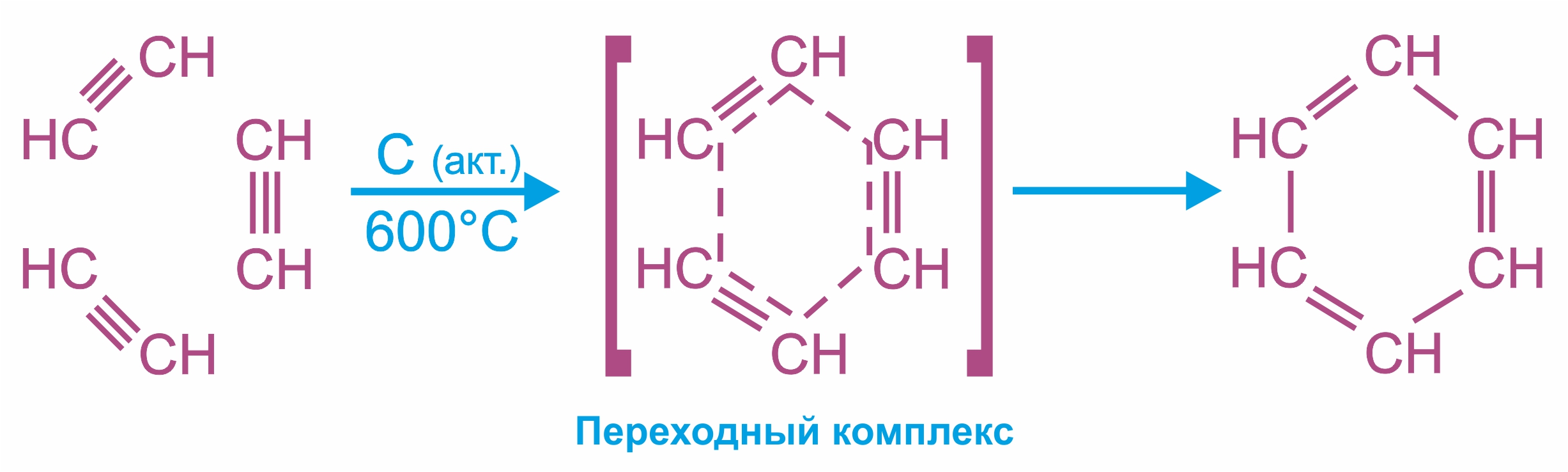
3. |
Замещение атома водорода у углерода с тройной связью на металл, проявление слабокислотных свойств; при этом образуются соли - ацетилениды:
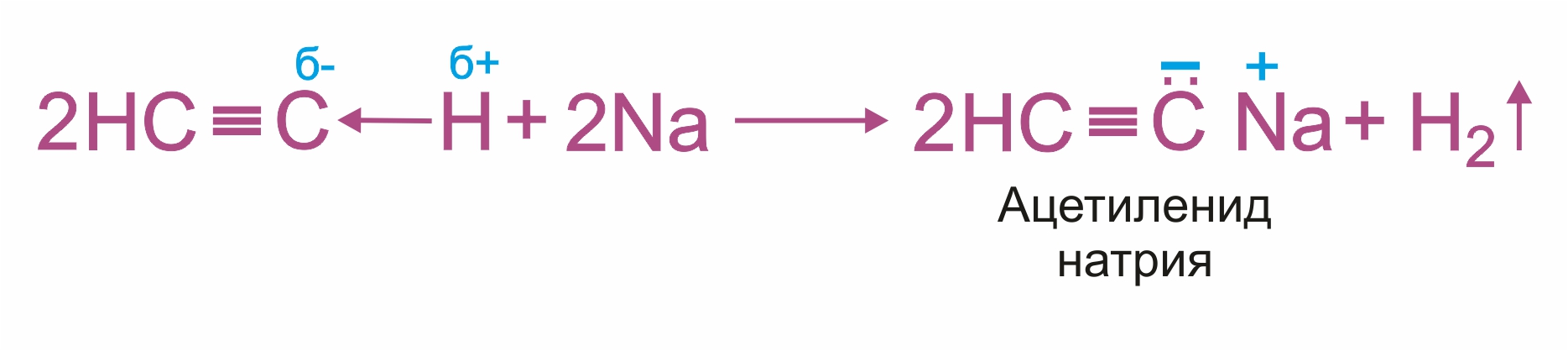
При взаимодействии ацетилена (или R–C≡C–H) с аммиачными растворами оксида серебра или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:
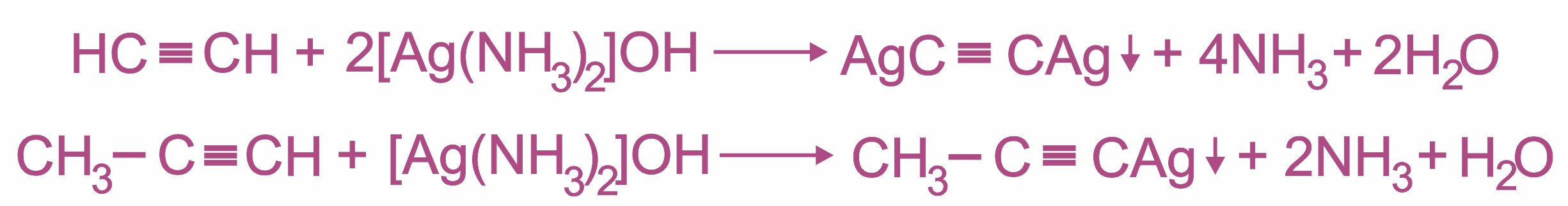
Образование серовато-белого осадка ацетиленида серебра (или красно-коричневого — ацетиленида меди RC≡CCu) служит качественной реакцией на концевую тройную связь.
Получение ацетиленида серебра
Если тройная связь находится не на конце углеродной цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода), и ацетилениды не образуются:

4. |
Окисление алкинов. |
• |
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
|
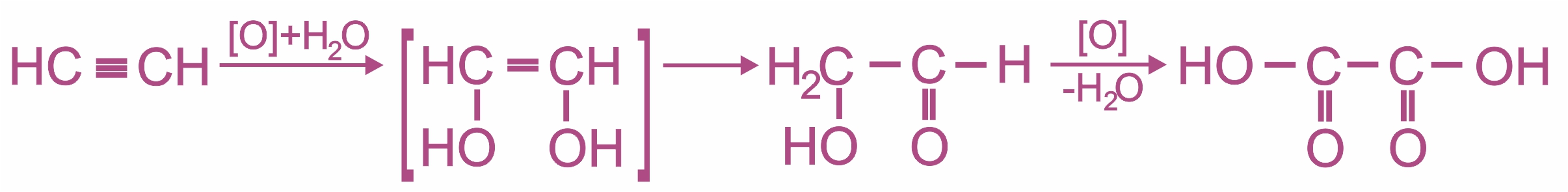
• |
Мягкое окисление без разрыва σ-связи С–С происходит при действии разбавленного раствора перманганата калия, который при этом обесцвечивается. Данная реакция доказывает ненасыщенность алкинов и является качественной на кратную связь, в этих условиях из ацетилена образуется щавелевая кислота:
|
• |
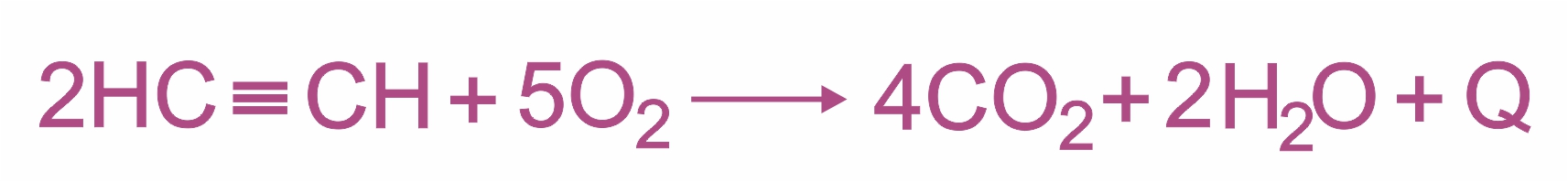
Полное окисление алкинов происходит при их сгорании до CO2 и H2O. Горение ацетилена сопровождается выделением большого количества тепла (Q = 1300 кДж/моль):
|
Температура ацетиленово-кислородного пламени достигает 2800…3000ºС. На этом основано применение ацетилена для сварки и резки металла.
Ацетилен образует с воздухом и кислородом взрывоопасные смеси.
Взрыв смеси ацетилена и кислорода
В сжатом, и особенно в сжиженном, состоянии ацетилен способен взрываться от удара.
Взаимодействие ацетилена и хлора
Применение алкинов
Ацетилен используется для получения самых разнообразных веществ: для синтеза винилхлорида, являющегося мономером для получения высокомолекулярного продукта — поливинилхлорида; для получения винилацетилена — важного промежуточного продукта в производстве синтетического хлоропренового каучука; для производства уксусного альдегида, из которого получают уксусную кислоту; а также для автогенной сварки.
Схема реакции получения хлоропренового каучука из винилацетилена: