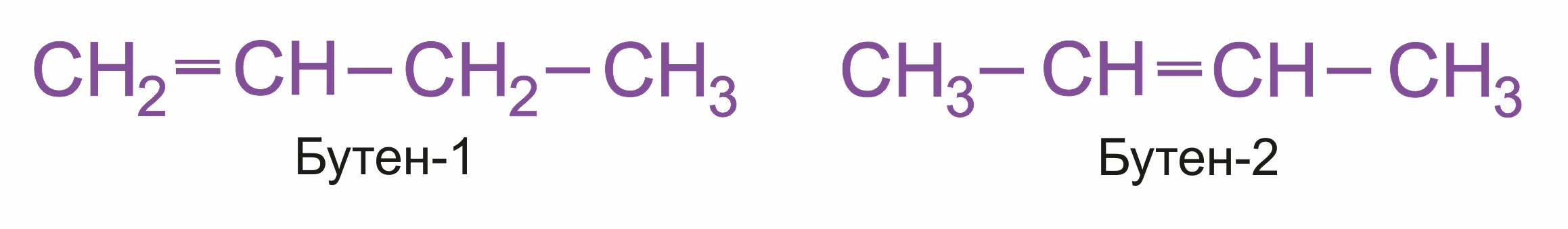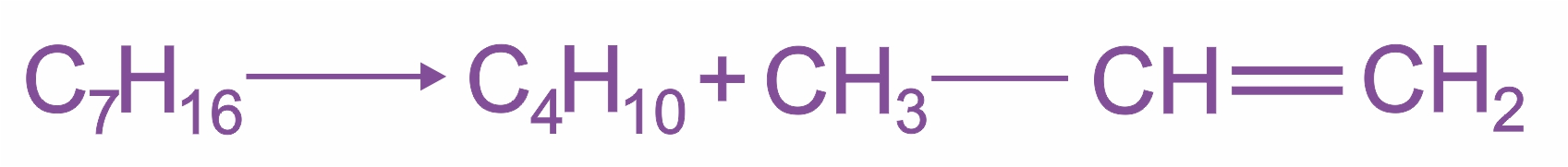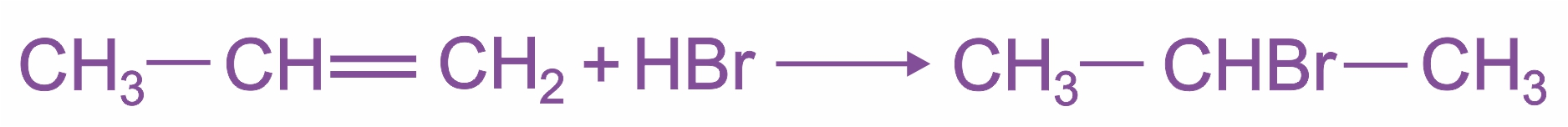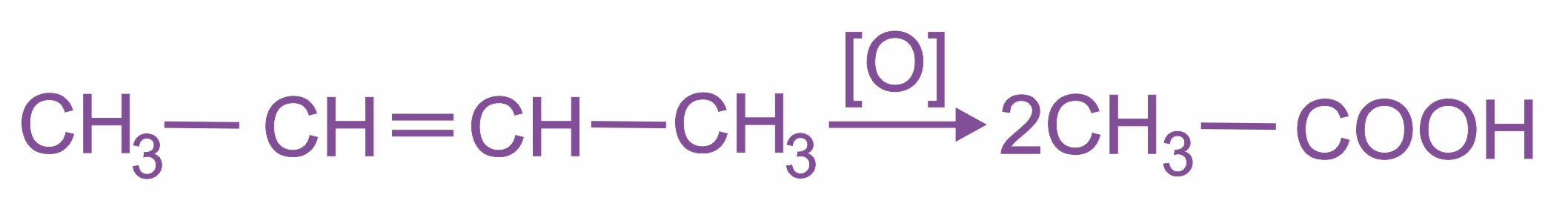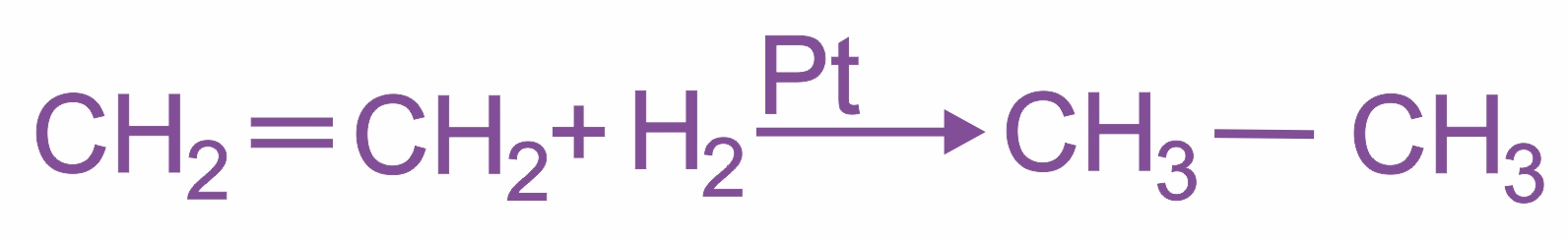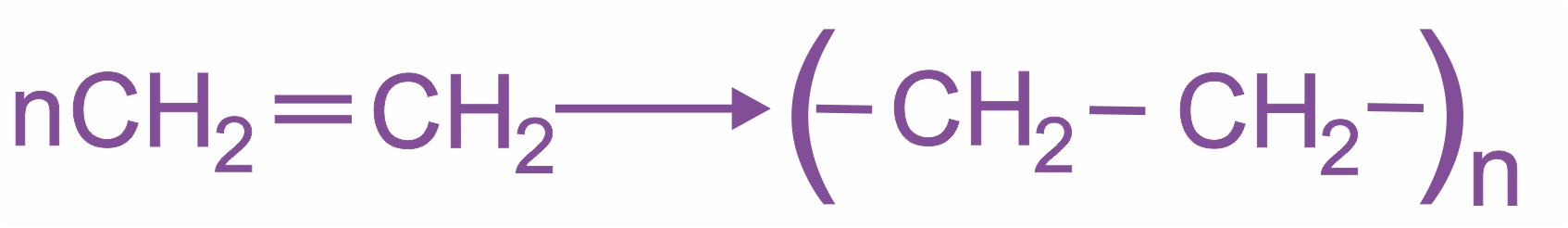Органическая химия

Тема 2.3. АЛКЕНЫ (этиленовые углеводороды, непредельные, олефины)
Общая формула гомологического ряда алкенов CnH2n.
В отличие от предельных углеводородов, алкены содержат двойную связь С=С, которая осуществляется 4 общими электронами:

![]() В образовании такой связи участвуют атомы углерода в sp2-гибридизованном состоянии:
В образовании такой связи участвуют атомы углерода в sp2-гибридизованном состоянии:
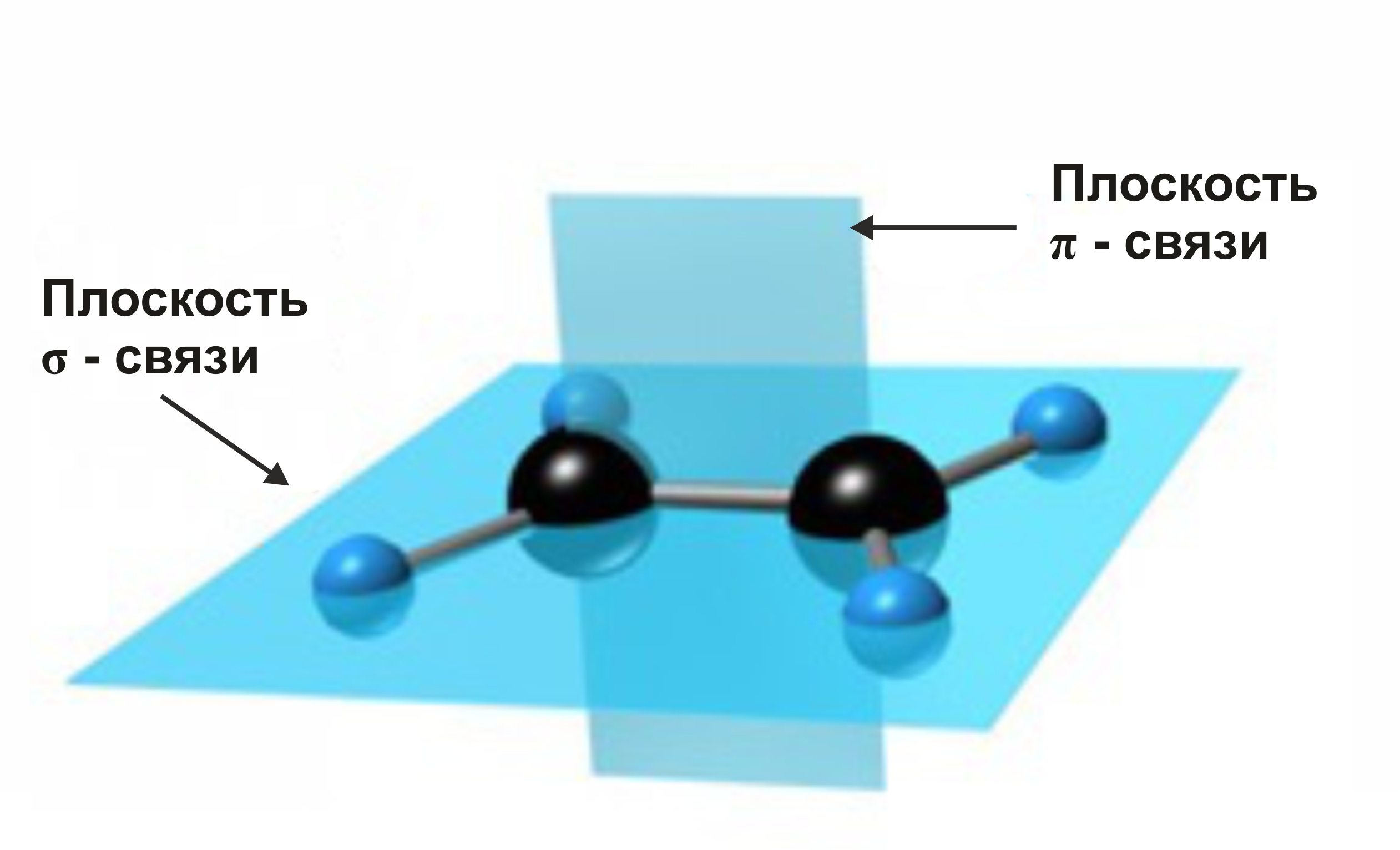
С=С σ-связь (перекрывание 2sp2-2sp2) и π-связь (2рz-2рz);
С–Н σ-связь (перекрывание 2sp2-АО углерода и 1s-АО водорода).
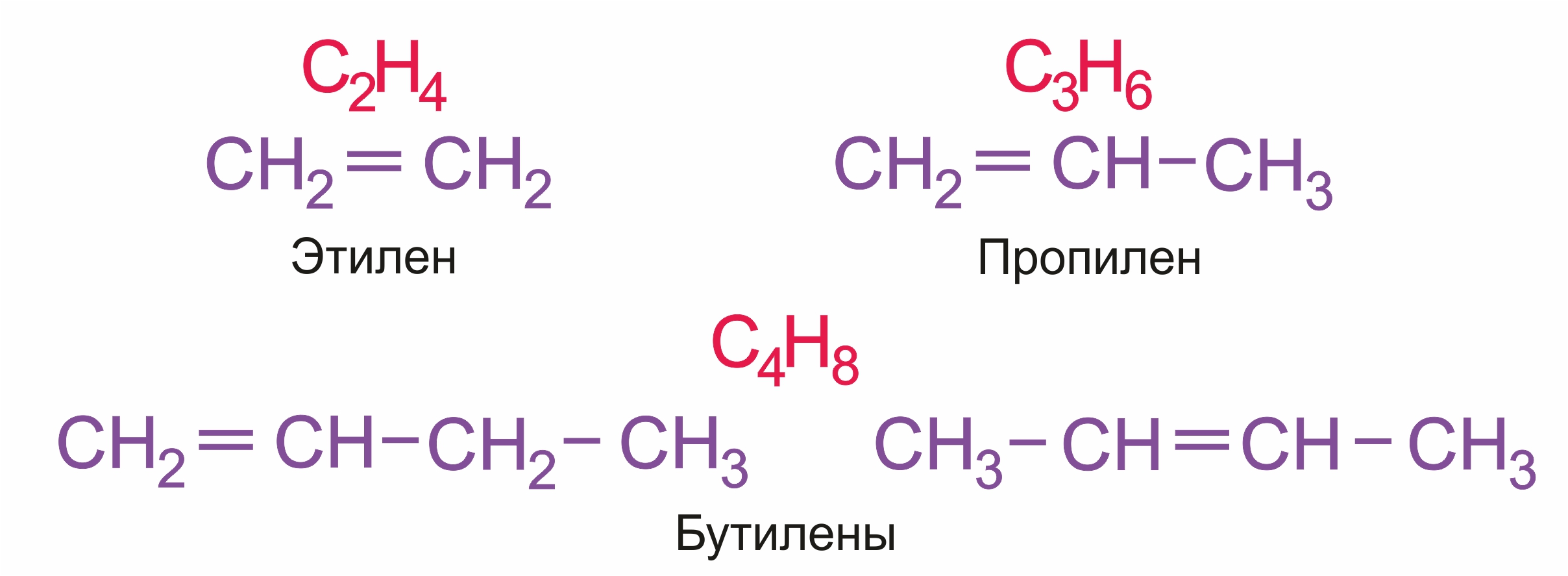
Простейшие представители:
σ-связи, образуемые sp2-гибридными орбиталями, находятся в одной плоскости под углом 120°. Поэтому молекула этилена имеет плоское строение:
Модели молекулы этилена
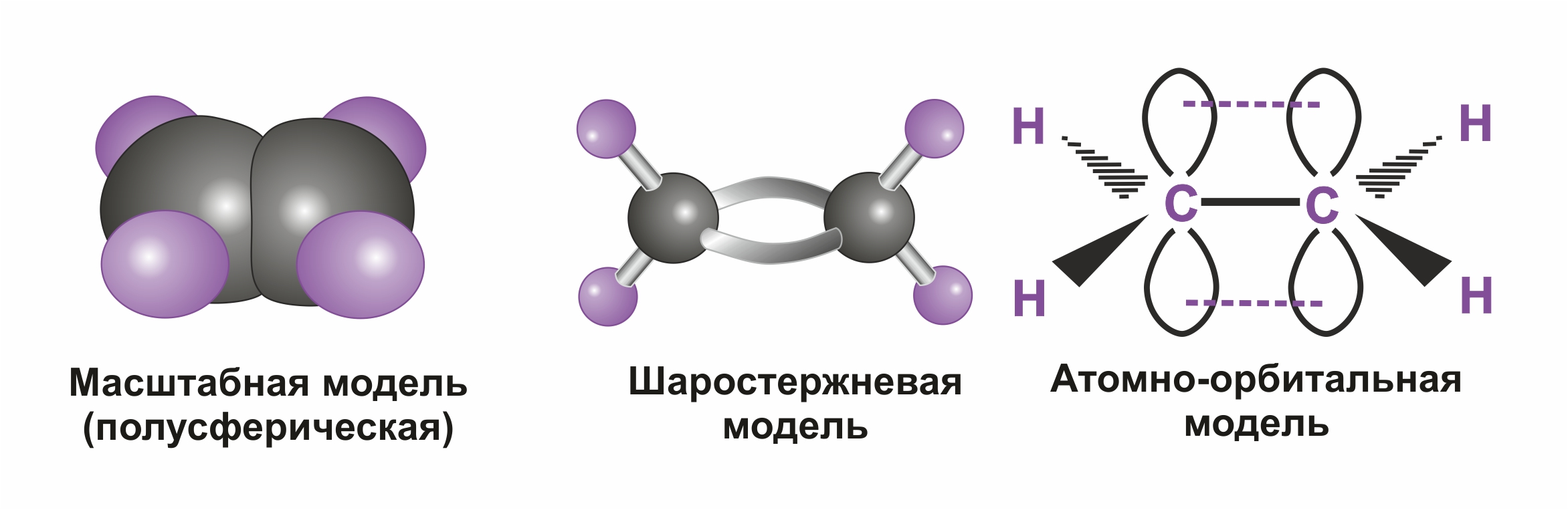
По своей природе π-связь резко отличается от σ-связи: π-связь менее прочная вследствие меньшей эффективности перекрывания р-орбиталей.
Номенклатура алкенов
По международной номенклатуре ИЮПАК названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ен:
2 атома С → этан → этен; 3 атома С → пропан → пропен и т.д. |
Главная цепь углеродных атомов выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной).
![]() Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен.
Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен.
Например:
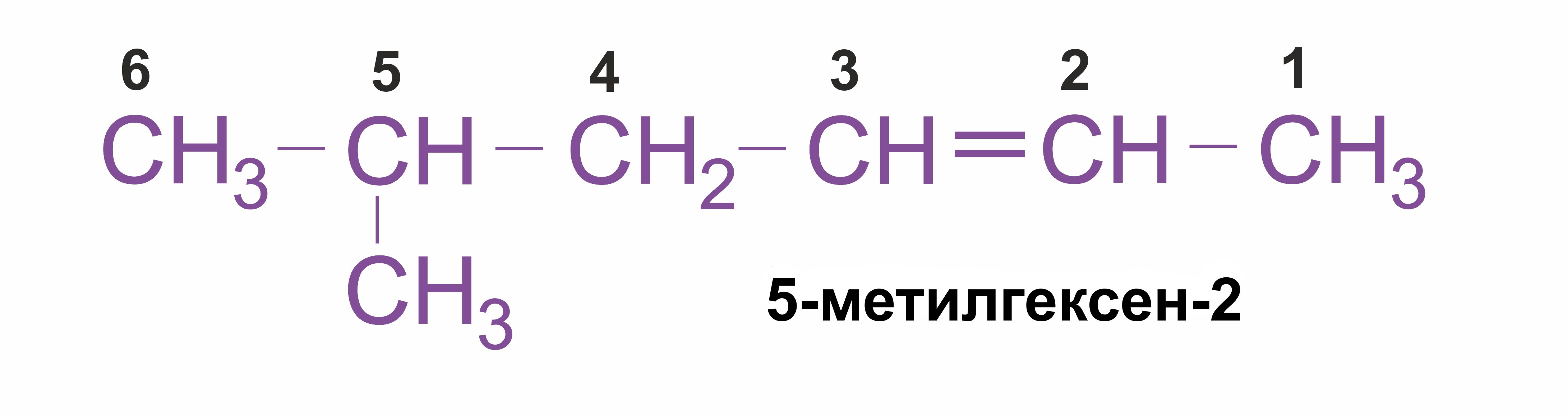
Для простейших алкенов применяются также исторически сложившиеся названия: этилен (этен), пропилен (пропен), бутилен (бутен-1), изобутилен (2-метилпропен) и т.п.
В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкенов:

Изомерия алкенов
Структурная изомерия алкенов
1. |
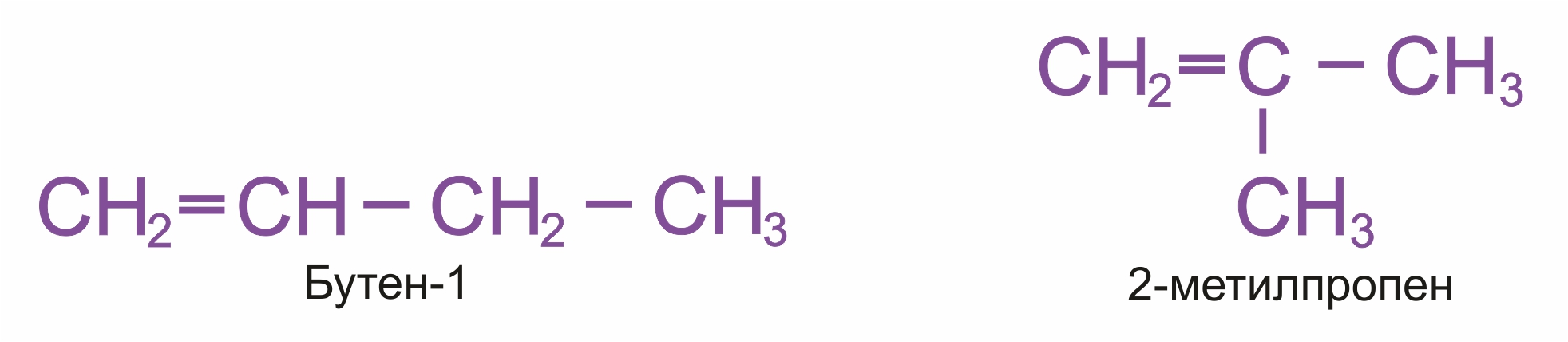
Изомерия углеродного скелета (начиная с С4Н8):
|
2. |
Изомерия положения двойной связи (начиная с С4Н8):
|
3. |
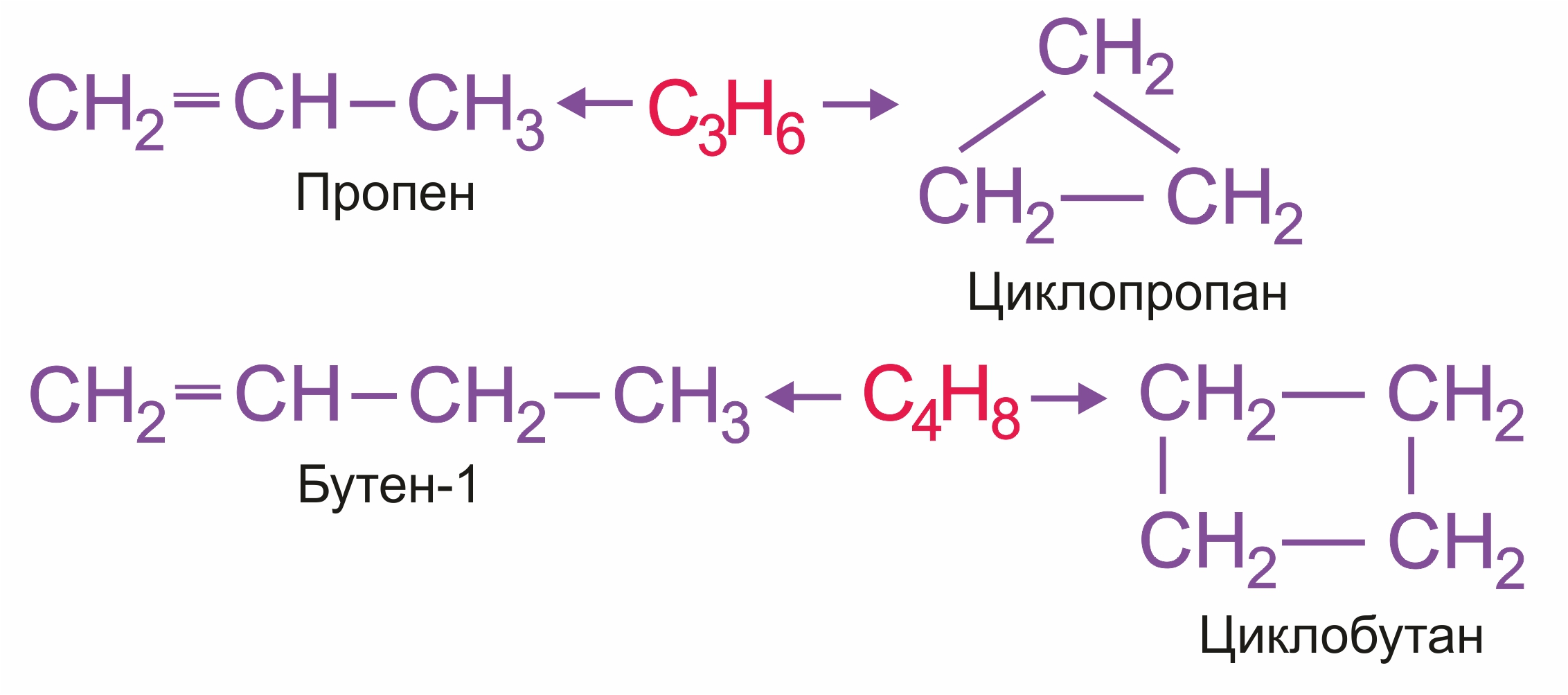
Межклассовая изомерия с циклоалканами (начиная с С3Н6):
|
Пространственная изомерия алкенов
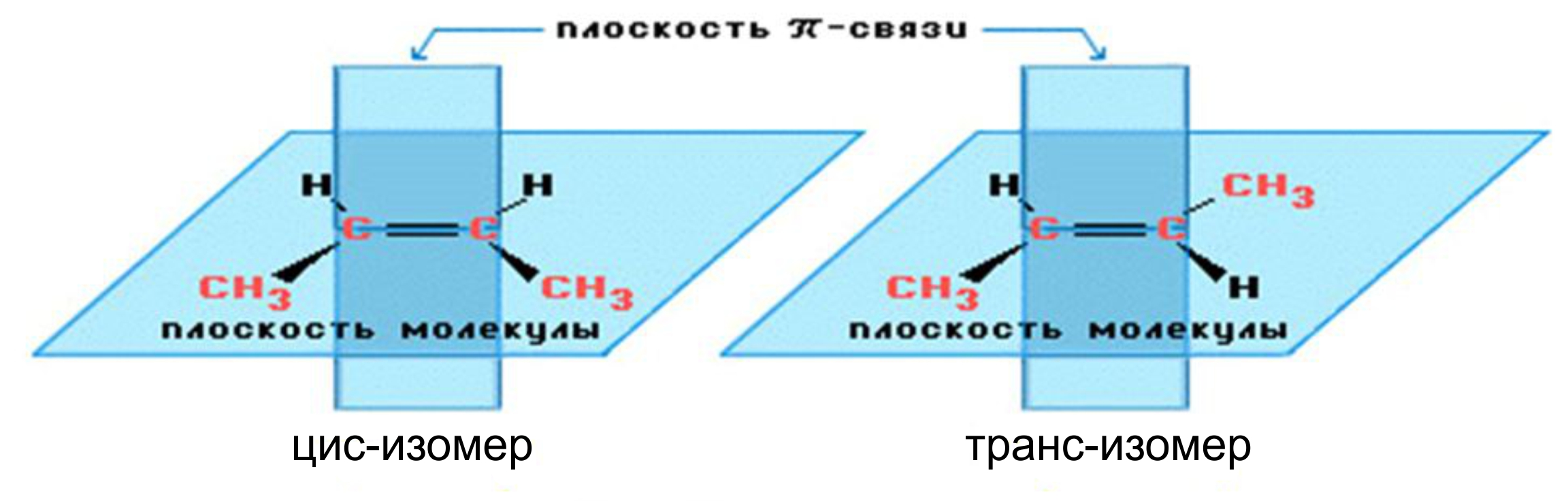
1. Цис-, транс-изомерия обусловлена наличием в молекуле двойной связи.
Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения π-связи (π-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы -СН3 могут находиться либо по одну сторону от двойной связи — это цис-изомер; либо по разные стороны — это транс-изомер:
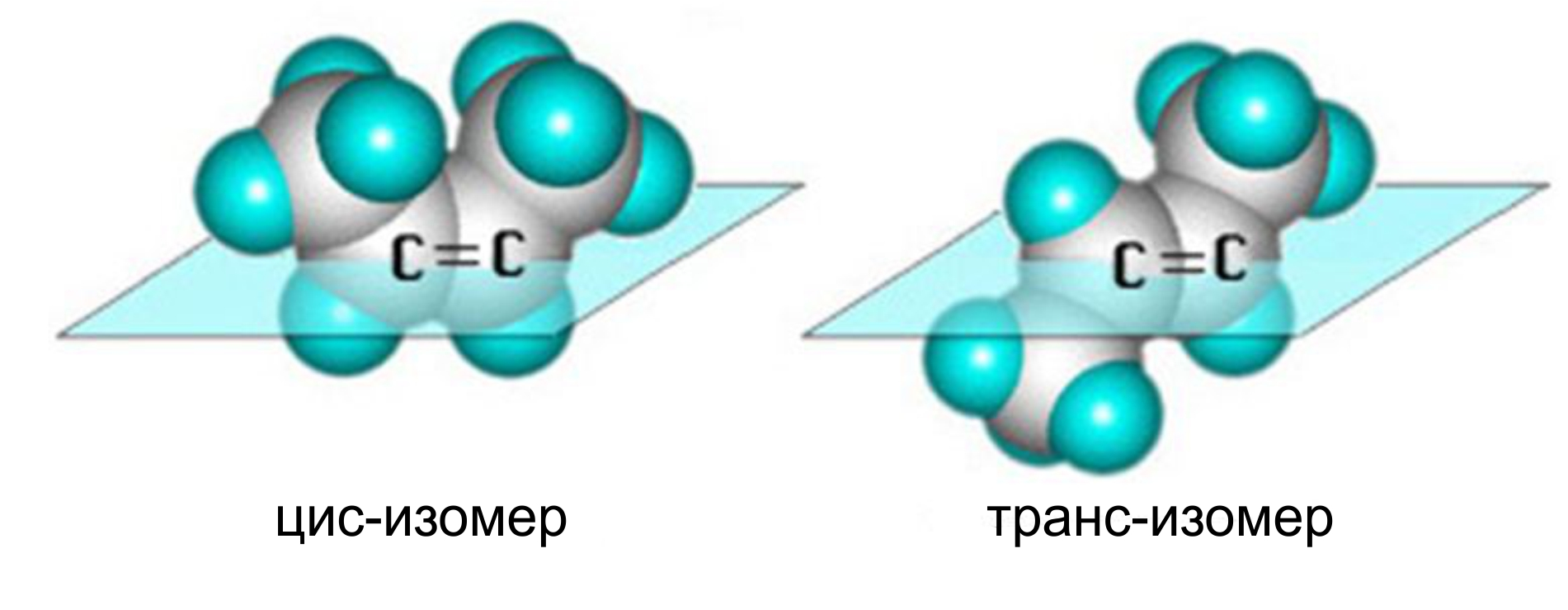
Цис-, транс-изомерия не проявляется, если хотя бы один из атомов С при двойной связи имеет 2 одинаковых заместителя.
Например, бутен-1 СН2=СН–СН2–СН3 не имеет цис- и транс-изомеров, т.к. первый атом С связан с двумя одинаковыми атомами Н.
Физические свойства алкенов
По физическим свойствам алкены мало отличаются от алканов с тем же числом атомов углерода в молекуле. Низшие гомологи С2-С4 при нормальных условиях — газы, С5-С17 — жидкости, высшие гомологи — твердые вещества. Алкены нерастворимы в воде, хорошо растворимы в органических растворителях.
1. |
Крекинг алканов Крекинг алканов является важнейшим промышленным способом получения алкенов из высококипящих фракций нефти. Под действием сильного нагревания (до 700°С) в молекулах алканов гомолитически расщепляются σ-связи С—С, при этом образуется смесь низкомолекулярных алканов и алкенов:
|
2. |
Реакции элиминирования: Эта группа реакций лежит в основе большинства способов получения алкенов. |
а) |
|
б) |
|
в) |
Дегалогенирование происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с двухвалентными металлами:
|
г) |
|
Химические свойства алкенов
Определяются наличием в их молекулах двойной связи. Электронное облако π-связи подвергается атаке электрофильными агентами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения.
1. |
При взаимодействии алкенов с галогеноводородами (НСl, НВr) образуются галогеналканы, причем если исходный алкен несимметричен, то реакция протекает по правилу Марковникова:
|
2. |
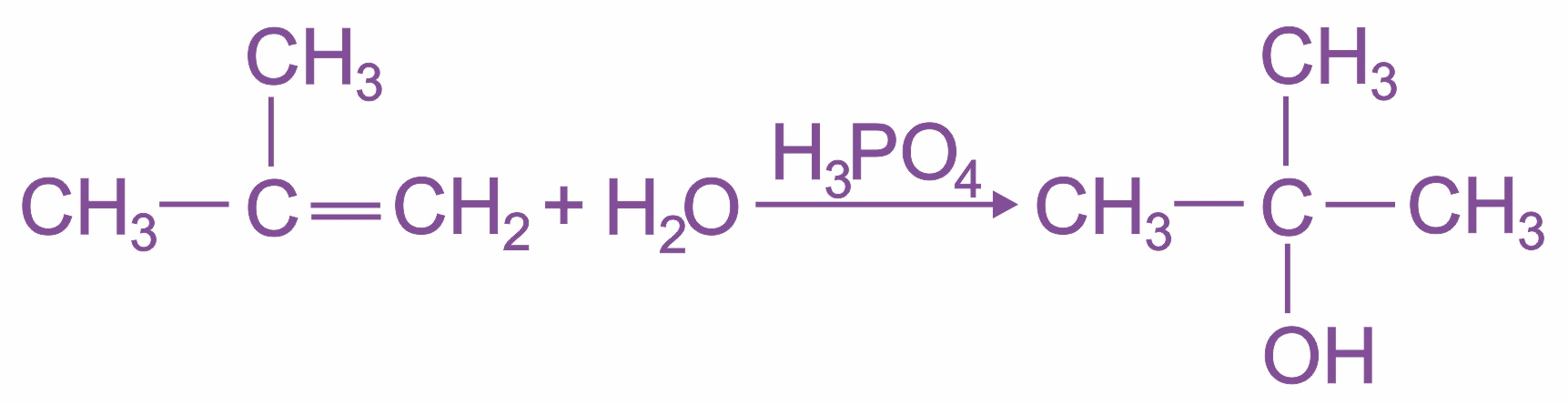
При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Присоединение воды идет по правилу Марковникова:
|
3. |
При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь:
|
4. |
При окислении алкенов перманганатом калия КMnO4 в нейтральной или щелочной среде окрашенный раствор перманганата калия быстро обесцвечивается (буреет). Эта реакция также является качественной на двойную связь (реакция Вагнера):
|
При окислении перманганатом калия в кислой среде или хромовой смесью происходит полный разрыв двойной связи с образованием карбоновых кислот:
|
|
5. |
Восстановление (гидрирование) Эта реакция протекает в присутствии катализатора — мелко раздробленного никеля, платины или палладия — при комнатной температуре:
|
6. |
Реакции полимеризации:
|
7. |
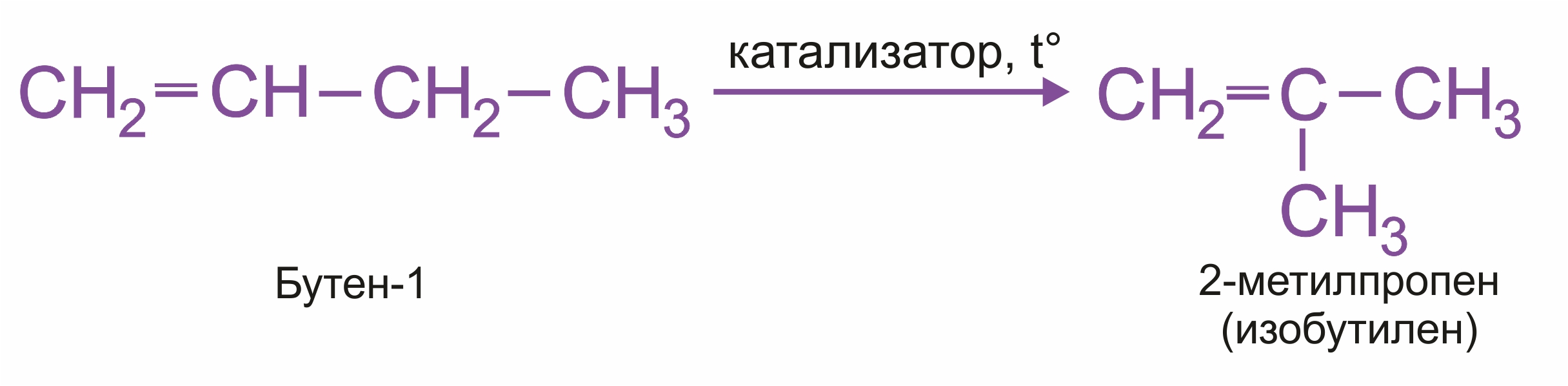
Изомеризация алкенов. Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3). Изомеризация алкенов приводит или к перемещению π–связи:
или к перестройке углеродного скелета:
|
Применение алкенов
Этилен применяется для получения этилового спирта, полиэтилена, политетрафторэтилена (тефлона), уксусного альдегида, галогенопроизводных и многих других органических соединений. Он ускоряет созревание плодов (помидоров, цитрусовых и др.) при введении небольших количеств его в воздух теплиц. Этилен и его гомологи используются как химическое сырье для синтеза полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.