Экологический мониторинг и экологическая экспертиза

Приложение 18. ПЕРМАНГАНАТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ |
Перманганатометрическое титрование – метод анализа, в котором титрантом служит раствор перманганата калия.
В процессе титрования анализируемого раствора малиново-фиолетовая окраска раствора перманганата обесцвечивается. После достижения точки эквивалентности избыточная капля раствора перманганата окрашивает титруемую жидкость в розовый цвет.
Индикатором в данном случае является перманганат калия. Поэтому при перманганатометрических определениях посторонние индикаторы не добавляют.
Перманганат калия проявляет окислительные свойства и в кислой, и в щелочной (или нейтральной) среде. При титровании кислых растворов
Mn (VII), входящий в состав KMnO4, восстанавливается до бесцветных катионов Mn2+.
Например:
10 FeSO4 + 2KMnO4 + 8H2SO4 = 5 Fe2(SO4)3 + 2 MnSO4 + K2SO4+ 8H2OI
2│1│ MnO4– + 8H+ + 5е– → Mn2+ + 4H2O
10│5│ Fe2+ – е– → Fe3+
При титровании в щелочной или нейтральной среде Mn (VII) восстанавливается только до Mn (IV),. например:
Cr2(SО4)3 + 2КMnО4 + 8КОН = 2MnО(ОН)2↓ + 2К2CrО4 + 3К2SО4 + 2Н2О.
Cr3+ + 8ОН– – 3е– → CrО42– + 4Н2О
MnO4– + 3Н2О + 3е– → MnО(ОН)2 + 4ОН–
Образующийся MnО(ОН)2 представляет собой бурый осадок, присутствие которого затрудняет определение точки эквивалентности.
Титрование перманганатом калия чаще проводят в кислых средах.
Перманганатометрию используют для количественного определения не только восстановителей, но и окислителей. Восстановители определяют прямым титрованием раствором перманганата. Определяя окислители, пользуются приемом обратного титрования, т.е. к анализируемому раствору окислителя приливают заведомый избыток вспомогательного раствора восстановителя с известной концентрацией, затем остаток восстановителя оттитровывают раствором перманганата калия и делают расчет.
В кислой среде каждая молекула КMnО4 приобретает 5 электронов.
Следовательно молярная масса эквивалента КMnО4 равна 1/5 молярной массы, т.е. 158,03 : 5 = 31,61 г/моль, т.е. для КMnО4 окислителя нужно молярную массу его разделить на число электронов, теряемых одной молекулой вещества в рассматриваемой реакции.
В щелочной среде или в нейтральной она составит 1/3 молярной массы, т.е. 158,03 : 3 = 52,67 г/моль, т.к в щелочном растворе каждая молекула КMnО4 приобретает только три электрона. Молярные массы эквивалентов восстановителей находят делением молярной массы на число электронов, теряемых одной молекулой вещества в реакции.
Так, молярная масса эквивалента сульфата железа (II) равна молярной массе (151,92 г/моль), а сульфата хрома (III) составляет 1/6 молярной массы: 392,22 : 6 =65, 37 г/моль.
Для определения окисляемости воды нужно приготовить 0,01 н. раствор перманганата калия (КМnО4), В кислой среде молярная масса эквивалента КMnО4 равна 1/5 молярной массы, т.е. 158,03 : 5 = 31,61 г/моль.
Для 1 л 0,01 н. раствора перманганата калия нужно взять 31,61 × 0,01 × 1,0 = 0,316 г КМnО4.
Навеску растворяют следующим образом. Приливают в стакан с навеской небольшие порции горячей воды, время от времени сливая жидкость с кристаллов в специально приготовленную склянку. Растворение ускоряют путем непрерывного перемешивания. Когда вся навеска перейдет в раствор, приливают к нему оставшуюся воду, тщательно перемешивают, закрывают пробкой, оборачивают черной бумагой.
Через 5 дней раствор, титр которого станет постоянным, осторожно сливают сифоном с осадка в другую склянку. Оттитровывают для установления точного титра.
Параллельно определяют и вычисляют сходимость результатов (Р,%), т.е. качество измерений, отражающих близость друг к другу результатов, полученных в одинаковых условиях, по формуле
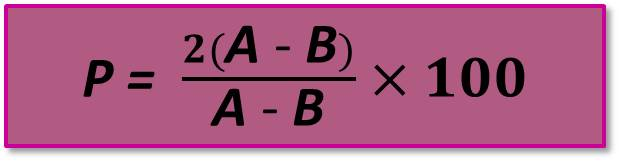 ,
,
где А и В – соответственно больший и меньший результат из двух параллельных определений.
Для большинства макрокомпонентов, содержание которых в воде более 10 мг/л, рекомендуется значение сходимости до 10%, с содержанием от 10 до 1 мг/л – 10-15%, от 1 до 0,01 мг/л – 15-25%, менее 0,01 мг/л – 30%.

к разделу 5 тема 2 работа 3.7.
