Экологический мониторинг и экологическая экспертиза

1.1. Классы и категории опасности загрязняющих веществ
Все вещества делятся на четыре класса опасности по степени влияния на окружающую природную среду.
Первый класс
Чрезвычайно опасные, обладающие очень высокой степенью вредного воздействия на окружающую природную среду (ОПС); критерием первого класса является необратимое нарушение экологической системы (период восстановления отсутствует). Из выбрасываемых предприятием веществ к нему относят бенз(а)пирен и свинец.
Бенз(а)пирен обладает высокой активностью и считается индикатором загрязнения окружающей среды различными полициклическими ароматическими углеводородами. Источником загрязнения бенз(а)пиреном считается автомобильный транспорт (сажа и выхлопные газы).
Тяжелые металлы химические элементы (более 40) с массой атома свыше 50 атомных единиц. Понятие «тяжелые металлы» во многом совпадает с понятием «микроэлементы», но включает и отдельные элементы повышенных концентраций.
К тяжелым металлам относятся свинец, цинк, кадмий, ртуть, молибден, марганец, никель, олово, кобальт, титан, медь, ванадий. Термин «тяжелые металлы» заменил устаревший термин «токсические элементы», поскольку степень токсичности зависит от концентраций веществ и условий окружающей среды.
Свинец (Pb) обладает химическими свойствами металлов. Распространенный элемент земной коры. Входит в состав полиметаллических руд, т.е. руд, содержащих несколько металлов.
Второй класс
Высокоопасные, обладающие высокой степенью воздействия на окружающую природную среду (вызывают сильное нарушение экологической системы: период восстановления – не менее 30 лет после полного устранения источника вредного воздействия). Из выбрасываемых предприятием веществ к нему относят марганец и его соединения, серную кислоту, сероводород, фтористый водород.
Марганец (Mn) – серебристо-белый твердый тугоплавкий металл. Он не окисляется на воздухе даже при нагревании, что объясняется образованием защитной пленки Mn2O3. Не реагируя с газообразным водородом и кислородом, марганец при повышенных температурах взаимодействует с галогенами.
Наибольшей устойчивостью в обычных условиях обладают соединения Mn (II). Единственный устойчивый в водных растворах катион марганца [Mn(OH2)6]2+ имеет, как и Cr (III), электронную конфигурацию d5 и является неискаженным октаэдром.
Аквакомплекс [Mn(OH2)6]2+ входит во многие кристаллогидраты, выпадающие из растворов хорошо растворимых солей:
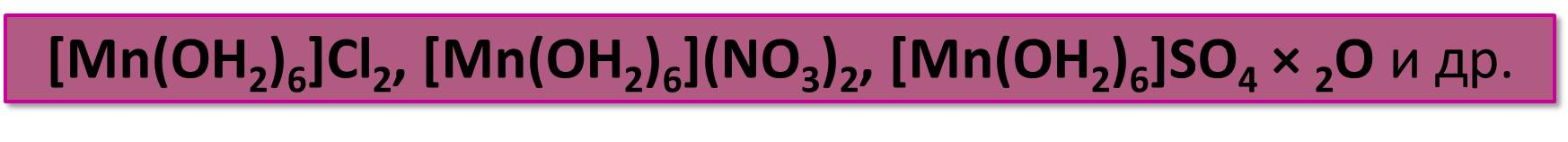
Из растворов этих солей под действием соответствующих анионов выпадают малорастворимые соли, содержащие Mn2+: белые карбонад MnCO3, ортофосфаты Mn3(PO4)3 и NH4MnPO4, телесного цвета сульфид MnS.
Марганец входит в состав многих металлоферментов растений и животных. Например, дегидрогеназы изолимонной и яблочной кислот, а также декарбоксилаза пировиноградной кислоты являются ферментами, без которых не может работать цикл Кребса, вырабатывающий энергию и запасающий ее в аденозинтрифосфате (АТФ).
Марганец присутствует в большинстве почв.
Обычно его содержание колеблется в пределах 20-200 мг/кг. В основном он присутствует в виде смешанных оксидов Mn2+, Mn3+ и Mn4+. Чаще других соединений марганца в почвах находят пиролюзит MnO2. Недостаток марганца в почве проявляется в заболеваниях растений, связанных с замедлением работы цикла Кребса. В качестве марганцевого микроудобрения используют MnSO4 × 4H2O.
Серная кислота (H2SO4) безводная представляет собой бесцветную вязкую маслянистую жидкость с высокой плотностью (p = 1,84 г/см3) и температурой плавления +16°С. Она подвергается автоионизации:

Обычно используют не безводную, а концентрированную серную кислоту. Концентрированная H2SO4, применяемая в промышленности и лабораторной практике, содержит 5-7,5% H2O; реактивная серная кислота содержит ~95% H2SO4, выпускаемая для технических нужд – 92,5%; безводная H2SO4 имеет название «моногидрит» и отвечает составу SO3 × H2O.
Фтороводород (НF) в обычных условиях представляет собой очень ядовитый бесцветный газ со сравнительно слабым запахом. Газообразный, жидкий и твердый фтороводород ассоциирован за счет образования водородных связей. Энергия водородных связей в HF выше, чем в H2O и NH3, и составляет около 40 кДж/моль. Из-за образования водородных связей HF имеет высокие температуры кипения (+20°С) и плавления (-83°С).
Третий класс
Умеренно опасные, обладающие средней степенью вредного воздействия на окружающую природную среду (вызывают нарушения экологической системы: период восстановления – не менее 10 лет после снижения вредного воздействия от существующего источника).
К нему относят оксид железа, оксид олова, оксид азота, сажу, взвешенные вещества, пыль неорганическую с содержанием двуокиси кремния ниже 20%, диоксид азота, сернистый ангидрид и пыль неорганическую с содержанием двуокиси кремния от 20 до 70%.
Железо (Fe) по распространенности в земной коре (4,65%) занимает четвертое место, уступая лишь кислороду, кремнию и алюминию. Многочисленны минералы железа – их более 300. Некоторые из них образуют гигантские месторождения.
Химически чистое железо – блестящий серебристо-белый, мягкий и ковкий металл.
Наибольшей устойчивостью в обычных условиях обладают соединения Fe (III), несколько меньшей – Fe (II). Устойчивость степеней окисления железа сильно зависит от природы координированных им лигандов. На этом основано действие многих железосодержащих ферментов и молекул – переносчиков кислорода.
В аквакомплексе [Fe(OH2)6]2+ атом железа имеет электронную конфигурацию d6.
Этот комплекс содержится в кристаллогидратах многих солей Fe2+, имеющих светло-зеленую окраску различных оттенков:
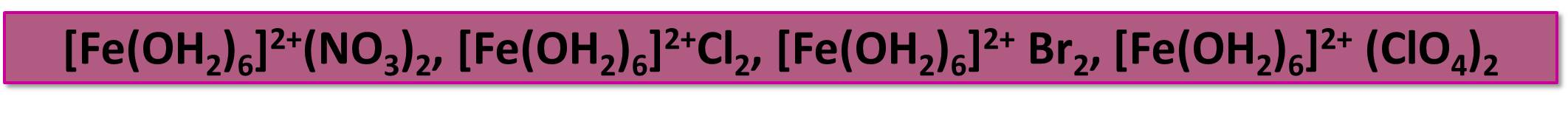
Устойчивый в водных растворах катион Fe2+ образует комплексы со многими моно, -би- и полидентатными лигандами. Он способен также координировать донорные группы многих аминокислот.
Оксиды азота (NO и NO2), как и SO2, относятся к основным загрязнителям атмосферы. Они вызывают как локальные, так и глобальные изменения в окружающей среде. Концентрация этих газов в чистом воздухе невелика.
Монооксид азота NO присутствует в воздухе лишь в следовых количествах. Масса указанных газов в атмосфере соответственно составляет 0,013×10-9 и 0,005×10-9т.
Монооксид NO и диоксид NO2 азота в экологической литературе часто обозначают общей формулой NOХ. В несколько большем количестве по сравнению с NO и NO2 в воздухе содержится оксид диазота N2O.
Его концентрация равна 0,5 млн-1 (5×10-5 об.%), а масса – 2109 т.
Основным антропогенным источником оксидов азота (NO и NO2) являются процессы высокотемпературного сгорания различных видов топлива (природного газа, угля, бензина, мазута) на тепловых электростанциях, промышленных установках и в автомобильных двигателях. Примерно 90% всех выбросов оксидов азота в атмосферу связаны с сжиганием топлива, в процессе которого протекают реакции двух типов:
1) реакция между O2 воздуха и азотом, содержащимся в топливе;
2) реакция между O2 воздуха и азотом, содержащимся в воздухе.
Ответственность за поступление оксидов азота в атмосферу несут и некоторые отрасли химической промышленности, в частности производители азотной кислоты («лисьи хвосты» над трубами), серной кислоты нитрозным методом, взрывчатых веществ.
Поступление оксидов азота происходит и в других процессах нитрования, при очистке металлов азотной кислотой, а также при ядерных взрывах.
На долю химической промышленности приходится около 5% выбросов NOх. Антропогенные источники выделяют до 60 млн т оксидов азота в год ( в пересчете на NO2).
Пыль – совокупность взвешенных в атмосфере мелких (10–2-10–4см) твердых частиц, способных, в отличие от дыма, оседать в безветренную погоду.
Борьба с производственной пылью – важная составная часть охраны окружающей среды от загрязнения.
Сажа – конгломерат углерода с водородом, выделяющийся при горении топлива и уносимый из топок с уходящими газами, главным образом в виде мельчайших частиц.
Четвертый класс
Малоопасные, обладающие низкой степенью вредного воздействия на окружающую природную среду (вызывают нарушения экологической системы: период самовосстановления – не менее 3 лет). К нему относят бензин, углеводороды предельные С12-19 и оксид углерода.
Оксид углерода (II) – CO. Этот газ, называемый также монооксидом углерода, или угарным газом, относится к основным загрязнителям воздуха. В незагрязненном воздухе содержание CO невелико и составляет всего 0,05-0,1 млн-1, но по массе его больше, чем таких загрязнителей, как NO, NO2, SO2.
Содержание CO в атмосфере составляет 6×108 т.
СО – бесцветный, не имеющий запаха газ, поэтому его трудно обнаружить органами чувств. Он вдыхается вместе с воздухом или табачным дымом и, поступая в кровь, конкурирует с кислородом за молекулы гемоглобина.
Гемоглобин представляет собой железосодержащий белок, присутствующий в эритроцитах крови и переносящий кислород из легких к клеткам тканей организма, а углекислый газ – из клеток организма обратно в легкие. Эта нормальная картина переноса нарушается, когда во вдыхаемом воздухе присутствует СО.
Молекулы оксида углерода (II) присоединяются к гемоглобину в 210 раз легче, чем кислород. Чем больше оксида углерода (II) содержится в воздухе, тем больше гемоглобина, прочно связанного с ним и по этой причине не способного переносить кислород.
Существуют два оксида углерода: монооксид (оксид углерода (II), или угарный газ) СО и диоксид (оксид углерода (IV), или углекислый газ) СО2.
Оксид углерода (IV) имеет линейные молекулы О = С = О с двумя σ- и двумя π-связями, валентные орбитали атома углерода в них проявляют sp-гибридизацию.
Диоксид углерода при обычных условиях – бесцветный газ, без запаха, со слабым кисловатым вкусом. При охлаждении под давлением СО2 сжижается. Испарение жидкого СО2 приводит к охлаждению и образованию твердого диоксида, известного под названием «сухой лед».
При –78°С твердый СО2 сублимирует без плавления. Получение в лабораторных условиях осуществляют по реакции
 .
.
В промышленности СО2 получается обжигом известняка:
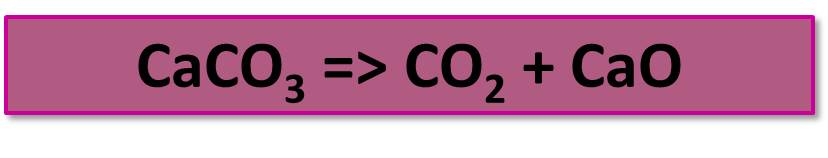 .
.
Являясь высшим оксидом углерода, СО2 проявляет слабые окислительные свойства. Как окислитель, он взаимодействует только с очень сильными восстановителями, например, в его атмосфере может гореть магний:
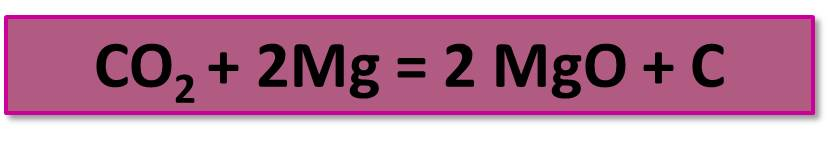 .
.
Одновременно с делением на классы все вредные вещества, выбрасываемые предприятием, делят на 4 категории опасности в зависимости от вредного влияния на окружающую среду и внутренней классификации веществ в томе ПДВ предприятия по программе «Эра»:
– первая категория – чрезвычайно опасные вещества;
– вторая категория – высокоопасные вещества;
– третья категория – умеренно опасные вещества;
– четвертая категория – практически неопасные вещества.
Из выбрасываемых предприятием веществ к третьей категории относят оксид железа, марганец и его соединения, оксид азота, сажу, бенз(а)пирен, пыль абразивную, диоксид азота, сернистый ангидрид, оксид углерода, пыль неорганическую с содержанием двуокиси кремния 20-70%.
Азот – бесцветный газ без запаха и вкуса, имеющий несколько меньшую плотность, чем воздух, мало растворимый в воде.
Существует пять оксидов азота со степенями окисления азота +1, +2, +3, +4 и +5. Азот в этих соединениях имеет или sp- , или sp2-гибридизацию. Некоторые оксиды имеют кратные или полукратные связи азота с кислородом, энергия этих связей возрастает с их кратностью.
Оксид азота (I) N2O (закись азота, веселящий газ ) – бесцветный газ со сладковатым вкусом, вызывающий при малых дозах смех, а при больших – наркологическое действие и анестезию, его используют в медицине. N2O – один из продуктов денитрификации почвенного азота.
В атмосферный воздух в процессе производства выбрасываются загрязняющие вещества четырех классов опасности через организованные и неорганизованные источники выбросов. При оценке территории большое значение имеют расположение данной местности и роза ветров, которая оказывает влияние на способность территории к ее самоочищению.
Например, основными источниками выбросов керамического завода являются литейное производство, обжиговые печи, массозаготовительное отделение, работа автотранспорта (табл. 1.1).
Организованными источники выбросов являются выбросы вредных веществ через трубы, вытяжные системы.
Неорганизованными источники выбросов являются выбросы через неплотности строений, открывающиеся ворота, выбросы движущегося автотранспорта.
Таблица 1.1 - Источники выбросов керамического завода
Основное производство |
Наименование источников выбросов |
Литейное |
Труба |
Обжиговые печи |
Неорганизованный |
Склад сыпучих материалов |
Неорганизованный |
Массозаготовительное отделение |
Труба |
Аккумуляторная |
Труба |
Котельная |
Труба |
Мехцех |
Неорганизованный |
Гипсолитейный участок |
Неорганизованный |
Открытый склад |
Неорганизованный |
Боксовая стоянка автодорожных машин |
Неорганизованный |
Маневрирование по территории |
Неорганизованный |
Работа автотранспорта |
Неорганизованный |
Бульдозера |
Неорганизованный |
Работа дорожных машин |
Неорганизованный |
