Экологический мониторинг и экологическая экспертиза

Работа 8. Анализ водной вытяжки
Метод водной вытяжки заключается в кратковременной обработке почвы водой и последующей фильтрации жидкости. Он дает качественное представление о составе почвенного раствора и его концентрации.
Для приготовления водной вытяжки берется навеска воздушно-сухой почвы, прошедшей через сито с размером ячеек 1 мм.
Отношение между количеством почвы и воды – 1:5, время взаимодействия воды с почвой – 3 мин.

На технических весах взвешивают 100 г воздушно-сухой почвы, просеянной через сито.
Навеску переносят в литровую колбу и обливают пятикратным количеством (500 мл) дистиллированной воды. Взбалтывают содержимое в течение 3 мин и фильтруют через двойной фильтр.
Чтобы коллоидная муть не проходила через фильтр, на него следует наливать не отстоявшуюся вытяжку, а вместе с почвой, так как слой почвы на фильтре задерживает коллоидные минеральные частицы.
Первые мутные порции фильтрата необходимо снова вылить на фильтр. Для анализа собирают только прозрачный фильтрат.
Определение общей суммы водорастворимых веществ (сухой остаток)

Берут пипеткой 50 мл водной вытяжки, переносят в высушенную и взвешенную на аналитических весах фарфоровую чашку.
Взятый объем вытяжки выпаривают досуха на водяной бане.
Чашку снаружи протирают, а затем сушат в сушильном шкафу при 105°С в течение 3 ч.
Чашку с остатками охлаждают в эксикаторе и взвешивают на аналитических весах.
Вычисляют сухой остаток в процентах:
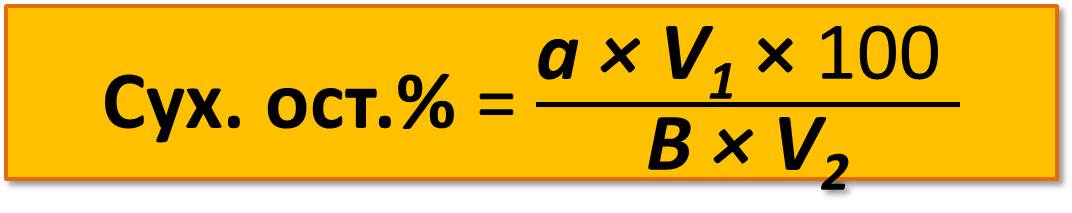 ,
,
где а – масса сухого остатка, г;
V1 – бщее количество воды, взятой для приготовления водной вытяжки, мл;
100 – коэффициент перевода в проценты;
V2 – объем вытяжки, взятой для выпаривания, мл;
В – навеска почвы, г.
Определение общей щелочности
Определяют общую щелочность титрованием водной вытяжки 0,02 н. раствором Н2SО4 в присутствии метилоранжа.

По 25 мл водной вытяжки пипеткой переносят в две колбочки.
Приливают в каждую по 2 капли метилоранжа. Титруют вытяжку в одной колбочке 0,02 н. раствором Н2SО4 до слабо-розового окрашивания.
Изменение окраски из желтой (в нейтральной и слабощелочной среде) в слабо-розовую (в кислой среде) трудноуловимо, поэтому для более точного титрования берут вторую колбочку, которая служит для сравнения изменения окраски титруемой жидкости (свидетель).
Обе колбочки ставят на лист белой бумаги. Следят за изменением окраски в колбочке, в которую приливают кислоту. Как только жидкость в ней слегка порозовеет, титрование заканчивают.
Общую щелочность вычисляют в миллиграмм-эквивалентах НСО3 на 100 г почвы и в процентах. Содержание НСО3– в миллиграмм-эквивалентах вычисляют по формуле
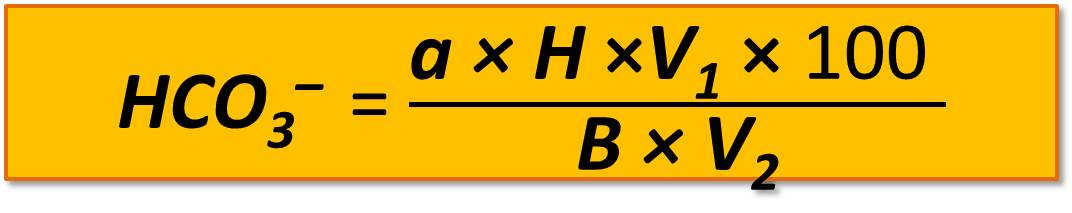 ,
,
где а – количество H2SO4, пошедшее на определение, мл;
Н – нормальность раствора;
V1 – общее количество воды, взятой для приготовления водной вытяжки, мл;
100 – коэффициент пересчета на 100 г почвы;
V2 – объем вытяжки, взятой для титрования, мл;
В – навеска почвы, г.
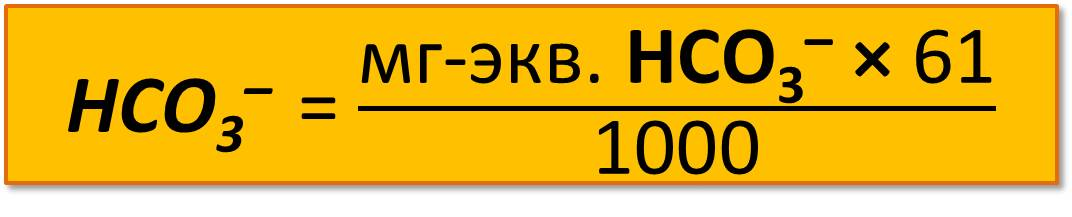
Содержание НСО3– в процентах определяют по формуле
 ,
,
где 61 – эквивалентная масса НСО3;
1000 – коэффициент пересчета в граммы.
Определение хлор-иона
Определяют хлор-ион титрованием водной вытяжки 0,01н. раствором АgNO3 в присутствии индикатора – 10%-го раствора К2СrО4.

В колбочку, в которой определяли щелочность, прибавляют 1мл 10%-го раствора K2CrO4.
Титруют 0,01н. раствором АgNO3 до появления красноватой окраски. Реакция идет по уравнению
 .
.
При этом выпадает осадок AgCl белого цвета. Когда весь хлор будет связан с серебром, последнее вступает в реакцию с К2СrО4:
 .
.
Хромово-кислое серебро дает осадок красноватого цвета, появление которого определяет конец титрования. Количество хлор-иона в миллиграмм- эквивалентах вычисляют по формуле
 ,
,
где а – количество титрованного раствора AgNO3, пошедшего на определение, мл;
Н – нормальность раствора;
V1 – общее количество воды, взятой для приготовления водной вытяжки, мл;
V2 – объем вытяжки, взятой для титрования, мл;
В – навеска почвы, г;
100 – коэффициент пересчета на 100 г почвы.
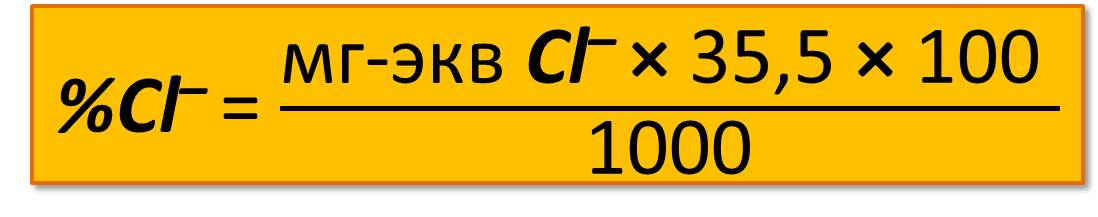
Содержание хлор-иона в процентах вычисляют по формуле
 ,
,
где 35,5 – эквивалентная масса хлора;
1000 – коэффициент пересчета в граммы.
Определение сульфат-иона
Сульфат-ион осаждается из раствора хлористым барием в форме сульфата бария.
Реакция идет по уравнению

Перед количественным определением сульфат-иона проводят качественную пробу на его наличие в водной вытяжке.
Для этого в пробирку наливают 5 мл водной вытяжки, прибавляют 2 капли 10%-й соляной кислоты и 1 мл 10%-го раствора хлористого бария, нагревают до кипения.
Если в почвенном растворе есть сульфаты, то выпадает осадок, и тогда необходимо их количественное определение. Для этого 50 мл водной вытяжки помещают в стакан объемом 100 мл. Добавляют 1-2 мл 10%-го раствора соляной кислоты и доводят до кипения. В кипящий раствор приливают 10 мл кипящего 10%-го раствора ВаСl2.
Кипятят 3-5 мин, затем оставляют в теплом месте на 15-18 ч.
Раствор фильтруют через плотный фильтр, перенося на него осадок лишь в конце фильтрования.
Осадок на фильтре и стакан тщательно промывают кипящей дистиллированной водой до полного удаления бария (проба с 5%-й серной кислотой). Осадок с фильтром необходимо подсушить и перенести в маленький, прокаленный и взвешенный тигель. Прокаливают в муфеле при температуре 600°С до постоянной массы.
Тигель с осадком охлаждают в эксикаторе и взвешивают.
 ,
,
где а – масса осадка ВаSO4, г;
V1 – общее количество воды, взятой для приготовления водной вытяжки, мл;
0,4114 – коэффициент перевода ВаSO4 в SO4;
В – навеска почвы, г;
V2 – объем вытяжки, взятой для определения сульфатов, мл;
100 – коэффициент пересчета в проценты.
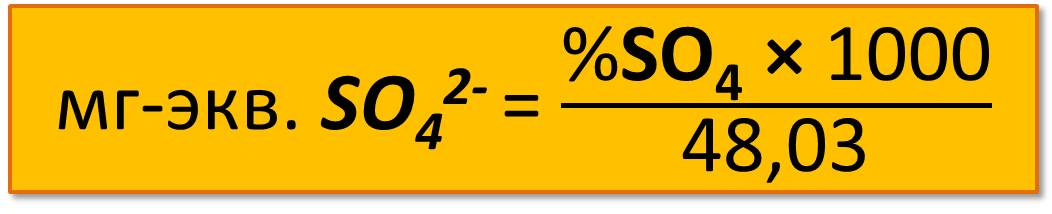 ,
,
где 48,03 – эквивалентная масса сульфата-иона;
1000 – коэффициент пересчета в миллиграммы.
Определение суммы кальция и магния
С помощью трилона Б определяют сумму кальция и магния, затем один кальций, что дает возможность вычислить содержание магния по разности.

В колбочку пипеткой приливают 50 мл водной вытяжки.
Добавляют из бюретки 5 мл хлоридно-аммиачного буфера и 15 капель индикатора хромогена черного.
Раствор окрасится в вишнево-красный цвет.
Титруют 0,05 н. раствором трилона Б до появления синей окраски. При титровании раствор необходимо постоянно перемешивать. Вишнево-красный цвет жидкости вблизи эквивалентности приобретает лиловую окраску, после чего титруют медленно. Содержание Са и Мg в миллиграмм-эквивалентах вычисляют по формуле
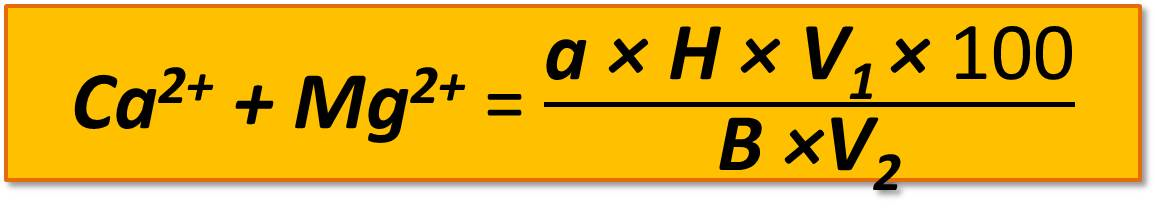 ,
,
где а – количество трилона Б, пошедшего на титрование, мл;
Н – нормальность трилона Б;
V1 – общее количество воды для приготовления водной вытяжки, мл;
V2 – объем вытяжки, взятой для титрования, мл;
В – навеска почвы, г;
100 – коэффициент пересчета на 100 г почвы.
Определение кальция
В колбочку пипеткой приливают 50 мл водной вытяжки.
Добавляют 2 мл 10%-го раствора NаОН (для доведения рН раствора до 12) и всыпают лопаточкой мурексид. Раствор окрашивается в малиновый цвет.
Титруют 0,05 н. раствором трилона Б до перехода окраски в лиловый цвет. Титруют медленно при постоянном помешивании.
Содержание кальция в миллиграмм-эквивалентах вычисляют по формуле
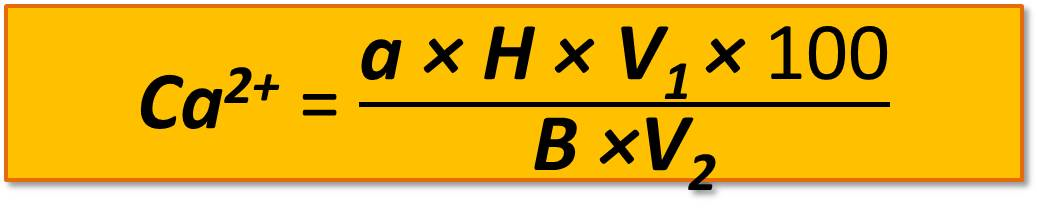 ,
,
где а – количество трилона Б, пошедшего на титрование, мл;
Н – нормальность трилона Б;
V1 – общее количество воды для приготовления водной вытяжки, мл;
V2 – объем вытяжки, взятой для титрования, мл;
В – навеска почвы, г;
100 – коэффициент пересчета на 100 г почвы.
Содержание кальция в процентах вычисляют по формуле
 ,
,
где 20 – эквивалентная масса кальция;
1000 – коэффициент пересчета в граммы.
Определение магния
Содержание магния в миллиграмм-эквивалентах определяют по формуле

Содержание магния в процентах вычисляют по формуле
 ,
,
где 12 – эквивалентная масса магния;
1000 – коэффициент пересчета в граммы.
Определение натрия
При анализе вытяжки часто Na+ непосредственно не определяют, а устанавливают его количество путем вычисления.
Оно основано на том, что в растворе сумма анионов эквивалентна сумме катионов. В водной вытяжке определяют анионы НСО3–, Сl–, SO42– и катионы Са2+, Mg2+.
Разницу между суммой эквивалентов анионов и катионов принимают как эквивалентное количество Nа+:
 .
.
Содержание натрия в процентах вычисляют по формуле
 ,
,
где 23 – эквивалентная масса натрия;
1000 – коэффициент пересчета в граммы.
Результаты анализа записывают по форме
Единица измерения |
Анионы |
Катионы |
Сухой остаток, % |
||||||
НСО3– |
Сl– |
SO42– |
Сумма анионов |
Са2+ |
Mg2+ |
Na+ |
Сумма катионов |
||
Необходимо установить соотношение между основными группами – карбонатами, хлоридами и сульфатами и выяснить преобладающий тип солей по анионному составу в данной почве. Это позволит определить характер засоления почвы.
Тип засоления в солончаках по составу анионов:
Тип засоления |
Cl / SO4 |
HCO3 / Cl+SO4 |
Хлоридный |
2 |
– |
Сульфатно-хлоридный |
2-1 |
– |
Хлоридно-сульфатный |
1-0,2 |
– |
Сульфатный |
0,2 |
– |
Карбонатно-сульфатный |
0,2 |
1 |
Сульфатно-содовый |
– |
2 |
