Экологический мониторинг и экологическая экспертиза

3.5. Титриметрический метод определения Са+2 и Mg+2
Определение содержания Са+2 и Mg+2 в природных водах необходимо для изучения процессов формирования химического состава природных вод, их происхождения и при исследовании карбонатного равновесия.
Для водоемов питьевого и рыбохозяйственного назначения ПДК для ионов Са+2 составляет 180 мг/л, Mg+2 – 40 мг/л. Для определения Са+2 используется как титриметрический метод анализа, так и ионометрический; содержание Mg+2 находится расчетным путем.
Определение Са+2
Метод основан на способности ионов Са+2 образовывать комплексы с трилоном Б в щелочной среде (pH 12-13), в качестве индикатора используется мурексид.

1. Титрованный раствор трилона Б (0,1 н. или 0,01н).
2. NaOH 2н.
3. Индикатор – мурексид + NaCl (сухая смесь).
Приготовление индикатора: 0,5 г мурексида растереть с 100 г хлорида натрия. Водный раствор мурексида лучше не готовить, так как мурексид нестоек в растворе.

К 50 или 100 мл отфильтрованной пробы добавляют 1мл NaOH до pH 9-10, затем индикатор на шпателе: сухую смесь индикатора (мураксид + NaCl) – 5-6 кристалликов тщательно перемешивают и сразу же титруют трилоном Б при перемешивании до перехода окраски из красной в фиолетовую. Титрант следует добавлять до тех пор, пока цвет раствора потеряет красный оттенок.
Содержание Са+2 вычисляют по формуле
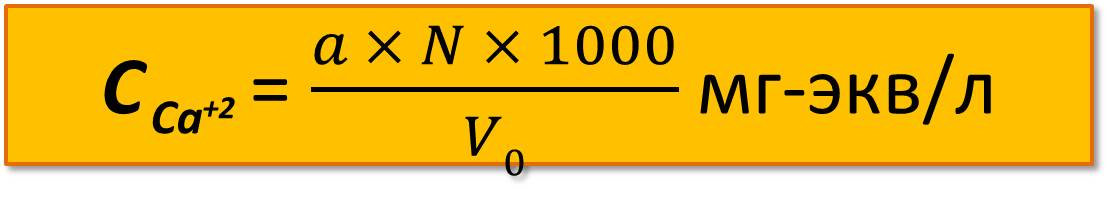
где а – количество трилона Б, мл;
N – нормальность трилона Б , мг-экв/л;
V0 – объем пробы, мл.
Для пересчета содержания Са+2 из мг-экв/л в мг/л умножают С на эквивалент Са+2, т.е. на 20,04.
Расчет содержания Mg+2
Содержание Mg+2 в пробах воды рассчитывают по разности жесткости и содержания Са+2:

В случае необходимости содержание Mg+2 в мг/л определяют по формуле

где 12,16 – эквивалентная масса Mg+2.
