ФИЗИКА
6.4. Принцип Паули. Распределение электронов по энергетическим уровням атома
В связи с введением спина, состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами:
главным - ![]() ;
;
азимутальным - ![]() ;
;
магнитным - ![]() ;
;
спиновым - ![]() .
.
Энергия состояния (исключая водород) зависит в основном от чисел n и ℓ. Кроме того, имеется слабая зависимость энергии от чисел т и ms, поскольку их значения связаны с взаимной ориентацией моментов  и
и  , от которой зависит величина взаимодействия между орбитальным и собственным магнитными моментами электрона. Энергия состояния сильнее возрастает с увеличением числа n, чем с увеличением ℓ. Поэтому, как правило, состояние с бóльшим n обладает, независимо от значения ℓ, большей энергией.
, от которой зависит величина взаимодействия между орбитальным и собственным магнитными моментами электрона. Энергия состояния сильнее возрастает с увеличением числа n, чем с увеличением ℓ. Поэтому, как правило, состояние с бóльшим n обладает, независимо от значения ℓ, большей энергией.
В нормальном (невозбуждённом) состоянии атома электроны должны располагаться на самых низких доступных для них энергетических уровнях. Поэтому казалось бы, в любом атоме в нормальном состоянии все электроны должны находиться в состоянии 1s(n=1, ℓ=0). Однако опыт показывает, что это не так.
Объяснение наблюдаемых типов спектров дал принцип Паули. Он справедлив не только для электронов, но и для других частиц с полуцелым спином. В своей простейшей формулировке принцип Паули гласит: в одном и том же атоме (или в какой-либо квантовой системе) не может быть двух электронов, обладающих одинаковой совокупностью четырёх квантовых чисел: n, ℓ, m, ms.
Иными словами, в одном и том же состоянии не могут находиться одновременно два электрона.
Ранее было показано, что данному n соответствует n2 состояний, отличающихся значениями ℓ и т. Квантовое число ms может принимать два значения: ±1/2. Поэтому в состояниях с данным значение n могут находиться в атоме не более 2n2 электронов:
n = 1 могут иметь 2 электрона;
n = 2 могут иметь 8 электронов;
n = 3 могут иметь 18 электронов;
n = 4 могут иметь 32 электрона;
n = 5 могут иметь 50 электронов.
Совокупность электронов, имеющих одинаковые значения квантового числа n, образуют оболочку. Оболочки подразделяются на подоболочки, отличающиеся значением квантового числа ℓ. В соответствии с значением n оболочкам дают обозначения, заимствованные из спектроскопии рентгеновских лучей:
Значение n 1 2 3 4 5 6 …
Обозначение оболочки К L M N O P …
Подразделение возможных состояний электрона в атоме на оболочки и подоболочки показано в табл. 6.4.1, в которой вместо обозначений ![]() применены для наглядности символы: ↑↓.
применены для наглядности символы: ↑↓.
Таблица 6.4.1
Заполнение оболочек К, L, M, N в атомах
Оболочка |
n |
i |
mi |
ms |
Подоболочка |
Оболочка |
n |
i |
mi |
ms |
Подоболочка |
K |
1 |
0 |
0 |
|
K (1s) |
N |
4 |
0 |
0 |
|
N1 (4s) |
L |
2 |
0 |
0 |
|
L1 (2s) |
1 |
-1 |
|
N2 (4p) |
||
1 |
-1 |
|
L2 (2p) |
0 |
|
||||||
0 |
|
+1 |
|
||||||||
+1 |
|
2 |
-2 |
|
N3 (4d) |
||||||
M |
3 |
0 |
0 |
|
M1 (3s) |
-1 |
|
||||
1 |
-1 |
|
M2 (3p) |
0 |
|
||||||
0 |
|
+1 |
|
||||||||
+1 |
|
+2 |
|
||||||||
2 |
-2 |
|
M3 (3d) |
3 |
-3 |
|
N4 (4f) |
||||
-1 |
|
-2 |
|
||||||||
0 |
|
-1 |
|
||||||||
+1 |
|
0 |
|
||||||||
+2 |
|
+1 |
|
||||||||
+2 |
|
||||||||||
+3 |
|
Для полностью заполненной подоболочки характерно равенство нулю суммарного орбитального и суммарного спинового моментов. Следовательно, момент импульса такой подоболочки равен нулю. Таким образом, при определении L и s атома заполненные подоболочки можно не принимать во внимание.
Периодическая система элементов Менделеева. Принцип Паули даёт объяснение периодической повторяемости свойств атомов. Проследим построение периодической системы Менделеева. Начнём с атома водорода, имеющего один электрон. Каждый последующий атом будем получать, увеличивая заряд ядра предыдущего атома на единицу и добавляя один электрон, который будем помещать в доступное ему согласно принципу Паули состояние с наименьшей энергией.
В атоме водорода имеется в основном состоянии один 1s-электрон с произвольной ориентацией спина.
Если заряд атома водорода увеличить на единицу и добавить ещё один электрон, то получится атом гелия. Оба электрона в этом атоме могут находиться в К-оболочке, но с антипараллельной ориентацией спинов. Электронная конфигурация атома может быть записана как 1s2. На атоме гелия заканчивается заполнение К-оболочки, что соответствует завершению І периода периодической системы элементов Менделеева.
Таблица 6.4.2
Распределение электронов в оболочках и подоболочках
Элемент |
К |
L |
М |
N |
Основной терм |
||||
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
||
1 Н |
1 |
- |
- |
- |
- |
- |
- |
- |
|
2 Не |
2 |
- |
- |
- |
- |
- |
- |
- |
|
3 Li |
2 |
1 |
- |
- |
- |
- |
- |
- |
|
4 Be |
2 |
2 |
- |
- |
- |
- |
- |
- |
|
5 B |
2 |
2 |
1 |
- |
- |
- |
- |
- |
|
6 C |
2 |
2 |
2 |
- |
- |
- |
- |
- |
|
7 N |
2 |
2 |
3 |
- |
- |
- |
- |
- |
|
8 O |
2 |
2 |
4 |
- |
- |
- |
- |
- |
|
9 F |
2 |
2 |
5 |
- |
- |
- |
- |
- |
|
10 Ne |
2 |
2 |
6 |
- |
- |
- |
- |
- |
|
11 Na |
2 |
8 |
1 |
- |
- |
- |
- |
|
|
12 Mg |
2 |
8 |
2 |
- |
- |
- |
- |
|
|
13 Al |
2 |
8 |
2 |
1 |
- |
- |
- |
|
|
14 Si |
2 |
8 |
2 |
2 |
- |
- |
- |
|
|
15 P |
2 |
8 |
2 |
3 |
- |
- |
- |
|
|
16 S |
2 |
8 |
2 |
4 |
- |
- |
- |
|
|
17 Cl |
2 |
8 |
2 |
5 |
- |
- |
- |
|
|
18 Ar |
2 |
8 |
2 |
6 |
- |
- |
- |
|
|
19 K |
2 |
8 |
8 |
- |
1 |
- |
|
||
20 Ca |
2 |
8 |
8 |
- |
2 |
- |
|
||
21 Sc |
2 |
8 |
8 |
1 |
2 |
- |
|
||
22 Ti |
2 |
8 |
8 |
2 |
2 |
- |
|
||
23 V |
2 |
8 |
8 |
3 |
2 |
- |
|
||
24 Cr |
2 |
8 |
8 |
4 |
1 |
- |
|
||
25 Mn |
2 |
8 |
8 |
5 |
2 |
- |
|
||
26 Fe |
2 |
8 |
8 |
6 |
2 |
- |
|
||
27 Co |
2 |
8 |
8 |
7 |
2 |
- |
|
||
28 Ni |
2 |
8 |
8 |
8 |
2 |
- |
|
||
29 Cu |
2 |
8 |
8 |
10 |
1 |
- |
|
||
30 Zn |
2 |
8 |
8 |
10 |
2 |
- |
|
||
31 Ga |
2 |
8 |
8 |
10 |
2 |
1 |
|
||
32 Ge |
2 |
8 |
8 |
10 |
2 |
2 |
|
||
33 As |
2 |
8 |
8 |
10 |
2 |
3 |
|
||
34 Se |
2 |
8 |
8 |
10 |
2 |
4 |
|
||
35 Br |
2 |
8 |
8 |
10 |
2 |
5 |
|
||
36 Kr |
2 |
8 |
8 |
10 |
2 |
6 |
|
||
Третий электрон атома Li (Z = 3), согласно принципу Паули, уже не может разместиться в целиком заполненной К-оболочке и занимает наинизшее энергетическое состояние с n = 2 (L-оболочка), т.е. 2s-состояние. Электронная конфигурация для атома Li: 1s22s. Атомом Li начинается II период Периодической системы элементов. Четвёртым электроном Be (Z = 4) заканчивается заполнение подоболочки 2s. У следующих шести элементов от B (Z = 5) до Ne (Z = 10) идёт заполнение подоболочки 2p. II период периодической системы заканчивается Ne - инертным газом, для которого подоболочка 2p целиком заполнена.
Одиннадцатый электрон Na (Z = 11) размещается в М-оболочке (n = 3), занимая наинизшее состояние 3s. Электронная конфигурация имеет вид 1s22s22p63s. 3s-электрон (как и 2s-электрон Li) является валентным электроном, поэтому оптические свойства Na подобны свойствам Li. С Z = 12 идёт последовательное заполнение М-оболочки. Ar (Z = 18) оказывается подобным Не и Ne; в его наружной оболочке все s- и р-состояния заполнены. Ar является химически инертным и завершает III период Периодической системы.
Девятнадцатый электрон К (Z = 19) должен был бы занять 3d состояние в М-оболочке. Однако и в оптическом, и в химическом отношениях атом К схож с атомами Li и Na, которые имеют внешний валентный электрон в s-состоянии. Поэтому 19-й валентный электрон К должен также находиться в s-состоянии, но это может быть только s-состояние новой оболочки (N-оболочки), т.е. заполнение N-оболочки для К начинается при незаполненной М-оболочке, что возможно только в том случае, если состояние n = 4, ℓ = 0 имеет меньшую энергию, чем состояние n = 3, ℓ = 2. Такое аномальное соотношение между энергиями состояний является следствием взаимодействия электронов между собой.
Известно, что электроны в состояниях с большим моментом импульса находятся в среднем дальше от ядра, чем электроны в состояниях с малым моментом импульса. На удалённые от ядра электроны действует заряд, несколько меньший заряда +Ze, так как внутренние электроны с малым моментом импульса частично экранируют ядро. Поэтому на внешние электроны действует меньшая сила притяжения, и они слабее связаны в атоме. Для состояний с n = 3 (и более высоких) этот экранирующий эффект вызывает значительные изменения в энергиях атомных состояний. Энергия 4s-состояния действительно оказывается ниже энергии 3d-состояния. Как показывают расчёты, подкреплённые экспериментами, порядок заполнения электронных оболочек таков:
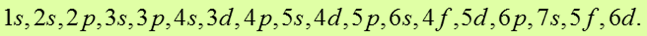
В соответствии с этой схемой 20-й электрон Са также находится в 4s-состоянии N-оболочки. В последующих элементах происходит заполнение М-оболочки (от Sc (Z = 21) до Zn (Z =30). Далее N-оболочка заполняется до Kr (Z = 36), у которого опять-таки, как и в случае Ne и Ar, s- и р-состояния наружной оболочки заполнены целиком. Криптоном заканчивается IV период периодической системы. По приведённой схеме заполнения электронных оболочек строятся и другие периоды.
Отметим важную особенность. Каждую из двух групп элементов – лантаниды (от лантана (Z = 57) до лютеция (Z = 71) и актиниды (от актиния (Z = 89) до лоуренсия (Z = 103) – приходится помещать в одну клетку таблицы, так как химические свойства элементов в пределах этих групп очень близки. Это объясняется тем, что для лантанидов заполнение подоболочки 4f, которая может содержать 14 электронов, начинается лишь после того, как целиком заполнятся подоболочки 5s, 5p, и 6s. Поэтому для этих элементов внешняя Р-оболочка (6s2) оказывается одинаковой. Аналогично одинаковой для актинидов является Q-оболочка (7s2). Таким образом, открытая Менделеевым периодичность в химических свойствах элементов объясняется повторяемостью в структуре внешних оболочек у атомов родственных элементов.
Сочетание принципа Паули и эффекта экранирования заряда ядра внутренними электронами полностью объясняет структуру электронных оболочек атомов.
к к к





























