ФИЗИКА
Атомное ядро было открыто Резерфордом в 1911 г. в опытах по изучению рассеяния частиц на тонких фольгах. Чтобы объяснить отклонение небольшой доли частиц на большие углы (до 180°С), Резерфорд предположил, что в центре каждого атома расположено тяжелое (до 99,98% массы всего атома) положительно заряженное ядро очень малых размеров (10-15-10-14 м). Вокруг ядра на относительно больших расстояниях (порядка 10-10 м) вращаются z электронов (z - порядковый номер элемента в периодической таблице Менделеева). Эта модель была названа ядерной, или планетарной, так как в соответствии с ней строение атома напоминает миниатюрную Солнечную систему, в которой роль Солнца играет ядро, роль планет – электроны, а роль гравитационного притяжения – кулоновское взаимодействие между разноименно заряженным ядром и электронами.
Однако с этой моделью возникли серьезные затруднения, так как она не удовлетворяла условию устойчивости.
Дело в том, что, согласно классической электродинамике, заряженная частица, движущаяся с ускорением, обязательно должна тратить свою энергию на излучение. Электрон, вращающийся вокруг атомного ядра, имеет центростремительное ускорение, а значит, из-за излучения его энергия должна постепенно уменьшаться. Уменьшение энергии будет приводить к снижению скорости вращения, т.е. центробежной силы, которая перестанет уравновешивать силу кулоновского притяжения. В результате электрон начнет по спирали приближаться к ядру и в конце концов упадет на него. Выходит, если поверить планетарной модели, то атом надо сравнивать не с Солнцем и планетами, а, скорее, с Землей, вокруг которой в пределах атмосферы вращаются искусственные спутники. Из-за сопротивления воздуха спутники постепенно снижают свою скорость и приближаются к Земле по спирали. Таким образом, по планетарной модели получается, что все атомы должны быть неустойчивы. А это противоречит эксперименту.
Другое, не менее важное, возражение против планетарной модели заключается в том, что она допускает испускание атомами светового излучения любой длины волны, в то время как из опыта следует, что конкретные атомы испускают излучение только строго определенных длин волн.
Выход из затруднений был предложен в 1913 г. Бором, правда, ценой введения предположений, противоречащих классическим представлениям. Допущения, сделанные Бором, содержатся в двух высказанных им постулатах:
1. В атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Двигаясь по стационарным орбитам, электрон должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию
(6.1.1)
 (n = 1,2,3...)
(n = 1,2,3...)
где me - масса электрона;
ν - его скорость на n-й орбите радиуса rn;
![]() - постоянная Планка.
- постоянная Планка.
2. При переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
(6.1.2)
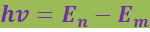
равной разности энергий соответствующих стационарных состояний.
При Em < En происходит излучение фотона, при Em > En - его поглощение. Набор возможных дискретных частот ![]() квантовых переходов и определяет линейчатый спектр атома.
квантовых переходов и определяет линейчатый спектр атома.
На основании расчетов, сделанных по теории Бора, были предсказаны и обнаружены экспериментально новые спектральные серии атома водорода. В дальнейшем теория Бора была усовершенствована другими физиками.
Круговые орбиты были заменены эллиптическими, движение электронов по ним стали рассчитывать не по классической, а по релятивистской механике и др.
Все это позволило еще лучше понять наблюдаемые закономерности в оптических спектрах, в частности, объяснить поведение излучающего атома в магнитном поле, природу тонкого, а впоследствии и сверхтонкого расщепления спектральных линий.
Однако вместе с успехами теории накапливались и возражения против нее. Дело в том, что для каждого усовершенствования теории в нее приходилось вводить всё новые и новые квантовые числа. Вслед за главным квантовым числом n в теорию были введены орбитальное квантовое число ℓ, а затем магнитное т и спиновое s квантовые числа.
Правда, каждое из них вводилось вполне логично – как мера квантования момента импульса или его проекции. Но каждый раз эти квантовые числа и диапазон возможных значений для них приходилось постулировать.
Сначала были постулированы возможные значения квантовых чисел, затем их пришлось oграничить специальными запретами (правила отбора). Потом для объяснения периодической системы элементов Менделеева пришлось постулировать принцип Паули, который запрещает двум электронам находиться в одном и том же состоянии (иметь одинаковыми все четыре квантовых числа).
Но, несмотря на это, теория оказалась неприменимой уже к следующему атому – атому He. Эта неудача теории объясняется тем, что в ней движение электронов в атоме происходит по определенным траекториям подобно тому, как это имеет место в обычной механике. А между тем опыт доказывает, что для микрочастицы понятие траектории теряет смысл.
к к к