ФИЗИКА
2.4.3. Внутренняя энергия реального газа. Эффект Джоуля-Томсона
Внутренняя энергия U реального газа равна сумме кинетической энергии EK хаотического движения молекул и их взаимной потенциальной энергии Ep:
(2.4.8)
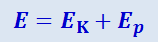 .
.
Силы взаимного притяжения влияют на движение лишь сравнительно небольшого числа молекул, находящихся в пограничном со стенками слоя газа. Поэтому можно считать, что EK для моля реального газа примерно совпадает с EK для моля соответствующего идеального газа, находящегося при той же температуре. Внутренняя же энергия Uид. идеального газа представляет собой только кинетическую энергию хаотического движения молекул, поэтому
(2.4.9)
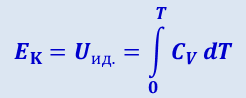 ,
,
где СV - молярная теплоёмкость газа в изохорном процессе.
Пренебрегая зависимостью CV от температуры, получим:
(2.4.10)
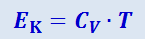 .
.
Таким образом, внутренняя энергия моля реального газа Um равна
(2.4.11)
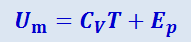 .
.
Взаимная потенциальная энергия Ep обусловлена силами межмолекулярного взаимодействия, зависящими от расстояния между молекулами. Каждая молекула газа взаимодействует с большим числом других молекул. Поэтому для данного газа энергия Ep должна зависеть от среднего расстояния между молекулами, которое, в свою очередь, однозначно определяется молярным объёмом Vm. Следовательно, в изохорном процессе Ep = const и, как видно из (2.4.11), изменение внутренней энергии dUm реального газа выражается так же, как для идеального газа:
 .
.
Экспериментально было обнаружено, что при адиабатном расширении газа без совершения полезной работы температура газа изменяется. Процесс такого необратимого расширения называется адиабатным дросселирова-нием, и явление изменения температуры в этом процессе – эффектом Джоуля-Томсона.
Рис. 2.4.4 |
Принципиальная схема опытов Джоуля и Томсона приведена на рис. 2.4.4. В хорошо теплоизолированную трубу В вставлена пористая пробка С (дроссель). С помощью подвижных поршней Е и D давления исследуемого газа слева и справа от пробки поддерживаются постоянными и соответственно равными p1 и p2 (p1 > p2). Под действием перепада давления Δp = p1 - p2 газ продавливается через пробку и при этом расширяется от давления p1 до давления p2. Совершаемая газом работа расширения практически целиком расходуется на преодоление трения газа в пробке, а выделяющаяся при трении теплота Qтр. = Атр. идёт на нагревание газа.
По первому началу термодинамики, изменение внутренней энергии газа при прохождении через дроссель равно
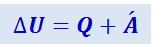 .
.
Сообщаемая газу теплота Q из-за отсутствия теплообмена между газом и внешними телами равна Qтр. Работа A', совершаемая над газом внешними силами, равна алгебраической сумме работ, совершаемых подвижными поршнями E (работа A'1) и D (работа A'2), и работы сил трения A'тр:
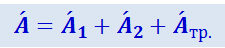 .
.
Учитывая, что работа, совершаемая газом против сил трения,
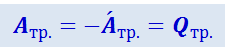 ,
,
получим:
(2.4.12)
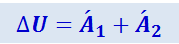 .
.
Работа изобарного вытеснения поршнем Е всего газа массой т и объёмом V, равна
(2.4.13)
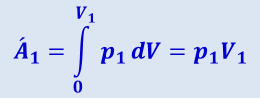 .
.
Аналогично
(2.4.14)
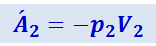 .
.
В этих формулах V1 и V2 - объёмы, занимаемые данной массой газа перед дросселем, т.е. при давлении p1, и после дросселя, т.е. при давлении p2. Знак минус в формуле (2.4.14) показывает, что поршень D противодействует перетеканию газа через дроссель. Из предыдущих формул получим:
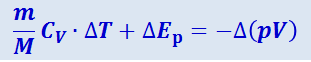 ,
,
где Δ(pV) = p2V2 - p1V1.
Таким образом, изменение температуры реального газа при адиабатном дросселировании равно
(2.4.15)
 .
.
Последняя формула выражает интегральный эффект Джоуля-Томсона, наблюдаемый при конечном перепаде давления в дросселе.
Опыты показали, что для каждого газа в зависимости от его состояния перед дросселем (p1, T1) и перепада давления в дросселе p1 - p2 изменение температуры ΔT = T2 - T1 может быть больше нуля – отрицательный эффект Джоуля-Томсона и равно нулю – нулевой эффект Джоуля-Томсона.
Изменение температуры газа при бесконечно малом адиабатном дросселировании, т.е. при изменении давления газа в дросселе на малую величину dp < 0, называют дифференциальным эффектом Джоуля-Томсона.
У идеальных газов эффект Джоуля-Томсона отсутствует.
к к к
