ФИЗИКА
2.4.1. Силы межмолекулярного взаимодействия в газах
Свойства не сильно разреженных газов отличаются от свойств идеальных газов, описываемых уравнением Клайперона-Менделеева. Так, например, из этого уравнения следует, что отношение pVm/RT, называемое фактором сжимаемости, для идеальных газов всегда равно единице. Однако опыты показывают, что факторы сжимаемости для всех газов зависят от давления и температуры. При достаточно высоких давлениях все реальные газы независимо от их температуры менее сжимаемы, чем идеальные.
Экспериментальные исследования удельной теплоёмкости, вязкости и других свойств газов, показали, что эти свойства тоже более или менее значительно отличаются от соответствующих свойств идеальных газов.
Причина этого кроется в том, что поведение молекул реальных газов отлично от того, какое приписывается частицам идеальных газов.
Во всех телах молекулы взаимодействуют друг с другом. Тот факт, что свойства разреженных газов близки к свойствам идеальных газов, свидетельствует о том, что силы взаимодействия между молекулами в сильной степени зависят от расстояния между ними. Эти силы имеют электромагнитную, а также особую квантовую природу. Опыты показывают, что при расстояниях более 10-9 м межмолекулярным взаимодействием можно пренебречь.
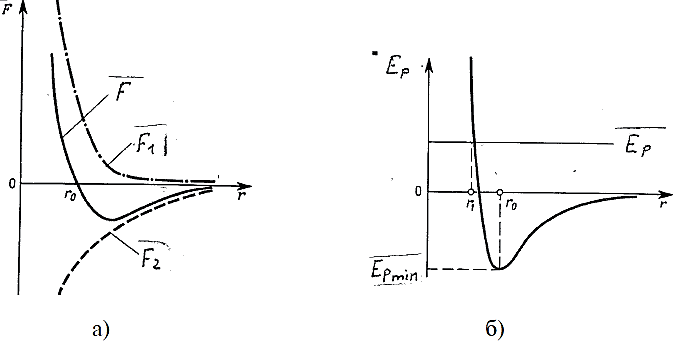
Свойства поверхностного слоя жидкостей, а также способность твёрдых тел сопротивляться растяжению приводят к выводу о том, что между молекулами вещества в любом агрегатном состоянии действуют силы взаимного притяжения. Относительно малая сжимаемость сильно уплотнённых газов, а также способность жидких и твёрдых тел сопротивляться сжатию указывают на то, что между молекулами действуют также и силы взаимного отталкивания. Существенно, что эти силы действуют одновременно. В противном случае тела не были бы устойчивы: образующие их частицы разлетались бы в разные стороны или «слипались». Из тех же соображений следует, что зависимость сил взаимного притяжения и отталкивания от расстояния r между молекулами должна быть различной. На очень близких расстояниях преобладают силы отталкивания 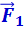 , на более далёких – силы взаимного притяжения
, на более далёких – силы взаимного притяжения 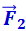 . Силы отталкивания считаются положительными, силы притяжения – отрицательными. Результирующая сила
. Силы отталкивания считаются положительными, силы притяжения – отрицательными. Результирующая сила 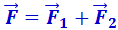 . Примерный характер зависимостей этих сил от r показан на рис. 2.4.1.
. Примерный характер зависимостей этих сил от r показан на рис. 2.4.1.
Рис. 2.4.1 |
При r = r0 силы 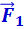 и
и 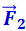 взаимно уравновешиваются и результирующая сила
взаимно уравновешиваются и результирующая сила 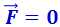 . Если r > r0, то преобладают силы взаимного притяжения, если r < r0, то преобладают силы отталкивания. Таким образом, r0 - это то равновесное расстояние между молекулами, на котором они находились бы при отсутствии теплового движения, нарушающего это равновесие.
. Если r > r0, то преобладают силы взаимного притяжения, если r < r0, то преобладают силы отталкивания. Таким образом, r0 - это то равновесное расстояние между молекулами, на котором они находились бы при отсутствии теплового движения, нарушающего это равновесие.
Элементарная работа δA силы F при увеличении расстояния между молекулами на dr совершается за счёт уменьшения взаимной потенциальной энергии молекул Ep, т.е.
(2.4.1)
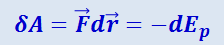 /
/
Из анализа качественной зависимости потенциальной энергии взаимодействия от расстояния между ними (рис. 2.4.1б) следует, что если молекулы находятся друг от друга на расстоянии, на котором межмолекулярные силы взаимодействия не действуют (r → ∞), то Ep = 0. При постепенном сближении молекул между ними появляются силы притяжения (F < 0), которые совершают положительную работу  . Тогда, согласно (2.4.1), потенциальная энергия взаимодействия уменьшается, достигая минимума при r = r0. При r < r0 с уменьшением r силы отталкивания (F > 0) резко возрастают, и совершаемая против них работа отрицательна
. Тогда, согласно (2.4.1), потенциальная энергия взаимодействия уменьшается, достигая минимума при r = r0. При r < r0 с уменьшением r силы отталкивания (F > 0) резко возрастают, и совершаемая против них работа отрицательна 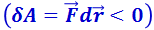 . Потенциальная энергия начинает тоже резко возрастать и становится положительной. Из данной потенциальной кривой следует, что система из двух взаимодействующих молекул в состоянии устойчивого равновесия (r = r0) обладает минимальной потенциальной энергией.
. Потенциальная энергия начинает тоже резко возрастать и становится положительной. Из данной потенциальной кривой следует, что система из двух взаимодействующих молекул в состоянии устойчивого равновесия (r = r0) обладает минимальной потенциальной энергией.
Критерием различных агрегатных состояний вещества является соотношение между величинами Epmin и kT. Наименьшая потенциальная энергия взаимодействия молекул Epmin определяет работу, которую нужно совершить против сил притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии (r = r0); kT определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического движения молекул.
Если Epmin << kT, то вещество находится в газообразном состоянии, так как интенсивное тепловое движение молекул препятствует соединению молекул, сблизившихся до расстояния r0, т.е. вероятность образования агрегатов из молекул достаточно мала.
Если Epmin >> kT, то вещество находится в твёрдом состоянии, так как молекулы, притягиваясь друг к другу, не могут удалиться на значительные расстояния и колеблются около положений равновесия, определяемого расстоянием r0. Если Epmin ≈ kT, то вещество находится в жидком состоянии, так как в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояние, превышающие r0.
Таким образом, любое вещество в зависимости от температуры может находиться в газообразном, жидком или твёрдом агрегатном состоянии, причём температура перехода из одного агрегатного состояния в другое зависит от значения Epmin для данного вещества. Например, у инертных газов Epmin мало, а у металлов велико, поэтому при обычных (комнатных) температурах они находятся соответственно в газообразном и твёрдом состояниях.
к к к