ФИЗИКА
2.3.3. Первое начало термодинамики
Внутренняя энергия может изменяться в основном за счёт двух различных процессов: совершения над телом работы A' и сообщения ему количества тепла Q. Совершение работы сопровождается перемещением внешних тел, воздействующих на систему. Так, например, при вдвигании поршня, закрывающего сосуд с газом, поршень, перемещаясь, совершает над газом работу A'. По третьему закону Ньютона, газ при этом совершает над поршнем работу A = -A'.
Сообщение газу тепла не связано с перемещением внешних тел и, следовательно, не связано с совершением над газом макроскопической (т.е. относящейся ко всей совокупности молекул, из которых состоит тело) работы.
В этом случае изменение внутренней энергии обусловлено тем, что отдельные молекулы более нагретого тела совершают работу над отдельными молекулами тела, нагретого меньше. Передача энергии происходит при этом также через излучение. Совокупность микроскопических (т.е. захватывающих не всё тело, а отдельные его молекулы) процессов, приводящих к передаче энергии от тела к телу, носит название теплопередачи.
Подобно тому как количество энергии, переданное одним телом другому, определяется работой А, совершаемой друг над другом телами, количество энергии, переданное от тела к телу путём теплопередачи, определяется количеством тепла Q, отданного одним телом другому телу. Таким образом, приращение внутренней энергии системы должно быть равно сумме совершённой над системой работы A' и количества сообщённого системе тепла Q:
(2.3.3)
 .
.
Здесь U1 и U2- начальное и конечное значения внутренней энергии системы. Обычно вместо работы A', совершаемой внешними телами над системой, рассматривают работу A (равную -A'), совершаемую системой над внешними телами. С учётом этого получим:
(2.3.4)
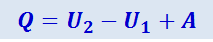
Таким образом, количество тепла, сообщённое системе, идёт на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Уравнение (2.3.4) выражает закон сохранения энергии и представляет собой содержание первого начала термодинамики. Все величины в (2.3.4) измеряются в джоулях.
Не следует думать, что при сообщении системе теплоты её внутренняя энергия обязательно возрастает. Если, например, совершённая системой работа больше, чем полученное количество теплоты (A > Q), то приращение внутренней энергией отрицательно и, следовательно, конечное значение внутренней энергии будет меньше начального (U2 < U1). Может также случиться, что система не получает теплоту, но отдаёт (Q < 0), а внутренняя энергия увеличивается. Это будет в том случае, когда совершаемая над системой работа больше, чем количество отдаваемой теплоты (A' и Q' положительны, причём A' > Q'; соответственно А и Q отрицательны, причём |A'|>|Q|).
Первое начало можно сформулировать также следующим образом: невозможен перпетуум мобиле (вечный двигатель) первого рода, т.е. такой периодически действующий двигатель, который совершал бы работу в большем количестве, чем получаемая им извне энергия.
При вычислении работы и теплоты обычно приходится разбивать рассматриваемый процесс на ряд элементарных процессов, соответствующих очень малому (в пределе – бесконечно малому) изменению параметров системы. Уравнение для элементарного процесса имеет вид:
(2.3.5)
 ,
,
где dU- бесконечно малое изменение внутренней энергии системы;
δA- элементарная работа;
δQ - бесконечно малое количество теплоты.
В этом выражении dU является полным дифференциалом, а δA и δQ таковыми не являются, поскольку их величина зависит от пути перехода системы из одного состояния в другое.
к к к