ФИЗИКА
8.1. Состав ядра и его характеристики
Ядро простейшего атома – атома водорода состоит из одной элементарной частицы, называемой протоном. Ядра всех остальных атомов состоят из двух видов элементарных частиц – протонов и нейтронов. Другое название этих частиц – нуклоны.
Протон (p) обладает положительным зарядом +e, равным отрицательному заряду электрона e = 1,6 ⋅ 10-19 Кл и массой покоя mp = 1,6726 ⋅ 10-27 кГ. В ядерной физике принято выражать массы в единицах энергии:
(8.1.1)

С учетом (8.1.1) получим
(8.1.2)

Для сравнения укажем, что масса электрона в этих единицах равна
(8.1.3)

Из сравнения (8.1.2) и (8.1.3) следует, что mp = 1836 mв.
Протон имеет спин, равный половине (s = 1/2) и собственный магнитный момент
(8.1.4)
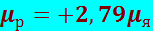
где
(8.1.5)

− единица магнитного момента, называемая ядерным магнетоном.
Из сопоставления (8.1.5) с магнетоном Бора μБ вытекает, что μя в 1836 раз меньше, чем μБ. Следовательно, собственный магнитный момент протона примерно в 660 раз меньше, чем магнитный момент электрона.
Нейтрон. Электрический заряд этой частицы равен нулю, а масса mn = 1,6749 ⋅ 10-27 кГ или в единицах энергии mn = 939,57 МэВ. Из сравнения с (8.1.2) следует, что масса нейтрона больше массы протона на 1,3 МэВ.
Нейтрон обладает спином, равным половине (s = 1/2), и (несмотря на отсутствие электрического заряда) собственным магнитным моментом
(8.1.6)
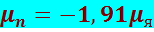
(знак минус указывает на то, что направления собственных механического и магнитного моментов противоположны). Происхождение магнитного момента нейтрона и аномально большого магнитного момента протона мы объясним в разделе 8.3 при рассмотрении схемы обменного взаимодействия между нуклонами.
В свободном состоянии нейтрон нестабилен – он самопроизвольно распадается, превращаясь в протон и испуская электрон (e-) и антинейтрино 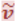 .
.
Характеристики атомного ядра. ![]() Для обозначения ядер применяется символ ZAX, где Х – химический символ данного элемента, Z – зарядовое число, величина Х – число. Численно оно равно количеству протонов, входящих в состав ядра, и определяет порядковый номер химического элемента в периодической таблице Менделеева. А – массовое число. Оно определяет число нуклонов (т.е. суммарное число протонов и нейтронов), входящих в ядро. Иногда массовое число пишут не слева, а справа от символа химического элемента (ZXA).
Для обозначения ядер применяется символ ZAX, где Х – химический символ данного элемента, Z – зарядовое число, величина Х – число. Численно оно равно количеству протонов, входящих в состав ядра, и определяет порядковый номер химического элемента в периодической таблице Менделеева. А – массовое число. Оно определяет число нуклонов (т.е. суммарное число протонов и нейтронов), входящих в ядро. Иногда массовое число пишут не слева, а справа от символа химического элемента (ZXA).
Ядра с одинаковым Z, но разными А, называют изотопами. Большинство химических элементов имеет несколько изотопов. Так, например, водород имеет три изотопа:
11H − обычный водород, или протий (Z = 1, N = 0)
21H − тяжёлый водород, или дейтерий (Z = 1, N = 1)
31H − тритий (Z = 1, N = 2)
Протий и дейтерий стабильны, тритий радиоактивен. Ядра с одинаковым массовым числом А называются изобарами. В качестве примера можно привести ядра аргона 1840Ar и кальция 2040Ca. Ядра с одинаковым числом нейтронов носят название изотонов (6C13, 7N14).
Наконец, существуют радиоактивные ядра с одинаковыми Z и А, отличающиеся периодом полураспада. Они называются изомерами.
Известно более 1500 ядер различающихся либо Z, либо А, либо тем и другим. Примерно 1/5 этих ядер устойчивы, остальные радиоактивны.
В природе встречаются элементы с атомным номером Z от 1 до 92, исключая технеций (Tc, Z = 43) и прометий (Pm, Z = 61). Плутоний (Pu, Z = 94) после получения его искусственным путем был обнаружен в ничтожных количествах в природном минерале – смоляной обманке. Остальные трансурановые (т.е. заурановые элементы с Z от 93 до 107) были получены искусственным путем.
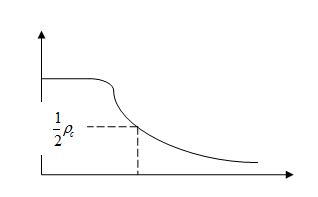
Форма и радиусы ядер. Ядра нельзя рассматривать просто как крошечные капельки ядерного вещества. Их нельзя также рассматривать как совокупность крошечных шариков (протонов и нейтронов), которые удерживаются в определенном положении благодаря некоему ядерному «клею». Подобно тому, как динамика атомных электронов надлежащим образом описывается не механическими орбитами, а распределением плотности вероятности, ядерные частицы следует рассматривать не с классической, а с квантовой точки зрения. Как и атомы, ядра оказываются «размытыми». Действительно, эксперименты по определению распределения вещества внутри ядер показали, что ядра не имеют резких границ; в центре ядра существует определенная плотность ядерного вещества, и она постепенно уменьшается до нуля с увеличением расстояния от центра. Из-за отсутствия чётко определённой границы ядра его «радиус» определяется как расстояние от центра до точки, в которой плотность ядерного вещества ρс уменьшается в два раза (рис. 8.1.1).
Рис. 8.1.1 |
Определённый таким образом радиус ядер в хорошем приближении описывается формулой:
(8.1.7)
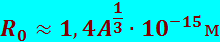
где А – массовое число ядра.
Из (8.1.7) следует, что объём ядра V:
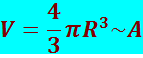
просто пропорционален общему числу протонов и нейтронов в ядре. Добавление протонов и нейтронов к какому-либо ядру с образованием нового элемента не приводит к сближению частиц: каждый протон и нейтрон занимают тот же объём независимо от числа частиц в ядре.
По аналогии с описанием средних положений электронов в атомах можно говорить и о формах ядер. Даже при таком квантовомеханическом описании среднее распределение плотности материи для большинства ядер оказывается не просто сферическим (рис. 8.1.2а). В действительности большинство ядер деформировано. Степень деформации, т.е. степень отклонения формы ядра от сферической, изменяется от одного ядра к другому. Некоторые ядра имеют форму вытянутых эллипсоидов (рис. 8.1.2б), другие форму сплющенных эллипсоидов (рис. 8.1.2в). Существуют ядра, имеющие ещё более сложную форму.
В заключение отметим важное обстоятельство. Как это следует из (8.1.6), атомы приблизительно в 100 000 раз больше, чем ядра.
Спин ядра. Спины нуклонов складываются в результирующий спин ядра. Спин нуклона равен 1/2. Поэтому квантовое число спина ядра I будет полуцелым при нечётном числе нуклонов А и целым или нулём при чётном А. Спины ядер не превышают несколько единиц. Это указывает на то, что спины большинства нуклонов в ядре взаимно компенсируют друг друга, располагаясь антипараллельно.
Рис. 8.1.2 |
к к к