ФИЗИКА
2.2.3. Уравнение состояния идеального газа
Состояние идеального газа определяется тремя параметрами: давлением р, под которым находится газ, его температурой Т и объёмом V, занимаемым определённой массой газа. Перечисленные величины не являются независимыми. Каждая из них является функцией двух других. Уравнение, связывающее все три величины для данной массы газа, называется уравнением состояния и может быть в общем виде записано так:
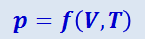
Это значит, что состояние газа определяется только двумя параметрами (например, давлением и объёмом, давлением и температурой или, наконец, объёмом и температурой), третий параметр однозначно определяется двумя другими. Если уравнение состояния известно в явном виде, то любой параметр можно вычислить, зная два других.
Для идеальных газов уравнение состояния легко получить из основных уравнений кинетической теории (2.2.10) и (2.2.13).
В самом деле, подставив в (2.2.10) вместо средней кинетической энергии молекул её выражение из (2.2.13), получим:
(2.2.14)
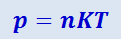
Если в объёме V содержится N частиц, то 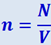 ; подставив это выражение в (2.2.14), будем иметь:
; подставив это выражение в (2.2.14), будем иметь:
(2.2.15)
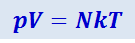 .
.
Это уравнение и является уравнением состояния идеальных газов. Его, однако, полезно преобразовать так, чтобы в него вместо недоступного прямому измерению числа частиц N входила легко измеряемая величина массы газа т.
Если разделить число молекул N в данной массе газа т на число Авогадро, то получим число молей в данной массе газа. Эту же величину можно получить, разделив массу газа т на его молекулярную массу М. Таким образом:
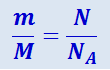 ,
,
отсюда
(2.2.16)
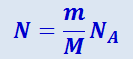 .
.
Подставим (2.2.16) в (2.2.15). Тогда уравнение состояния примет вид:
(2.2.17)
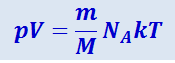 .
.
В это уравнение входят две универсальные константы NA = 6,02 ⋅ 1023 моль-1 и k = 1,38 ⋅ 10-23 Дж/град. Произведение этих констант, очевидно, тоже является универсальной константой. Она обозначается R:
 .
.
Заменив в (2.2.17) NA ⋅ k универсальной газовой постоянной, получим:
(2.2.18)
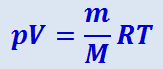 .
.
Представленное в таком виде уравнение состояния идеального газа часто называют уравнением Клайперона-Менделеева. Величина  , входящая в это уравнение, представляет собой число молей в данной массе газа. Для одного моля газа уравнение (2.2.18) имеет вид:
, входящая в это уравнение, представляет собой число молей в данной массе газа. Для одного моля газа уравнение (2.2.18) имеет вид:
(2.2.19)
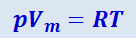 .
.
к к к