‘»«» ј
7.9. Энергетические уровни свободных атомов
Состояние электрона в атоме определяется четырьмя квантовыми числами:
- главным n (n = 1, 2, 3,...);
- орбитальным ℓ (ℓ = 0, 1, 2, ..., n-1);
- магнитным mв (mв = -ℓ,..., -1, 0, +1,...+ℓ);
- магнитным спиновым ![]() .
.
Для атома водорода n определяет энергию атома в стационарном состоянии E(n):
(7.9.42)
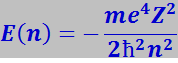
где: т и е – соответственно масса и заряд электрона;
Z – порядковый номер атома в периодической системе.
Орбитальное квантовое число ℓ определяет орбитальный момент импульса электрона Lℓ:
(7.9.43)
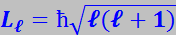
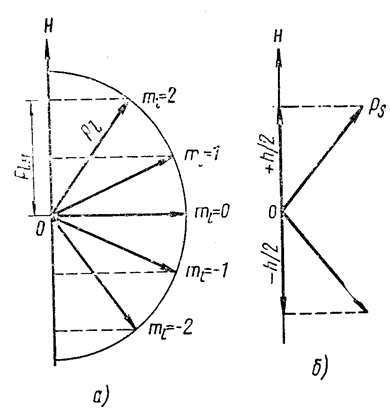
Магнитное квантовое число mℓ определяет ориентацию орбитального момента импульса электрона относительно избранного направления напряжённости магнитного поля  (рис. 7.9.15): вектор
(рис. 7.9.15): вектор ![]() может ориентироваться относительно направления
может ориентироваться относительно направления  лишь так, что его проекция на это направление целократна ħ:
лишь так, что его проекция на это направление целократна ħ:
(7.9.44)
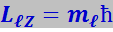
Магнитное спиновое число ms определяет ориентацию спинового момента импульса ![]() электрона относительно избранного направления
электрона относительно избранного направления ![]() :
:
(7.9.45)
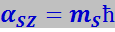
Рис. 7.9.15 |
Состояния, для которых орбитальное квантовое число ℓ = 0 при любых значениях других квантовых чисел, называются s-состояниями; состояния с ℓ = 1 называются р-состояниями, с ℓ = 2 - d-состояниями, с ℓ = 3 - f-состояниями и т.д. Электроны, находящиеся в этих состояниях, называются соответственно s-, p-, d-, f- и т.д. электронами.
В отличие от атома водорода, энергия электрона в многоэлектронных атомах зависит не только от n, но и от ℓ:
E(n, ℓ). В соответствии с тем, что n и ℓ могут принимать лишь дискретные ряды значений, энергетический спектр электронов в атомах является также дискретным: он состоит из ряда разрешённых уровней E(n, ℓ), разделённых областями запрещённых энергий. Эти уровни заполняются электронами согласно принципу Паули: в одном и том же атоме (или в какой-либо другой квантовой системе) не может быть двух электронов, обладающих одинаковой совокупностью четырёх квантовых чисел: n, ℓ, mℓ и ms.
В таблице приведена схема расположения первых трёх групп этих уровней.
Таблица 7.9.1
Обозначение уровней в атоме
Энергетические уровни атома и их обозначение |
Кратность вырождения уровней g = (2i + 1) |
Полное число электронов на уровне n = 2∙(2i + 1) |
Расщепление уровней при снятии вырождения на g = (2i + 1) подуровней |
|||
E (3, 2) |
3d |
5 |
10 |
3d |
|
2 |
|
1 |
|||||
|
+ |
|||||
|
-1 |
|||||
|
-2 |
|||||
E (3, 1) |
3p |
3 |
6 |
3p |
|
1 |
|
0 |
|||||
|
-1 |
|||||
E (3, 0) |
3s |
1 |
2 |
3s |
|
0 |
E (2, 1) |
2p |
3 |
6 |
2p |
|
1 |
|
0 |
|||||
|
-1 |
|||||
E (2, 0) |
2s |
1 |
2 |
2s |
|
0 |
E (1, 0) |
1s |
1 |
2 |
1s |
|
0 |
Все уровни s являются невырожденными. Это означает, что каждому из них отвечает единственное состояние электрона в атоме. В соответствии с принципом Паули, в таком состоянии могут находиться два электрона, отличающихся друг от друга направлением своих спинов.
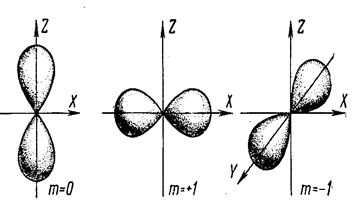
Уровни р являются трёхкратно вырожденными: каждому из них отвечает не одно, а три состояния, которые отличаются друг от друга магнитным квантовым числом mℓ. При ℓ = 1 оно может принимать следующие три значения: mℓ = -1, 0, +1. На рис. 7.9.16 показана форма электронных облаков, соответствующая этим состояниям. Так как в каждом может находиться два электрона, то на уровне р могут разместиться 6 электронов.
Рис. 7.9.16 |
Уровни d имеют пятикратное вырождение (mℓ = -2, -1, 0, +1, +2). На этом уровне может разместиться 10 электронов.
В общем случае уровень с орбитальным числом ℓ имеет (2ℓ+1) - кратное вырождение и на нём может разместиться 2(2ℓ+1) электронов.
При помещении свободного атома в сильное внешнее поле вырождение уровней снимается: каждый из них расщепляется на (2ℓ+1) близко расположенных подуровней, как показано в последнем столбце таблицы 7.9.1.
На различные уровни атома влияние внешнего поля не одинаково. Уровни внутренних электронов, сильно взаимодействующих с ядром, испытывают настолько слабое расщепление, что им можно пренебречь; по мере же перехода к всё более внешним электронам энергия взаимодействия их с ядром уменьшается, и влияние внешнего поля увеличивается. Наиболее сильное изменение под влиянием поля претерпевают уровни внешних валентных электронов, сравнительно слабо связанных с ядром.
к к к