ФИЗИКА
7.1. Силы связи твердого тела
Силы Ван-дер-Ваальса. Наиболее общим видом связи, возникающим между любыми атомами и молекулами, являются силы Ван-дер-Ваальса. Впервые они были введены для обоснования уравнения состояния реальных газов – уравнения Ван-дер-Ваальса:
(7.1.1)
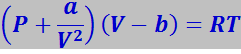
в котором определяют поправки ![]() (V - объем) и b, учитывающие действие соответственно сил притяжения и отталкивания между молекулами реального газа.
(V - объем) и b, учитывающие действие соответственно сил притяжения и отталкивания между молекулами реального газа.
Почти в чистом виде эти силы проявляются между молекулами с насыщенными химическими связями (O2, H2, N2, CH4 и т.д.), а также между атомами реальных газов, обусловливая существование их жидкого и твёрдого состояний.
В общем случае Ван-дер-ваальсова связь включает в себя дисперсионное, ориентационное и индукционное взаимодействия. Рассмотрим качественно каждое из них.
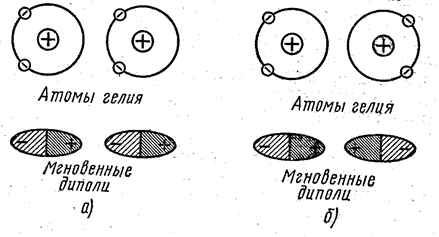
Дисперсионное взаимодействие. Рассмотрим взаимодействие двух атомов гелия (рис. 7.1.1).
Рис. 7.1.1 |
Распределение электронной плотности атома гелия обладает сферической симметрией, вследствие чего его электрический момент равен нулю. Но это означает лишь, что равно нулю среднее значение электрического момента атома. В каждый же момент времени электроны расположены в определённых точках пространства, создавая мгновенные быстро меняющиеся электрические диполи. При сближении двух атомов гелия в движении электронов этих атомов устанавливается корреляция (согласование), которая приводит к возникновению сил взаимодействия. Эти силы могут иметь двоякий характер. Если движение электронов скоррелировано так, как показано на рис. 7.1.1а, то между мгновенными диполями возникает притяжение, приводящее к появлению сил связи между атомами; при корреляции, показанной на рис. 7.1.1б, между атомами возникает отталкивание. Так как при реализации конфигурации (рис. 7.1.1а) энергия системы понижается, то эта конфигурация является более вероятной и осуществляется наиболее часто. Это и обусловливает появление постоянно действующей силы притяжения, связывающей атомы гелия. Рассмотренные силы связи называются дисперсионными силами. Их расчёт был проведён на основе следующей модели: под влиянием мгновенного электрического диполя одного атома другой атом поляризуется, и в нём возникает наведённый диполь, способствующий реализации конфигурации (рис. 7.1.1а), отвечающей притяжению. Результаты расчёта хорошо подтверждаются опытом.
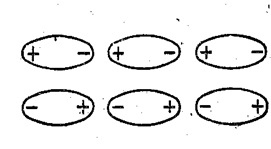
Ориентационное взаимодействие. Если молекулы являются полярными, то между ними возникает электростатическое взаимодействие, стремящееся расположить молекулы в строгом порядке (рис. 7.1.2), так как при таком расположении энергия системы уменьшается. Правильная ориентация молекул нарушается тепловым движением. Поэтому энергия системы, определяемая ориентацией молекул, сильно зависит от температуры. Такой вид взаимодействия называется ориентационным.
Рис. 7.1.2 |
Индукционное взаимодействие. Наконец, у полярных молекул, обладающих высокой поляризуемостью, может возникать наведённый (индуцированный) момент под действием поля постоянных диполей соседних молекул. Такое взаимодействие называется индукционным.
В общем случае при сближении двух молекул могут возникать все три вида связи. В частности, для воды дисперсионное взаимодействие составляет 19%, индукционное – 4, а ориентационное – 77% в общей энергии связи.
Ионная связь. Атомы, стоящие в периодической системе Менделеева рядом с инертными газами, обладают склонностью принимать их конфигурацию путём отдачи или принятия электронов. У атомов щелочных металлов, стоящих непосредственно за инертными газами, валентный электрон движется вне заполняющего слоя и связан с ядром слабо. У галоидов, стоящих непосредственно перед инертными газами, недостаёт одного электрона для заполнения устойчивого слоя инертного газа. Поэтому они обладают высоким сродством к дополнительному электрону.
Под этим термином понимается количество энергии, которое выделяется при присоединении электрона к нейтральному атому металлоида. Например, для Cl эта величина составляет 3,8 эВ.
Рассмотрим более подробно процесс образования молекулы NaCl. Пусть атомы находятся на достаточно большом расстоянии друг от друга. Произведём ионизацию Na. На это затрачивается энергия 5,1 эв. Затем присоединим полученный электрон к атому Cl. В результате получим ион Cl. Этот этап возвращает нам обратно 3,8 эВ – энергию электронного сродства. Итак, разность энергий составляет 1,3 эВ. Сравнение энергии ионизации металлов и электронного сродства металлоидов показывает, что почти всегда энергия ионизации больше, чем энергия электронного сродства.
Таким образом, переход электрона от атома Na к атому Cl не может происходить самопроизвольно и требует затраты энергии равной 1,3 эВ. С другой стороны известно, что при образовании этих молекул выделяется энергия.
Отсюда следует, что образование ионов и их сближение представляет собой единый процесс, происходящий одновременно и лишь, после того как атомы сблизятся настолько, что вместе с образованием ионов выделяется необходимое для этого количество энергии.
Легко подсчитать, что потенциальная электростатическая энергия взаимодействия двух однозаряженных ионов, находящихся на расстоянии r, равная
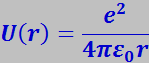
восполнит разность между энергией ионизации и электронного сродства в 1,3 эВ при
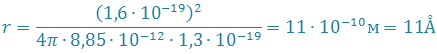 .
.
Таким образом, переход электрона от атома Na к атому Cl может начинаться лишь при r ≤ 11Å .
Электростатическое притяжение противоположно заряженных ионов на весьма малых расстояниях между ними сменяется силами отталкивания (природа этих сил будет рассмотрена ниже), препятствующими дальнейшему сближению ионов. В результате ионы Na+ и Cl- оказываются на равновесном расстоянии друг от друга, соответствующем уравновешиванию сил притяжения и отталкивания. Так возникает молекула NaCl.
Как показывает рентгеноструктурный анализ равновесным для NaCl является расстояние r0 = 1,4Å. При этом расстоянии энергия электростатического взаимодействия превышает энергию, необходимую для образования молекулы NaCl на 10,2 - 1,3 = 8,9 эВ. Эксперимент, однако, показывает, что эта величина энергии несколько завышена, ибо она не учитывает вклада в потенциальную энергию сил отталкивания.
В заключение отметим, что в связи с тем, что взаимодействие ионов носит в основном кулоновский характер, ионная связь имеет ненаправленный характер и не может быть насыщена.
Ковалентная связь. Наличием ионной и ван-дер-ваальсовой связи невозможно объяснить существование соединений типа H2, O2, N2 и т.п., а также связи в атомных кристаллах типа алмаза. Однородные атомы не могут образовать, очевидно, противоположно заряженные ионы путём перераспределения валентных электронов, как в случае взаимодействия металлов с галоидами. С другой стороны, прочность связи в молекулах H2, O2, N2… значительно больше той, которую могут обеспечить силы Ван-дер-Ваальса. Связь указанных атомов между собой получила название ковалентной. Рассмотрим качественно природу этой связи на примере молекулы водорода.
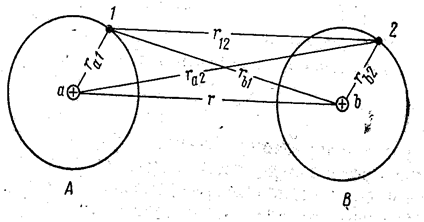
Предположим, что на сравнительно большом расстоянии r друг от друга находятся два атома водорода А и В (рис. 7.1.3).
Рис. 7.1.3 |
Вследствие того, что плотность электронного облака, описывающего состояние электрона в атоме, очень быстро падает с расстоянием, обнаружить электрон 1 у ядра b, а электрон 2 у ядра а маловероятно. Расчёт показывает, что при r ≈ 50 Å каждый из электронов может побывать у «чужого» ядра один раз в среднем за 1012 лет. Поэтому атомы А и В можно рассматривать как изолированные и энергию системы, состоящей из таких атомов, принимать равной 2E0, где E0 - энергия изолированного атома в нормальном состоянии.
По мере сближения атомов вероятность перехода электронов к «чужим» ядрам увеличивается. При r ≈ 2Å наступает заметное перекрытие электронных облаков этих атомов, и частота перехода увеличивается уже до 1014 c-1. При дальнейшем сближении степень перекрытия облаков растёт, и частота обмена электронов местами увеличивается настолько, что теряет смысл говорить о принадлежности электрона 1 к атому А, электрона 2 – к атому В. Это соответствует возникновению нового состояния, не свойственного системе, состоящей из двух изолированных атомов, и замечательного тем, что электроны в этом состоянии принадлежат обоим ядрам, или, как говорят, обобществлены.
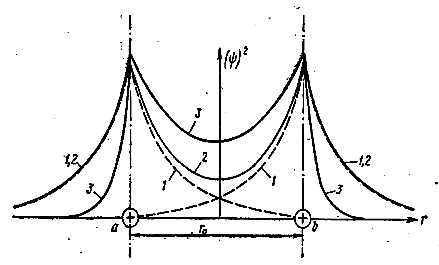
Обобществление электронов сопровождается перераспределением электронной плотности ψ2 и изменением энергии системы по сравнению с суммарной энергией 2E0 изолированных атомов. На рис. 7.1.4 пунктирными линиями 1 показана плотность электронных облаков изолированных атомов, тонкой сплошной линией 2 – суммарная плотность, которая получилась бы при простом наложении электронных облаков изолированных атомов; и наконец, жирной линией 3 – распределение плотности вдоль оси, соединяющей ядра а и b, фактически устанавливающейся при обобществлении электронов.
Рис. 7.1.4 |
Из рисунка видно, что при обобществлении электронов происходит втягивание электронных облаков в пространство между ядрами: на небольшом расстоянии от ядра вне этого пространства плотность облаков уменьшается по сравнению с плотностью в изолированных атомах, в то время как в пространстве между ядрами она повышается по сравнению с суммарной плотностью, которая могла получиться от сложения в этом пространстве облаков изолированных атомов. Появление состояния с повышенной плотностью электронного облака, заполняющего межядерное пространство, вызывает всегда уменьшение энергии системы и приводит к возникновению сил притяжения между атомами. Образно говоря, электронное облако, которое образуется в межядерном пространстве обобществлённой парой электронов, как бы стягивает ядра, стремясь максимально приблизить их друг к другу. Такова качественная картина возникновения ковалентной связи. ![]()
Количественные расчёты показали, что система, состоящая из двух сближенных атомов водорода, в зависимости от направления спинов электронов в них может обладать двумя значениями энергии:
(7.1.2)
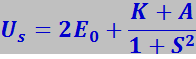
- при антипараллельном направлении спинов;
(7.1.3)
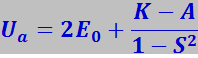
- при параллельном направлении спинов.
Здесь 2E0 - суммарная энергия двух изолированных атомов водорода, К – энергия электростатического взаимодействия электронов с ядрами, электронов между собой и ядер между собой. Её называют также кулоновской энергией; по знаку она отрицательна. А представляет собой энергию обменного взаимодействия, возникающую вследствие обмена атомов электронами. Это как раз та дополнительная энергия взаимодействия, которая появляется в следствие перераспределения электронной плотности атомов при образовании из них молекулы; по знаку она отрицательна, по абсолютной величине значительно превосходит К; S – интеграл неортогональности (0 ≤ S ≤ 1) .
Состояние с энергией Us называют симметричным, а с энергией Ua - антисимметричным. Так как К и А отрицательны, а S < 1, то при образовании симметричного состояния энергия системы уменьшается, что соответствует возникновению сил притяжения. При образовании антисимметричного состояния энергия системы увеличивается, что соответствует возникновению сил отталкивания. Таким образом, молекула образуется только в том случае, если спины электронов у сближающихся атомов антипараллельны.
Характерными особенностями ковалентной связи, отличающей её от других видов связи, являются насыщаемость и направленность. Насыщаемость выражает то, что каждый атом способен образовать ковалентную связь лишь с определённым числом своих соседей.
Так, каждый атом водорода может устанавливать связь лишь с одним своим соседом. Пара электронов, образующих эту связь, обладает антипараллельными спинами и занимает одну квантовую ячейку. Третий в этих условиях будет уже не притягиваться, а отталкиваться.
Валентная связь образуется в том направлении, в котором расположена наибольшая часть электронного облака, соответствующего валентным электронам. При этом осуществляется максимальное перекрытие облаков связующих электронов. Это и означает, что валентная связь имеет направленный характер.
Металлическая связь. Особую группу тел составляют металлы, стоящие в начале каждого периода таблицы Менделеева. Образование металлического состояния невозможно объяснить ни с точки зрения ионной, ни с точки зрения ковалентной связей. Это указывает на то, что в металлах действует особый вид связи, получивший название металлической. Рассмотрим природу этой связи.
Внешние валентные электроны в атомах связаны с ядром относительно слабо. При образовании жидкого и твёрдого состояний атомы располагаются настолько близко друг другу, что валентные электроны приобретают способность покидать свои атомы и свободно перемещаться внутри решётки. Таким образом, возникает весьма однородное распределение отрицательного заряда в кристаллической решётке металла. Это подтверждается прямыми опытами.
Связь в решётке металла возникает вследствие взаимодействия положительных ионов с электронным газом. Электроны, находящиеся между ионами, «стягивают» их, стремясь уравновесить силы отталкивания, действующие между одноимённо заряженными ионами (атомными оставами). С уменьшением расстояния между ионами увеличивается плотность электронного газа, вследствие чего растёт сила, стягивающая ионы. С другой стороны, по мере уменьшения расстояния между ионами увеличиваются силы отталкивания, стремящиеся удалить ионы друг от друга. При достижении такого расстояния между ионами, при котором силы притяжения уравновешиваются силами отталкивания, решётка становится устойчивой.
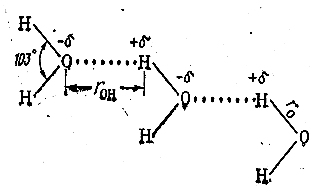
Водородная связь. Она возникает в том случае, когда атом водорода связан с очень электроотрицательным атомом, например, атомом кислорода, фтора, хлора и т.п. Такой атом притягивает электроны связи и приобретает отрицательный заряд; при этом атом водорода, от которого электрон связи оттянут, приобретает положительный заряд. Водородная связь обусловлена электростатическим притяжением этих зарядов. Типичным примером может служить водородная связь, возникающая между молекулами воды (рис. 7.1.5).
Рис. 7.1.5 |
Связь О – Н, устанавливающаяся между атомом кислорода одной молекулы воды и атомом водорода другой молекулы, ведёт себя как маленький диполь с зарядом -δ на кислороде и +δ на водороде. Притяжение между этими зарядами и приводит к возникновению водородной связи, показанной на рис. 5 точками. Длина этой связи rOH= 2,76Å значительно больше длины rO = 0,96Å ковалентной связи Н – О в самой молекуле воды.
Водородная связь вызывает ассоциацию молекул жидкостей (воды, кислот, спиртов и др.), приводящую к повышению их вязкости, увеличению точки кипения, аномальному изменению объёма при нагревании и т.д. Показательной в этом отношении является вода. Если бы между молекулами воды не действовала водородная связь, то она кипела бы при атмосферном давлении не при +100°C, а при -80°C; её вязкость была бы на порядок ниже. При нагревании воды выше 0°C происходит разрушение водородных связей, обуславливающих рыхлую структуру ассоциированных комплексов, в которых молекулы воды отстоят на значительных расстояниях друг от друга (2,76Å). Разрушение такой структуры должно приводить к уплотнению – повышению её плотности. С другой стороны, повышение температуры, увеличивая интенсивность теплового движения молекул, должно приводить к термическому расширению и уменьшению плотности воды. Как показывает опыт, в интервале температур от 0 до 4°С превалирующим является первый фактор – увеличение плотности воды вследствие разрыва водородных связей. Выше 4°С превалирующим оказывается второй фактор – термическое расширение воды. Поэтому при дальнейшем нагревании плотность воды уменьшается, как и у других («нормальных») жидкостей.
Сопоставление различных видов связи. Силы отталкивания. Наиболее универсальной является связь Ван-дер-Ваальса. Она возникает во всех без исключения случаях. Вместе с тем это наиболее слабая связь с энергией порядка 104 Дж/моль . В чистом виде она проявляется при взаимодействии нейтральных атомов и молекул, имеющих заполненные внутренние электронные оболочки. В частности, силы Ван-дер-Ваальса обусловливают существование жидкого и твёрдого состояний инертных газов, водорода, кислорода, азота и многих органических и неорганических соединений, обеспечивают связь в широкой группе валентно-молекулярных кристаллов. Вследствие того, что энергия ван-дер-ваальсовой связи низка, все структуры, обусловленные ею, малоустойчивы, легколетучи и имеют низкие точки плавления.
Ионная связь является типичной химической связью, широко распространённой среди неорганических соединений. К ним относятся соединения металлов с галоидами, окислы металлов, сульфиды и другие полярные соединения. Ионная связь присуща также многим интерметаллическим соединениям (карбиды, селениды, нитриды и др.). Энергия ионной связи значительно выше энергии ван-дер-ваальсовой связи и достигает ~106 Дж/моль. Поэтому твёрдые тела с ионной связью имеют высокие теплоты сублимации и высокие точки плавления.
Валентная связь имеет исключительно широкое распространение в органических соединениях, но встречается также в некоторых металлах и во многих интерметаллических соединениях. Эта связь обусловливает образование валентных кристаллов типа алмаза, германия и т.п. Энергия ковалентной связи также высока, ~106 Дж/моль.
Металлическая связь характерна для типичных металлов и многих интерметаллических соединений. Энергия этой связи по порядку величины сравнима с энергией валентной связи.
Наконец, водородная связь, хотя и является относительно слабой связью, тем не менее, играет исключительно важную роль в природе.
В заключение следует подчеркнуть, что в реальных твёрдых телах каждая из рассмотренных связей в чистом виде почти никогда не встречается. Практически всегда имеет место наложение двух и более типов связи. Одна из них имеет, как правило, превалирующее значение, определяя структуру и свойства тела.
Для образования устойчивой системы необходимо, чтобы между взаимодействующими атомами или молекулами возникали не только силы притяжения, но и силы отталкивания, препятствующие беспредельному сближению частиц.
Источником сил отталкивания является, прежде всего, взаимодействие ядер. Энергия этого взаимодействия U' от определяется соотношением
(7.1.4)
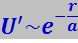
где r – расстояние между ядрами;
а = 0,53Å - радиус первой боровской орбиты.
Из (7.1.4) следует: силы отталкивания достигают огромной величины на малых расстояниях и резко падают с увеличением r.
Силы отталкивания, обусловленные взаимодействием ядер, играют основную роль при сближении лёгких атомов, ядра которых сравнительно слабо экранированы электронными оболочками.
Во всех других случаях основное значение приобретает отталкивание, возникающее вследствие перекрытия заполненных электронных оболочек сближенных атомов. В качестве примера рассмотрим взаимодействие в молекуле NaCl иона натрия, имеющего заполненную 2р-оболочку, и иона хлора с заполненной 3р-оболочкой. При сближении их до расстояния, на котором оболочки 2р и 3р перекрываются, число электронов в каждой из них становится больше того количества, которое требует принцип Паули. Поэтому часть электронов должна перейти на более высокие уровни (например, 3d или 4s). Это связано с повышением энергии системы, а следовательно, с появлением сил отталкивания. Энергия такого отталкивания определяется соотношением
(7.1.5)

где ρ - константа, определяемая экспериментально.
к к к