ФИЗИКА
2.2.1. Молекулярно-кинетические представления
Согласно современным молекулярно-кинетическим представлениям, любое тело (твёрдое, жидкое или газообразное) состоит из мельчайших обособленных частиц, называемых молекулами. Эти частицы находятся в беспорядочном, хаотическом движении, интенсивность которого зависит от температуры тела. Такое движение молекул называется тепловым.
Непосредственным доказательством существования теплового движения молекул служит, к примеру, броуновское движение.
Для характеристики масс атомов и молекул используются величины, называемые относительной атомной массой (или просто атомной массой) химического элемента и относительной молекулярной массой (или просто молекулярной массой) вещества (раньше эти величины назывались атомным и молекулярным весом).
Относительной атомной массой (Ar) химического элемента называется отношение массы этого элемента к 1/12 массы атома 12C (так обозначается изотоп углерода с массовым числом 12).
Относительной молекулярной массой (Mr) вещества называется отношение массы молекулы этого вещества к 1/12 массы атома 12C. Из их определения следует, что атомная и молекулярная массы являются безразмерными величинами.
Масса, равная 1/12 массы атома 12C, называется атомной единицей массы (а.е.м.). Обозначим её через тед. Тогда масса атома будет равна Ar ⋅ тед, а масса молекулы Mr ⋅ тед.
Одной из основных единиц СИ является единица количества вещества, называемая молем. Моль представляет собой количество вещества, в котором содержится число частиц (атомов, молекул, ионов, электронов или других структурных единиц), равное числу атомов в 0,012 кг изотопа углерода 12C.
Число частиц, содержащихся в моле вещества, называется постоянной Авогадро:
(2.2.1)
 .
.
Массу моля обозначают буквой М и называют молярной массой. Она равна произведению постоянной Авогадро на массу молекулы:
(2.2.2)
 .
.
В случае углерода 12C молярная масса равна 0,012 кг/моль, а масса атома 12 тед. Подставив эти значения в (2.2.2), получим:
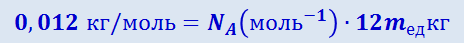 ,
,
откуда
(2.2.3)
 .
.
Таким образом, масса атома равна 1,66 ⋅ 10-27 Аr (кг), а масса молекулы равна 1,66 ⋅ 10-27 Мr (кг).
Перемножив (2.2.2) и (2.2.3), найдём, что
(2.2.4)
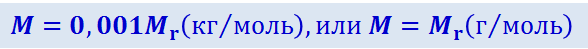 .
.
Из (2.2.4) следует, что молярная масса, выраженная в граммах на моль, численно равна относительной молекулярной массе.
Получив представление о массе молекул, произведём оценку их размеров. Естественно предположить, что в жидкостях и твёрдых телах молекулы располагаются «вплотную» друг к другу. Поэтому приближённую оценку объёма молекулы можно получить, разделив объём моля жидкости на число молекул в моле NA. Проще всего это сделать для воды. Известно, что моль (т.е. 18 г) воды занимает объём 18 ⋅ 10-6 м3/моль. Следовательно, на долю одной молекулы приходится объём, равный
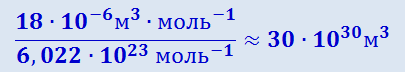 .
.
Отсюда линейные размеры молекул воды примерно равны
 .
.
Молекулы других веществ имеют размеры того же порядка.
Из четырёх возможных агрегатных состояний вещества наиболее простым является газообразное. Поэтому именно газ будет предметом нашего изучения. Причём и в молекулярно-кинетической теории, и в термодинамике мы будем пользоваться моделью идеального газа, согласно которой считают, что:
1) собственный объём молекул газа пренебрежимо мал по сравнению с объёмом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Эта модель используется в силу того, что в широком диапазоне температур и давлений она с достаточной точностью описывает поведение всех реальных газов. Кроме того, внеся поправки, учитывающие собственный объём молекул газа и действующие межмолекулярные силы, от неё можно легко перейти к теории реальных газов.
к к к