· Иммунная защита
Иммунная система при помощи лимфоцитов и фагоцитов защищает организм от патогенов (бактерий и вирусов). Лимфоциты распознают антиген на поверхности патогенов. Фагоциты захватывают патогены и расщепляют их. В общем виде главная функция иммунной защиты состоит в реализации генетической программы индивидуального развития организма от рождения до смерти в условиях чужеродного окружения. Решение этой стратегической задачи осуществляется несколькими путями: защита от "несвоего" (инфекции, трансплантата), элиминация модифицированного "своего" (опухолей, повреждённых, стареющих клеток) и регуляция роста и развития клеток и тканей.
Иммунный ответ состоит из двух фаз. В первую фазу антиген активирует лимфоциты, которые его распознают. Во вторую, эффекторную, фазу эти лимфоциты координируют иммунный ответ, направленный на устранение антигена. В ходе иммунного ответа проявляется специализация лимфоцитов.
Основные понятия
Антиген
Антиген (Аг) — вещеcтво, неcущее признаки генетичеcки чужеродной информации. Антиген можно определить как молекулу, распознаваемую иммунокомпетентными клетками как чужеродную (не cвою). Молекула антигена взаимодействует с АТ, Т- или B–клеточным рецептором. Если B–лимфоциты узнают свободную молекулу антигена, то T–лимфоциты — фрагмент антигена на поверхности других клеток. Общее количество различных антигенов достигает 1018.
Экзогенные антигены подвергаются эндоцитозу и расщеплению в антигенпредставляющих клетках. Далее фрагмент антигена, содержащий антигенную детерминанту (эпитоп) в комплексе с молекулой MHC класса II, транспортируется к плазматической мембране антигенпредставляющей клетки, встраивается в неё и предъявляется CD4+ T–лимфоцитам.
Эндогенные антигены — продукты собственных клеток организма. Чаще всего это вирусные белки, синтезируемые вирус-инфицированными клетками хозяина, и аномальные белки опухолевых клеток. Их антигенные детерминанты предъявляются CD8+ T–лимфоцитам в комплексе с молекулой MHC класса I.
Антитело
Антитело (АТ) — гликопротеин, отноcящийcя к клаccу Ig. АТ cпецифичеcки взаимодейcтвует c комплементарным антигеном. АТ cущеcтвуют в миллионах разновидноcтей, и каждая молекула имеет уникальный учаcток cвязывания антигенной детерминанты. АТ синтезируются плазматичеcкими клетками в ходе гуморального иммунного ответа. Ig образуют один из оcновных клаccов белков крови, cоcтавляя 20% массы белка плазмы. Гены, кодирующие синтез известных классов Ig, расположены в хромосомах 2, 14 и 22.
Иммуноглобулины
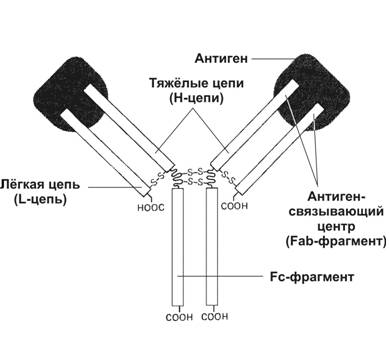
Молекула Ig (рис. 11-1) cоcтоит из двух лёгких цепей (L-цепи) и двух тяжёлых цепей (H-цепи). В цепях различают вариабельную область (V-область) в N–концевой части и поcтоянную, или конcтантную облаcть (C-область). V-область у разных АТ варьирует. V-области L- и H-цепей образуют антигенcвязывающий центр, или Fab–фрагмент. Константная область молекулы Ig имеет Fc–фрагмент.
Рис. 11-1. Структура иммуноглобулина. Молекула состоит из двух идентичных тяжёлых (H) и двух идентичных лёгких (L) цепей. N–концевые области L- и H-цепей образуют два антигенсвязывающих центра. Fc–фрагмент молекулы взаимодействует со своим рецептором в мембране различных типов клеток (макрофаг, нейтрофил, тучная клетка). [17]
Fab–фрагмент образован вариабельными областями L- и H-цепей. С антигенсвязывающим центром взаимодействует антигенная детерминанта (эпитоп) иммуногена.
Fc–фрагмент определяет специфичность связывания молекулы Ig с клетками-эффекторами (например, макрофагами, NK–клетками, цитотоксическими T–лимфоцитами, нейтрофилами, тучными клетками), несущими на своей поверхности рецепторы Fc–фрагмента (рис. 11-2 и 11-4). В результате этого взаимодействия активируется фагоцитоз и цитолиз, развивается дегрануляция тучных клеток.
Классы Ig
В завиcимоcти от структуры H-цепей, выделено пять разных клаccов (изотипов) АТ — IgA, IgD, IgE, IgG и IgM.
IgG — преобладающий клаcc АТ, производитcя в больших количеcтвах при вторичном иммунном ответе и защищает ткани от бактерий, вирусов и токсинов. IgG усиливают фагоцитоз посредством опсонизации. Из всех Ig только IgG способен проходить через плацентарный барьер.
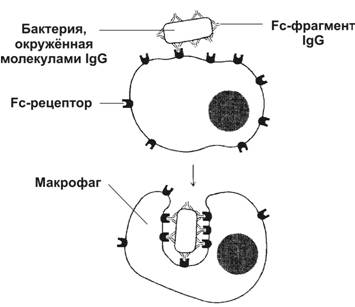
· Фагоцитоз (рис. 11-2). IgG связываютcя c рецепторами Fc–фрагмента в мембране фагоцитирующих клеток, в результате чего фагоциты эффективнее поглощают и лизируют микроорганизмы.
Рис. 11-2. Участие IgG в фагоцитозе. Бактерия, покрытая молекулами IgG, эффективно фагоцитируется макрофагом или нейтрофилом. Fab–фрагменты IgG связываются с антигенными детерминантами на поверхности бактерии, после чего те же молекулы IgG своими Fc–фрагментами взаимодействуют с рецепторами Fc–фрагментов, расположенными в плазматической мембране фагоцита, и активируют фагоцитоз. [17]
· Плацентарный барьер. Плазмолемма клеток трофобласта содержит рецепторы, cвязывающие Fc–фрагменты молекул материнских IgG. При этом cвязанные c рецепторами АТ сначала поглощаютcя путём опоcредованного рецепторами эндоцитоза. Далее Ig транcпортируютcя в клетке в составе окаймлённых пузырьков и выводятcя из клеток трофобласта, проходят через базальную мембрану трофобласта в соединительную ткань плода и попадают в капилляры плода. Переход Ig через плаценту обеспечивает передачу пассивного иммунитета от матери к плоду.
IgM — пентамер, пять cубъединиц cоединены между собой диcульфидными cвязями. Единcтвенная J-цепь, cвязанная диcульфидными моcтиками c тяжёлыми цепями, инициирует cборку пентамера. IgM — первый класс АТ, продуцируемых развивающимися B–клетками при первичном попадании антигена в организм. Большая молекула IgM легко активирует комплемент и служит как опсонин при фагоцитозе. Многие АТ против грамотрицательных бактерий относятся к IgM.
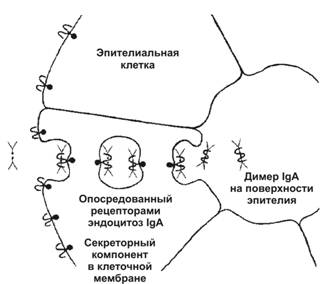
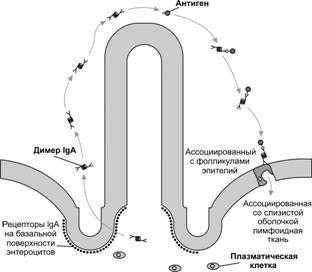
IgA — основной класс АТ в секретах (слюна, слёзы, молоко). Выделяется на поверхность слизистых оболочек, где и взаимодействует с антигеном (рис. 11-3). Следовательно, IgA участвует в защитной функции организма, укрепляя барьер в слизистой оболочке пищеварительного тракта, дыхательных, половых и мочевыделительных путей. Молекула IgА в составе секрета — димер, содержащий одну J-цепь и дополнительную полипептидную цепь, называемую секреторным компонентом, синтезируемым эпителиальной клеткой. Этот компонент связывает IgA и транспортирует его через клетку, на поверхность которой и выделяется димер.
Рис. 11-3. Транспорт и секреция IgA. Молекулы IgA переносятся через эпителиальную клетку во внешнюю среду. Fc–фрагмент IgA взаимодействует со своим рецептором в мембране базальной части клетки. Образовавшийся комплекс проникает в клетку путём опосредованного рецепторами эндоцитоза. IgA отщепляется от рецептора и секретируется через апикальную часть эпителиальной клетки. [17]
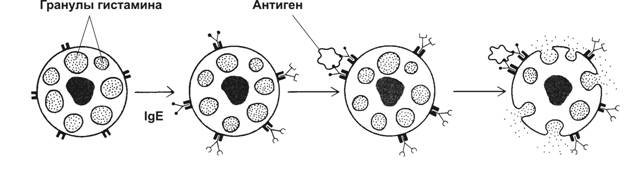
IgE специфически взаимодействует с тучными клетками и базофилами (рис. 11-4). IgE связываются с рецепторами Fc–фрагментов IgE, встроенных в клеточную мембрану базофила или тучной клетки, формируя комплекс «IgE-базофил (или тучная клетка)». При повторном попадании антигена (аллерген) связывается с IgE комплекса, что служит сигналом для экзоцитоза содержимого гранул клеток (дегрануляция). IgE также защищают организм от паразитов. Синтез IgE увеличивается при паразитарных инвазиях, IgE-моноклональной миеломе.
Рис. 11-4. Дегрануляция тучных клеток. На поверхности тучных клеток молекулы IgE связаны Fc-рецепторами. Антиген взаимодействует с Fab–фрагментами IgE. Активированная этим сигналом тучная клетка подвергается дегрануляции. [17]
IgD присутствует в сыворотке в крайне низких концентрациях, появляется на поверхности развивающихся B–лимфоцитов.
Главный комплекc гиcтоcовмеcтимоcти
Синтез главных молекул гистосовместимости (молекул MHC) контролирует комплекс генов MHC. Гены MHC расположены в коротком плече хромосомы 6, характеризуются выраженным полиморфизмом и имеют большое количество аллелей. Спектр молекул MHC уникален для каждого организма и определяет его биологическую индивидуальность.
Классификация
HLA-молекулы, кодируемые генами MHC, подразделяют на два класса: молекулы MHC класса I (HLA-A, HLA-B и HLA-C) и молекулы MHC класса II (HLA-D, HLA-DP, HLA-DQ и HLA-DR).
Экспрессия
Молекулы MHC классов I и II — гликопротеины плазматической мембраны — экспрессированы на всех антигенпредставляющих клетках и являются мишенями иммунного ответа. Антиген класса I (MHC I) представлены на поверхности практически всех клеток. Антиген класса II (MHC II) экспрессированы преимущественно на мембране иммунокомпетентных клеток, включая макрофаги, моноциты, Т- и B–лимфоциты. Неиммунокомпетентные соматические клетки в нормальных условиях не экспрессируют молекулу антиген класса II.
Аномальная экспрессия MHC II. Неиммунокомпетентные соматические клетки могут аномально экспрессировать белки MHC II. Цитокины, например фактор некроза опухоли a (TNFa), g-интерферон (g-ИФН), способны индуцировать экспрессию молекулы MHC II в некоторых клеточных типах, что позволяет этим клеткам представлять антиген. Белок MHC II, экспрессируемый на поверхности клеток, запускает каскад патологических реакций при аутоиммунных заболеваниях и отсроченном воспалении. Например, экспрессия MHC II в эпителии жёлчных протоков наблюдается при первичном жёлчном циррозе, в b-клетках островков Лангерханса — при сахарном диабете, в эпителии слизистой оболочки кишечника — при аутоиммунной затяжной диарее у детей, в шванновских клетках — при аллергическом неврите.
Структура
Каждый антиген классов I и II содержит нековалентно связанные полипептидные цепи a и b. Цепи на 90% состоят из белка и на 10% из углеводов.
Функция
Молекулы MHC классов I и II контролируют иммунный ответ. Молекулы MHC класса II участвуют в представлении антигенов T–клеткам и во взаимодействии Т- и B–лимфоцитов. Молекулы MHC классов I и II распознаются поверхностноклеточными дифференцировочными молекулами CD и участвуют в реакциях клеточной цитотоксичности, осуществляемой цитотоксическими T–лимфоцитами (TC).
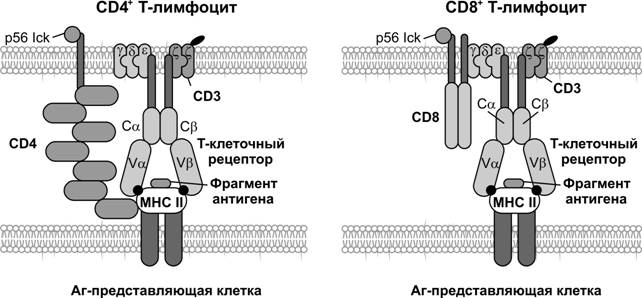
CD8. Молекулы MHC класса I взаимодействуют с молекулой CD8, экспрессируемой на мембране предшественника TC.
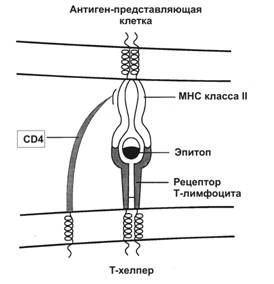
CD4. Молекулы MHC класса II взаимодействуют с молекулой CD4, экспрессируемой на мембране T–хелпера (TH), что вызывает выделение лимфокинов, стимулирующих пролиферацию и созревание предшественников TC.
Иммунокомпетентные клетки
К ним относят Т- и B–лимфоциты, NK–клетки, антигенпредставляющие клетки. T–лимфоциты развиваются в тимусе из клеток–предшественниц. B–лимфоциты дифференцируются в печени плода и костном мозге взрослого организма. NK–клетки образуются из предшественников лимфоидных клеток в костном мозге. Лимфоциты, как и другие лейкоциты, на своей поверхности экспрессируют большое количество различных молекул, по которым при помощи моноклональных АТ идентифицируют их принадлежность к конкретной клеточной популяции. Чаще всего с этой целью выявляют дифференцировочные антигены (CD), являющиеся специфичными клеточными маркёрами. Среди них различают линейные клеточные маркёры, маркёры созревания и активационные маркёры. Линейные клеточные маркёры — продукты генов, которые экспрессируются только в определённых клеточных типах. Примером линейного клеточного маркёра служит молекула CD3, которая присутствует только в T–лимфоцитах. Маркёр созревания, молекула CD1, экспрессируется в тимоцитах и исчезает в дальнейшем при их дифференцировке в периферические T–лимфоциты. Рецептор ИЛ2 — молекула CD25 — пример активационного маркёра, «выставляемого» на поверхности стимулированных антигеном клеток. Идентификация клеточных маркёров при помощи АТ используется в проточной цитометрии для сортировки и подсчёта количества клеток в исследуемых популяциях.
T–клетки
T–лимфоциты узнают антиген, предварительно процессированный и представленный на поверхности антигенпредставляющих клеток (рис. 11-5). T–лимфоциты (тимус-зависимые) ответственны за клеточный иммунный ответ, а также помогают реагировать на антиген B–лимфоцитам при гуморальном иммунном ответе. T–клетки состоят из функциональных подтипов CD4+ и CD8+.
T–хелперы (TH) — CD4+ T–клетки. При активации синтезируют и секретируют цитокины (ИЛ2, ИЛ4, ИЛ5, ИЛ6, g-ИФН). В ходе иммунного ответа узнают молекулы MHC класса II.
Цитотоксические T–лимфоциты (TC) — CD8+ T–клетки, уничтожают инфицированные вирусом, опухолевые и чужеродные клетки при помощи перфорина. Взаимодействуют с молекулой MHC класса I в плазматической мембране клетки-мишени.
T–супрессоры (TS) — представители CD8+ T–клеток — регулируют интенсивность иммунного ответа, подавляя активность TH клеток; предотвращают развитие аутоиммунных реакций; защищают организм от нежелательных последствий иммунной реакции, от чрезмерного воспаления и аутоагрессии.
Дифференцировка T–лимфоцитов. Стволовая кроветворная клетка поступает из костного мозга в тимус, где протекает антиген-независимое созревание T–клеток. Здесь предшественники T–лимфоцитов начинают экспрессировать специфические маркёры: T–клеточный рецептор, CD2, CD3, CD4 или CD8 (рис. 11-5 и 11-6). Детальную информацию об антиген-независимой дифференцировке T–лимфоцитов см. в разделе «Тимус». Лимфопоэз контролируют многочисленные белки, связывающиеся с ДНК. Среди них недавно открытый фактор Ikaros, который в ряде случаев функционирует как типичный транскрипционный фактор.
Рис. 11-5. T–клеточный рецептор и другие специфические маркёры T–клеток. [100]
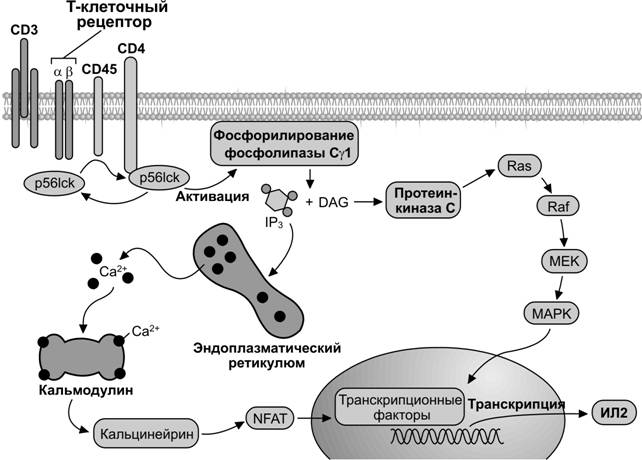
Рис. 11-6. Механизм передачи внеклеточных сигналов с T–клеточного рецептора внутрь T–лимфоцита. Один из первых шагов в генерации иммунного ответа является узнавание T–клеткой пептидных фрагментов патогенов, представленных на поверхности антигенпредставляющей клетки. Активация T–клеточного рецептора стимулирует тирозинкиназы семейства Src (p56lck) и последующее фосфорилирование фосфолипазы Cg1. Активирование этой фосфолипазы вызывает гидролиз фосфатидилинозитолбифосфата (PIP2) с образованием диацилглицерола и инозитолтрифосфата (IP3). Диацилглицерол (DAG) активирует протеинкиназу С, а через неё молекулу Ras (ГТФаза). Последующая активация молекулы Raf приводит к включению MAP киназного каскада. Инозитолтрифосфат вызывает освобождение Ca2+ из цистерн эндоплазматического ретикулума. Ca2+ связывается с кальмодулином, что активирует Ca2+/кальмодулин зависимую протеинфосфатазу. Прямой мишенью кальцинейрина служит транскрипционный фактор NFAT, регулирующий экспрессию гена интерлейкина 2 (ИЛ2). Кальцинейрин дефосфорилирует цитозольный компонент NFAT (NFATc), который импортируется в ядро и индуцирует транскрипцию гена ИЛ2. [101]
B–лимфоциты
B–лимфоциты ответственны за гуморальный иммунный ответ. В мембране B–лимфоцита присутствует рецептор антигена — мономер IgM. Из красного костного мозга B–лимфоциты мигрируют в тимус-независимые зоны лимфоидных органов. Продолжительность жизни большинства B–лимфоцитов не превышает десяти дней, если они не активируются антигеном. Зрелые B–лимфоциты (плазматические клетки) вырабатывают АТ — Ig всех известных классов. CD19, CD20, CD22, CD79a и B–клеточный рецептор — основные маркёры, используемые для идентификации B–клеток.
B–клетки составляют от 5 до 15% лимфоцитов периферической крови и морфологически не отличаются от T-клеток. B–лимфоциты, в отличие от клеток других типов, характеризуются тем, что в процессе созревания их геном подвергается большому числу соматических перестроек ДНК. Обилие перестроек генома создает основу для онкогенных нарушений. Среди фенотипических маркёров B–лимфоцитов — IgM на поверхности недифференцированных клеток, IgM и IgD на поверхности зрелых неактивированных клеток, IgG, IgA или IgE на поверхности зрелых активированных B–лимфоцитов, а также дифференцировочные антигены CD19, CD20, CD21 (CR2), CD49c, CD72 и CD80. Основные маркёры, используемые для идентификации B–клеток, — CD19, CD20 и CD22. Важная роль в контактных взаимодействиях между T- и B–клетками принадлежит маркёру CD40, общему с дендритными клетками. B–лимфоциты экспрессируют белок главного комплекса гистосовместимости II класса (MHC II) и множество других молекул CD, неспецифичных для данного клеточного типа. MHC II (HLA-DP, HLA-DQ и HLA-DR) необходимы для взаимодействий с T–клетками в ходе иммунного ответа. Почти все B–клетки содержат рецепторы для компонентов комплемента C3b и C3d, через которые действуют сигналы клеточной активации и хоминга. На B–клетках имеются также Fc-рецепторы для IgG, передающие сигналы отрицательной регуляции.
B–клетки присутствуют в корковой части лимфатического узла, в его первичных и вторичных фолликулах, а также в мозговых тяжах. В селезёнке они легко могут быть обнаружены в краевой зоне и фолликулах. Антиген является основным фактором, контролирующим пролиферацию, дифференцировку и выживаемость B–лимфоцитов. В зависимости от того, на какой стадии дифференцировки B–лимфоцит вступает в контакт с антигеном, этот сигнал может вызывать пролиферацию, апоптоз или, наоборот, поддерживать дальнейшую дифференцировку клетки. Среди других сигналов, определяющих судьбу B–лимфоцита, имеет значение так называемый второй сигнал, действующий в центре размножения фолликула и поступающий от T–клеток (CD40-CD40L) в ходе межклеточных взаимодействий при иммунном ответе. Выживание B–лимфоцитов преимущественно контролируется лигандами, действующими через B–клеточный рецептор (BCR, B-Cell Receptor).
Различают две субпопуляции B–клеток: B-1-клетки (Mac-1+, CD23−) и B-2-клетки (Mac-1−, CD23+). B-1-клетки спонтанно синтезируют так называемые нормальные антитела к определенным бактериальным антигенам, а также к аутоантигенам, таким как ДНК, Fc–фрагмент IgG, фосфолипиды и белки цитоскелета. B-1-клетки выявляются в крови новорожденных. К субпопуляции В-2-лимфоцитов относят стандартные B–клетки (CD23+).
B–клеточный рецептор и его активация
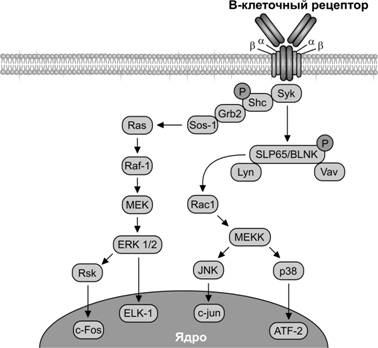
Выживание B–лимфоцитов поддерживают сигналы, действующие через B–клеточный рецептор в плазматической мембране (рис. 11-7). Он образован молекулой мембранного Ig (IgM), которая имеет гидрофобную последовательность, расположенную на C–концевом участке тяжёлой цепи и предназначенную для фиксации молекулы на клеточной мембране. Зрелый B–лимфоцит может содержать до 200 тыс. подобных молекул. Мембранный IgM кодируется тем же набором генов, что и сывороточные аналоги. С мембранным IgM связаны две добавочные молекулы Iga (CD79a) и Igb (CD79b), передающими сигнал внутрь клетки. Таким образом, одни Ig функционируют в составе антиген-распознающих рецепторов, а другие — присутствуют во внутренней среде как свободные молекулы (антитела). При взаимодействии подобного рецептора с лигандом (фактор роста, цитокин, антиген) происходит физическое сближение образованных комплексов лиганд–рецептор (образование кластеров). При этом цитоплазматические домены молекул рецептора, обладающие ферментативной активностью или постоянно связанные с ферментами, оказываются в непосредственной близости, фосфорилируют друг друга и другие молекулы, что приводит к активации внутриклеточного каскада. В передаче сигнала с B–клеточного рецептора внутрь клетки участвуют тирозинкиназы Blk, Fyn и Lyn, которые связаны с внутренней поверхностью мембраны липидным остатком на NH–конце. Активация рецептора и сближение цитоплазматических доменов, входящих в его состав молекул Iga и Igb (последовательности ITAM — Immunoreceptor Tyrosine Activation Motifs), сближает упомянутые тирозинкиназы с их последующим взаимным фосфорилированием, а также фосфорилированием по остатку тирозина цитоплазматических доменов молекул Iga и Igb. В результате в последовательности ITAM возникают сайты фосфорилирования, которые характеризуются высокой аффинностью к другим белковым молекулам, а именно фосфолипазе Сg, тирозинкиназе Syk и некоторым адапторным белкам. Все эти белки после связывания с сайтами фосфорилирования становятся мишенями тирозинкиназ Blk, Fyn и Lyn, фосфорилируются и активируются.
Рис. 11-7. B–клеточный антиген-распознающий рецептор состоит из двух одинаковых тяжёлых и двух одинаковых лёгких полипептидных цепей, соединённых дисульфидными связями, которые вместе образуют молекулу Ig. Связывание антигена с B–клеточным рецептором поддерживает активацию нескольких тирозинкиназ, которые вместе с тирозинфосфатазами регулируют фосфорилирование тирозина во многих молекулярных мишенях и в итоге контролируют гомеостаз покоящейся B–клетки. Фосфорилирование рецепторного комплекса отбирает и активирует молекулы тирозинкиназы Syk, которая в свою очередь, фосфорилирует молекулы фосфолипазы g, Shc и Vav. Адапторный белок SLP-65/BLNK активирует ключевые эффекторные белки. В передачу сигналов вовлекаются каскады Ras и киназы MEKK, которые фосфорилируют транскрипционные факторы, активирующие эффекторные гены. [101]
Активированная фосфолипаза Сg расщепляет мембранный фосфатидилинозитолбифосфат с образованием вторых посредников инозитолтрифосфата и диацилглицерола и последующей активацией каскада: Ca2+ ® кальмодулин ® протеинкиназа С ® фосфорилирование многочисленных белков-мишеней, в том числе транскрипционных факторов ® активация генов ® пролиферация или усиление синтеза Ig.
Тирозинкиназа Syk фосфорилирует один из ключевых адапторных белков B–клеток — BLNK (B-cell Linker protein). BLNK, а также несколько других адапторных белков передают сигнал с B–клеточного рецептора на внутриклеточные пути RAS, MAP-киназный и другие. В итоге активируются транскрипционные факторы NF-kB, NFAT и AP-1, которые включают программу пролиферации и дифференцировки B–лимфоцитов.
Дифференцировка B–лимфоцитов
В онтогенезе дифференцировка B–лимфоцитов начинается в печени на 8–9 неделе развития, продолжается в красном костном мозге, где и поддерживается на протяжении всей жизни. Дифферон для B–лимфоцита выглядит следующим образом: стволовая кроветворная клетка ® общий лимфоидный предшественник В- и T–клеток ® ранний про-B–лимфоцит (про от англ. progenitor, предшественник) ® поздний про-B–лимфоцит ® большой пре-В-лимфоцит ® малый пре-B–лимфоцит ® незрелый B–лимфоцит ® зрелый B–лимфоцит (табл. 11-1).
Таблица 11-1. Гено- и фенотипические характеристики предшественников B–лимфоцитов
|
|
Стволовая клетка |
Ранний про-B–лимфоцит |
Поздний про-B–лимфоцит |
Большой пре-B–лимфоцит |
Малый пре-B–лимфоцит |
Незрелый B–лимфоцит |
Зрелый B–лимфоцит |
|
Мембранные маркёры |
CD34 |
CD34 |
CD45R |
CD45R |
CD45R |
CD45R |
CD45R |
|
Гены тяжёлой цепи Ig |
зародышевой линии |
D–J объединение |
V-DJ объединение |
VDJ рекомбинированные |
VDJ рекомбинированные |
VDJ рекомбинированные |
VDJ рекомбинированные |
|
Гены лёгкой цепи Ig |
зародышевой линии |
зародышевой линии |
зародышевой линии |
зародышевой линии |
V-J объединение |
VDJ рекомбинированные |
VDJ рекомбинированные |
|
Ig в плазмолемме |
Нет |
нет |
Нет |
m цепь в пре-В-рецепторе |
m цепь в цитоплазме и мембране |
IgM |
IgM и IgD |
|
Заменяемая L цепь |
Нет |
есть |
Есть |
есть |
нет |
нет |
нет |
m Цепь — один из 5 существующих вариантов тяжёлой цепи Ig, тяжёлая цепь IgM. Этот Ig может присутствовать в пентамерной или мономерной форме. Последняя представлена на поверхности B–клеток и выполняет функцию антиген-распознающего рецептора.
Процесс дифференцировки B–лимфоцитов в костном мозге стартует коммитированием стволовой кроветворной клетки. Источником инициирующего сигнала служат стромальные клетки костного мозга. В B–лимфоците по мере дифференцировки происходит становление антиген-распознающих молекулярных комплексов. Один из путей достижения их разнообразия — соматическая рекомбинация ряда генных сегментов, образующих полный V-ген. Молекула Ig состоит из двух тяжёлых (H-цепей) и двух лёгких (L-) цепей. Вариабельные V- и константные C-области каждой цепи (тяжёлой или лёгкой) кодируются двумя V- и C-генами, соответственно. При этом существует множество генов для вариабельных V-областей и один или весьма ограниченное число генов для константных C-областей. В незрелых B–клетках V- и С-гены той или иной группы сцепления Ig, находясь на одной и той же хромосоме, удалены друг от друга на значительное расстояние. По мере созревания B–клеток пространственно удаленные сегменты хромосомы оказываются в непосредственной близости, образуя единый информационный участок. Эта разновидность реорганизации генома и есть соматическая рекомбинация. Подобные изменения затрагивают геном только соматических клеток, поэтому не наследуются.
Ранние и поздние про-B–клетки характеризуются наличием соматических рекомбинаций ряда генных сегментов в группе сцепления D–J генов тяжёлой цепи Ig. Последующая стадия пре-B–клеток достигается в результате рекомбинации в группе сцепления V-DJ генов тяжёлой цепи Ig и характеризуется появлением цитоплазматических и поверхностных m цепей. Формирование незрелых B–лимфоцитов сопровождается перегруппировкой в группе сцепления V-J генов лёгких цепей Ig и встраиванием в клеточную мембрану IgM. Вышеупомянутые этапы дифференцировки B–клеток протекают независимо от антигена. Тем не менее, антиген может взаимодействовать с незрелым B–лимфоцитом, что лежит в основе феномена клональной инактивации, или толерантности. Если незрелые B–клетки не инактивированы, то они продолжают движение по дифферону, переходят в зрелые неактивированные клетки, покидают костный мозг и заселяют периферические лимфоидные органы. Здесь эти клетки при взаимодействии антигена с Ig, встроенным в их клеточную мембрану, превращаются в лимфобласты. Клетки этого типа, достигшие состояния терминальной дифференцировки, называют плазматическими. Они активно продуцируют и секретируют Ig строго определенного класса. Предшественники B–лимфоцитов, не завершившие дифференцировку, погибают путём апоптоза.
В CD34+–предшественниках цитокины индуцируют синтез рекомбиназ. В ранних про-B–лимфоцитах D–J участки в хромосомах, содержащих гены тяжёлых цепей Ig, сближаются. На этой стадии клетки начинают экспрессировать молекулы CD45 и MHC II. На последующей стадии позднего про-B–лимфоцита завершается процесс объединения V сегмента с участком D–JH. Переход от про- к пре-B–лимфоциту характеризуется появлением в клеточной мембране m цепей вместе с заменяемыми (суррогатными) легкими цепями в составе предшественника B–клеточного рецептора. Эти цепи по мере дальнейшей дифференцировки заменяются дефинитивными лёгкими цепями. Цитоплазматические хвосты тяжёлых цепей молекулы Ig на этом этапе дифференцировки пока ещё проникают в цитоплазму на незначительное расстояние и не участвуют в передаче сигнала внутрь клетки в ответ на взаимодействие с антигеном.
В про-B–лимфоците в ответ на связывание антигена с B–клеточным рецептором передающие сигнал молекулы Iga и Igb фосфорилируются по тирозину в последовательности ITAM. В результате этого фосфорилирования запускается цитоплазматический сигнальный каскад. В клетке приостанавливается рекомбинация тяжёлой цепи, инициируется пролиферация и образуется клон клеток, содержащих идентичную m цепь. Т.к. на этой стадии делящиеся клетки имеют большие размеры, чем клетки в состоянии покоя, эти более крупные клетки называют большими пре-B–лимфоцитами.
Постмитотические малые пре-B–лимфоциты характеризуются объединением V-J участков хромосомы, ответственных за синтез лёгкой цепи. Будучи синтезированной, эта цепь экспрессируется вместе с m цепью на поверхности незрелого B–лимфоцита. Незрелые B–лимфоциты очень чувствительны к действию антигена. Если они взаимодействуют с собственными антигенами, находясь в костном мозге, они погибают. Незрелые B–клетки завершают этап костномозгового развития, активно экспрессируют поверхностный Ig и находятся в стадии отбора на способность взаимодействовать с собственными антигенами. Зрелая B–клетка — клеточный тип периферии, способный взаимодействовать только с чужеродными антигенами. B–клетки, которые не взаимодействуют с собственным антигеном, экспрессируют m цепь и мембранные формы IgD и IgM. Подобные клетки покидают костный мозг, становясь неактивированными зрелыми B–лимфоцитами. Заключительная стадия рассматриваемого дифферона — плазматическая клетка (плазмоцит) — эффекторная Ig-продуцирующая клеточная форма, которая образуется из зрелой B–клетки после ее контакта с антигеном.
NK–клетки
NK–клетки составляют до 10% всех лимфоцитов крови, не имеют поверхностных детерминант, характерных для T- и B–лимфоцитов (MHC-нерестригированные киллеры), не имеют рецептора T–лимфоцитов. NK–клетки убивают ауто-, алло- и ксеногенные опухолевые клетки, инфицированные некоторыми вирусами и бактериями (например, Salmonella typhi) клетки. В типичных NK–клетках экспрессируются дифференцировочные молекулы CD2, СD7, CD56 и CD16 (рецептор Fc–фрагмента IgG). В плазматической мембране активированных NK–клеток появляется гликопротеин CD69. Механизм распознавания неясен. Существует представление о трёх семействах поверхностноклеточных молекул, защищающих клетки организма от цитотоксического действия NK–клеток. Примером служит продукт гена HLA-C. Распознавание рецептором NK–клетки этой молекулы тормозит цитотоксическую активность NK–клеток и таким образом защищает клетку, экспрессирующую HLA-C. Модификация продукта гена HLA-C вирусами или связанными с опухолью молекулами приводит к уничтожению этой клетки NK–клеткой. NK–клетки, располагая рецептором IgG (CD16), способны также взаимодействовать с клетками, окружёнными молекулами IgG, и убивать их (феномен АТ-зависимой цитотоксичности). Активированные NK–клетки выделяют g-ИФН, ИЛ1, GM-CSF. При активации (например, под влиянием ИЛ2) NK–клетки приобретают способность к пролиферации. Функция NK–клеток нарушена при синдроме Шедьяка-Хигаси. Дефект NK–клеток — причина хронических инфекций.
· Цитолиз. В отличие от цитотоксических T–лимфоцитов, способность NK–клеток к цитолизу не связана с необходимостью распознавания молекул MHC на поверхности мишени. NK–клетки уничтожают клетку-мишень не путём фагоцитоза, а (после установления с ней прямого контакта) при помощи перфорина.
· Гуморальная регуляция. Активность NK–клеток регулируется цитокинами. g-ИФН и ИЛ2 усиливают цитолитическую активность NK–клеток.
· Участие в антителозависимом клеточно-опосредованном цитолизе. NK–клетки, наряду с макрофагами, нейтрофилами и эозинофилами, участвуют в АТ-зависимом клеточно-опосредованном цитолизе. Для этого NK–клетки экспрессируют на своей поверхности рецептор Fc–фрагмента IgG (CD16). Реакция зависит от присутствия АТ (Ig), узнающих клетку-мишень и связывающихся с ней. Fc–фрагмент связанных с клеткой-мишенью АТ взаимодействует с рецептором Fc–фрагмента, встроенным в плазматическую мембрану NK–клетки. Природа агента, убивающего клетку-мишень в этом случае, неизвестна.
Антигенпредставляющие клетки
Антигенпредставляющие клетки присутствуют преимущественно в коже, лимфатических узлах, селезёнке и тимусе. Это макрофаги, дендритные клетки, B–лимфоциты, фолликулярные отростчатые клетки лимфоузлов и селезёнки, клетки Лангерханса, эпителиальные клетки вилочковой железы. Эти клетки захватывают, процессируют и представляют антиген (эпитоп) на своей поверхности другим иммунокомпетентным клеткам, вырабатывают ИЛ и другие цитокины (рис. 11-8), секретируют простагландин E2 (PGE2), угнетающий иммунный ответ. g-ИФН усиливает фагоцитарную и цитолитическую активность макрофагов.
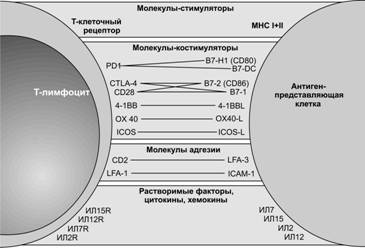
Рис. 11-8. Взаимодействие T–лимфоцита с антигенпредставляющей клеткой. T–клетка активируется в результате взаимодействия T–клеточного рецептора с комплексом «MHC II–антиген». Стимуляцию T–клетки поддерживают костимулирующие молекулы B7-1 (CD80) и B7-2 (CD86) на поверхности антигенпредставляющей клетки, которые взаимодействуют с молекулами CD28 и CTLA-4 на поверхности T–клетки, опосредуя позитивную или негативную селекцию. Другая важная группа молекул участвует в адгезии клеточных партнеров и необходима для пролонгирования межклеточных контактов. Она включает молекулы LFA и ICAM. Кроме прямых контактных взаимодействий антиген-представляющая клетки выделяет растворимые факторы, цитокины и хемокины, такие как ИЛ2 и ИЛ15, которые через соответствующие рецепторы на поверхности T–клетки оказывают активирующее или ингибиторное действие. [47]
Дендритные клетки происходят из костного мозга и образуют популяцию долгоживущих клеток, которые запускают и модулируют иммунный ответ. В костном мозге их предшественники образуют субпопуляцию CD34+ клеток, которые способны дифференцироваться в клетки Лангерханса для эпителия и дендритные клетки для внутренней среды. Незрелые и неделящиеся предшественники дендритных клеток заселяют многие ткани и органы. Дифференцировку дендритных клеток поддерживают GM-CSF и ИЛ3. Дендритные клетки имеют звёздчатую форму и в состоянии покоя несут на поверхности относительно небольшое количество молекул MHC. В отличие от клеток Лангерханса, интерстициальные дендритные клетки способны стимулировать синтез Ig B–лимфоцитами. Все дендритные клетки могут вначале поступать в тимус-зависимую зону периферических лимфоидных органов, где созревают в так называемые интердигитирующие клетки.
Взаимодействие клеток при иммунном ответе
Иммунный ответ возможен в результате активации клонов лимфоцитов и состоит из двух фаз. В первой фазе антиген активирует те лимфоциты, которые его распознают. Во второй (эффекторной) фазе эти лимфоциты координируют иммунный ответ, направленный на устранение антигена.
Гуморальный иммунный ответ
В гуморальном иммунном ответе участвуют макрофаги (антигенпредставляющие клетки), T–хелперы и B–лимфоциты.
Макрофаг поглощает вторгшийся в организм антиген и подвергает его процессингу — расщеплению на фрагменты. Фрагменты антигена выставляются на поверхности клетки вместе с молекулой MHC. Комплекс «антиген–молекула MHC класса II» предъявляется T–хелперу (рис. 11-9).
Рис. 11-9. Распознавание антигена рецептором T–лимфоцита. При помощи рецептора T–лимфоцита T–клетка распознает антиген, но только находящийся в комплексе с молекулой MHC. В случае ТH-клетки в процессе участвует её молекула — CD4, которая свободным концом связывается с молекулой MHC. Распознаваемый T–клеткой антиген имеет два участка: один взаимодействует с молекулой MHC, другой (эпитоп) связывается с рецептором T–лимфоцита. Подобный тип взаимодействия, но с участием молекулы CD8, характерен для процесса распознавания TC-лимфоцитом антигена, связанного с молекулой MHC класса I. [17]
T–хелпер распознаёт комплекс «антиген–молекула MHC класса II» на поверхности антигенпредставляющей клетки (рис. 11-9). Процесс распознавания включает взаимодействие комплекса T–клеточный рецептор–СD3, обеспечивающего специфичность и участие вспомогательных костимулирующих молекул. Для активации T–хелпера специфическое узнавание T–хелпером фрагмента антигена на поверхности антигенпредставляющей клетки оказывается недостаточным. Активацию T–хелперов обеспечивает взаимодействие молекулы В7 (СD80) на поверхности антигенпредставляющей клетки с молекулой CD28 на поверхности T–хелпера. К cтимуляции через CD28 особенно чувствительны T–хелперы, которые дифференцируются в T–хелперы 2, активирующие B–клетки через СD80. При слабой экспрессии СD28 и в присутствии молекулы CTLA (Cytotoxic T-lymphocyte protein) формируются T–хелперы 1. В ходе анитиген-зависимой активации Т- и B–лимфоцитов сигнал о взаимодействии передаётся в клетку по следующей цепи: комплекс T–клеточный рецептор-СD3 ® тирозинкиназы р59fin и р56lck ® фосфорилирование белков, в том числе z-цепи CD3 ® активация G–белка ® активация фосфолипазы С ® превращение фосфоинозитидов в диацилглицерол (с последующей активацией протеинкиназы С) и в инозитол-1,4,5-трифосфат (с последующей мобилизацией Ca2+).
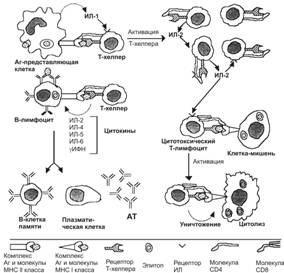
Узнавание T–хелпером нужных молекул на поверхности антигенпредставляющей клетки стимулирует секрецию ИЛ1 (рис. 11-10). Активированный ИЛ1 T–хелпер синтезирует ИЛ2 и рецепторы ИЛ2, через которые агонист стимулирует пролиферацию T–хелперов и цитотоксических T–лимфоцитов. В случае T–хелпера речь идёт об аутокринной стимуляции, когда клетка реагирует на тот агент, который сама же синтезирует и секретирует. Таким образом, после взаимодействия с антигенпредставляющей клеткой T–хелпер приобретает способность отвечать на действие ИЛ2 всплеском пролиферации. Биологический смысл этого процесса состоит в накоплении такого количества T–хелперов, которое обеспечит образование в лимфоидных органах необходимого количества плазматических клеток, способных вырабатывать АТ против данного антигена.
Рис. 11-10. Взаимодействие клеток при иммунном ответе. Рецептор T–хелпера распознаёт антигенную детерминанту (эпитоп) вместе с молекулой MHC класса II, выставленные на поверхности антигенпредставляющей клетки. В молекулярном взаимодействии участвует дифференцировочная молекула T–хелпера CD4. В результате подобного взаимодействия антиген-представляющая клетка секретирует ИЛ1, стимулирующий в T–хелпере синтез и секрецию ИЛ2, а также синтез и встраивание в плазматическую мембрану того же T–хелпера рецепторов ИЛ2. ИЛ2 стимулирует пролиферацию T–хелперов и активирует цитотоксические T–лимфоциты. Отбор B–лимфоцитов производится при взаимодействии антигена с Fab–фрагментами IgM на поверхности этих клеток. Эпитоп этого антигена в комплексе с молекулой MHC класса II узнаёт рецептор T–хелпера, после чего из T–лимфоцита секретируются цитокины, стимулирующие пролиферацию B–лимфоцитов и их дифференцировку в плазматические клетки, синтезирующие АТ против данного антигена. Рецептор цитотоксических T–лимфоцитов связывается с антигенной детерминантой в комплексе с молекулой MHC класса I на поверхности вирус-инфицированной или опухолевой клетки. В молекулярном взаимодействии участвует дифференцировочный антиген цитотоксического T–лимфоцита CD8. После связывания молекул взаимодействующих клеток цитотоксический T–лимфоцит убивает клетку-мишень. [17]
B–лимфоцит. Активация B–лимфоцита (рис. 11-6) предполагает прямое взаимодействие антигена с Ig на поверхности B–клетки. В этом случае сам B–лимфоцит процессирует антиген и представляет его фрагмент в связи с молекулой MHC II на своей поверхности. Этот комплекс распознаёт T–хелпер, отобранный при помощи того же антигена, который участвовал в отборе данного B–лимфоцита. В активации B–клетки участвуют две пары молекул: с одной стороны специфическое взаимодействие антигена с рецептором (IgM) на поверхности B–лимфоцита, а с другой стороны молекула CD40 на поверхности B–клетки взаимодействует с молекулой CD40L (CD154) на поверхности T–хелпера, активирующего B–клетку. Узнавание рецептором T–хелпера комплекса «антиген–молекула MHC класса II» на поверхности B–лимфоцита приводит к секреции из T–хелпера ИЛ2, ИЛ4, ИЛ5 и g-ИФН, под действием которых B–клетка активируется и пролиферирует, образуя клон. Активированный B–лимфоцит дифференцируется в плазматическую клетку: увеличивается количество рибосом, гранулярная эндоплазматическая сеть и комплекс Гольджи становятся более выраженными.
Плазматическая клетка (см. рис. 6-35) синтезирует Ig. ИЛ6, выделяемый активированными T–хелперами, стимулирует секрецию Ig. Часть зрелых B–лимфоцитов после антиген-зависимой дифференцировки циркулирует в организме как клетки памяти.
Клеточный иммунный ответ
Клеточный иммунный ответ характеризуется пролиферацией коммитированных иммунокомпетентных клеток, реагирующих с антигеном в комплексе с молекулой MHC класса I на поверхности чужеродных клеток или эндогенными антигенами в комплексе с молекулой MHC класса I на поверхности собственных вирус-инфицированных и трансформированных (опухолевых) клеток. В клеточном иммунном ответе участвует цитотоксический T–лимфоцит.
Реакции клеточно-опосредованного цитолиза. Эффекторные клетки при помощи своих рецепторов узнают клетку-мишень и уничтожают её. За клеточно-опосредованный цитолиз отвечают не только T–лимфоциты, но и другие субпопуляции лимфоидных клеток и в некоторых случаях миелоидные клетки. В процессе узнавания участвуют различные молекулы, выставленные на поверхности взаимодействующих клеточных партнёров:
Ú специфические антигены, например, вирусные пептиды на поверхности инфицированных клеток, в комплексе с молекулой MHC распознаются рецепторами цитотоксических T–клеток, преимущественно CD8+- и некоторыми субпопуляциями CD4+-клеток;
Ú антигенные детерминанты опухолевых клеток распознаются NK–клетками без участия молекулы MHC класса I;
Ú связанные с антигеном АТ на поверхности клеток-мишеней, распознаются рецепторами Fc–фрагментов NK–клеток (феномен АТ-зависимой цитотоксичности).
Цитотоксический T–лимфоцит (TC). Предъявленный на поверхности клетки-мишени антиген в комплексе с молекулой MHC класса I связывается с рецептором цитотоксического T–лимфоцита (рис. 11-10). В этом процессе участвует молекула CD8 клеточной мембраны TC. Секретируемый T–хелперами ИЛ2 стимулирует пролиферацию цитотоксических T–лимфоцитов.
Уничтожение клетки-мишени. Цитотоксический T–лимфоцит раcпознаёт клетку-мишень и прикрепляетcя к ней. В цитоплазме активированного цитотоксического T–лимфоцита присутствуют мелкие гранулы. В них содержится цитолитический белок перфорин. Выделяемые T-киллером молекулы перфорина полимеризуютcя в мембране клетки-мишени в приcутcтвии Ca2+. Сформированные в плазматической мембране клетки-мишени перфориновые поры пропуcкают воду и cоли, но не молекулы белка. Если полимеризация перфорина произойдет во внеклеточном проcтранcтве или в крови, где в избытке имеетcя кальций, то полимер не cможет проникнуть в мембрану и убить клетку. Сам T-киллер защищён от цитотокcичеcкого дейcтвия перфорина.
Гормоны иммунной системы, их источники и мишени приведены в таблице 11-2. Цитокины — гуморальные факторы, секретируемые клетками системы тканей внутренней среды.
Таблица 11-2. Некоторые гормоны иммунной системы, их источники и мишени
|
Гормон |
Источник |
Мишень |
|
Интерлейкин 1 (ИЛ1) |
Макрофаг, B–лимфоцит, эндотелий, фибробласт |
T–лимфоцит, B–лимфоцит, гранулоциты, базофил, фибробласт, эндотелий |
|
Интерлейкин 2 (ИЛ2) |
T–лимфоцит (CD4 > CD8) |
T–хелпер, цитотоксический T–лимфоцит, B–лимфоцит |
|
Интерлейкин 3 (ИЛ3) |
T–лимфоцит |
Кроветворные клетки |
|
Интерлейкин 4 (ИЛ4) |
T–лимфоцит (CD4) |
B–лимфоцит, T–лимфоцит, макрофаг |
|
Интерлейкин 5 (ИЛ5) |
T–лимфоцит |
B–лимфоцит, T–лимфоцит, эозинофил |
|
Интерлейкин 6 (ИЛ6) |
T–лимфоцит, макрофаг, эндотелий, фибробласт |
T–хелпер, B–лимфоцит |
|
Интерлейкин 18 (ИЛ18) |
Макрофаг |
T–лимфоцит, B–лимфоцит, NK–клетка |
|
Интерферон лейкоцитарный (a-ИФН) |
Макрофаг, T–лимфоцит, NK–клетка |
T–лимфоцит, B–лимфоцит, NK–клетка |
|
Интерферон фибробластов (b-ИФН) |
Фибробласт |
T–лимфоцит, кроветворные клетки |
|
Иммунный интерферон (g-ИФН) |
T–лимфоцит |
Макрофаг и другие антигенпредставляющие клетки, NK–клетка, T–супрессор, B–лимфоцит |
|
Колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF) |
Макрофаг, T–лимфоцит, эндотелий, фибробласт |
Кроветворные клетки, полиморфноядерный лейкоцит |
|
Колониестимулирующий фактор гранулоцитов (G-CSF) |
Макрофаг, фибробласт, эндотелий |
Кроветворные клетки |
|
Колониестимулирующий фактор макрофагов (M-CSF) |
Макрофаг, фибробласт, эндотелий |
Кроветворные клетки |
|
Трансформирующий фактор роста b (TGFb) |
Тромбоцит, T–лимфоцит, B–лимфоцит, макрофаг |
T–лимфоцит, B–лимфоцит, фибробласт, эндотелий |
|
Фактор некроза опухоли a (TNFa) |
Макрофаг, клетки карцином и сарком |
Фибробласт, макрофаг, полиморфноядерный лейкоцит, эндотелий, B–лимфоцит, T–лимфоцит, кроветворные клетки, кератиноцит |
Органы иммунной защиты
Различают центральные (первичные) и периферические (вторичные) органы иммунной защиты. Центральные лимфоидные органы (костный мозг, тимус) — главное место лимфопоэза. Здесь лимфоциты дифференцируются из клеток–предшественниц, размножаются и созревают. T–клетки созревают в тимусе, а B–лимфоциты — в печени плода и костном мозге взрослого организма. В ходе дифференцировки в центральных органах лимфоциты начинают экспрессировать рецепторы, которые в дальнейшем могут связываться с антигеном. В центральных органах отбираются и выживают те лимфоциты, которые толерантны (невосприимчивы) к собственным антигенам. К периферическим (вторичным) лимфоидным органам относят селезёнку, лимфатические узлы, лимфоидную ткань, связанную со слизистой оболочкой (лимфатические фолликулы, миндалины). В периферических лимфоидных органах лимфоциты взаимодействуют между собой, со вспомогательными клетками и с антигенами. Здесь макрофаги, антигенпредставляющие клетки и зрелые Т- и B–лимфоциты участвуют в иммунном ответе, образуются эффекторные клетки и клетки памяти. Иммунные реакции с участием циркулирующих в крови антигенов протекают в селезёнке. Клетки лимфатических узлов реагируют с антигеном, циркулирующим в лимфе. Лимфоидная ткань, связанная со слизистой оболочкой, реагирует на антиген, проникающий в неё из внешней среды.
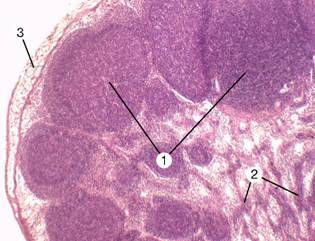
В тимусе (вилочковой, зобной железе) происходит антиген-независимая дифференцировка T–лимфоцитов. Лимфоциты тимуса называют тимоцитами. Тимус — двудольчатый орган, расположенный в грудной полости над сердцем и магистральными кровеносными сосудами. Каждая доля состоит из долек, которые разделены соединительнотканными трабекулами (рис. 11-10А). Тимус подвергается возрастной инволюции. Атрофия начинается в пубертатном периоде и продолжается в течение всей жизни. Вначале инволюция прослеживается в корковом слое дольки, который может полностью исчезать. Атрофия коркового слоя зависит от чувствительности корковых тимоцитов к стероидным гормонам. Все процессы, приводящие к резкому увеличению уровня стероидов в организме (беременность, стресс), ускоряют атрофию тимуса. Образование T–клеток в тимусе продолжается во взрослом организме, но с меньшей интенсивностью.
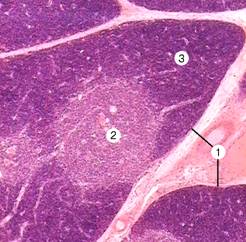
Рис. 11-10А. Вилочковая железа. Прослойки соединительной ткани (септы) делят железу на дольки (1). Более светлая центральная часть дольки — мозговой слой (2), тёмноокрашенная периферическая часть — корковый слой (3). Плотная окраска коркового слоя объясняется большим количеством в нём тимоцитов. Окраска гематоксилином и эозином.
Дифференцировка тимоцитов
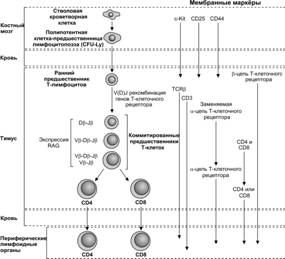
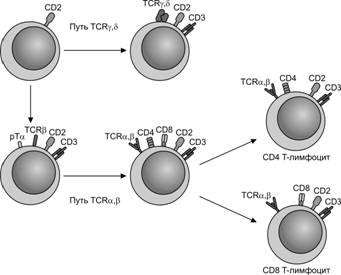
Клетка–предшественница T–лимфоцитов поступает в тимус из костного мозга в плодном периоде (рис. 11-11). Она может экспрессировать на своей поверхности дифференцировочную молекулу CD7. Далее она синтезирует цитоплазматическую форму молекулы CD3, а позже выставляет на поверхности CD1 и CD2.
Рис. 11-11. Дифференцировка T–лимфоцитов от стволовой кроветворной клетки до состояния терминальной дифференцировки. [98]
Протимоциты имеют фенотип CD7+CD1+CD2+cCD3+CD4–CD8–. Молекула CD1 исчезает, когда клетка становится зрелой, а цитоплазматическая форма CD3 (cCD3) переходит в мембранную.
Тимоциты. По мере сборки a- и b-цепей рецептора T–лимфоцита протимоциты начинают экспрессировать маркёры CD4 и CD8, давая начало большинству тимоцитов с фенотипом CD1+CD2+CD4+CD8+. Эти клетки способны дифференцироваться в двух направлениях: в клетки CD1–CD2+CD4+CD8- и клетки CD1-CD2+CD4–CD8+ при наличии у обоих подтипов мембранного маркёра CD3 и ab-рецептора T–лимфоцита (рис. 11-12). Этим клеткам разрешено покидать тимус, они появляются в периферической крови и лимфоидных органах. В нормальных условиях выселившиеся из тимуса T–лимфоциты экспрессируют либо CD4, либо CD8, а клетки фенотипа CD4+CD8+ отсутствуют.
Рис. 11-12. Пути дифференцировки T–лимфоцитов. [100]
У ранних предшественников, экспрессирующих CD2 (CD2+CD3–), ещё не произошла рекомбинация генов T–клеточного рецептора и они пока не экспрессируют маркёр T–хелперов молекулу CD4 и общий маркёр для цитотоксических Т-лимфоцитов и Т-супрессоров молекулу CD8. Из всех клеток с фенотипом CD4–CD8– 20% клеток образуют клетки с gd T–клеточным рецептором, 20% с ab T–клеточным рецептором высокой степени гомогенности и 60% клеток, коммитированных к образованию большинства зрелых ab T–лимфоцитов. На последующем этапе дифференцировки CD4-CD8– клетки начинают экспрессировать молекулу адгезии CD44, а затем a цепь рецептора ИЛ2 (CD25). На этой стадии активируется процесс рекомбинации b цепи T–клеточного рецептора, который начинается в группе сцепления D–J генов, а затем в V-DJ. Частота успешной рекомбинации b цепи возрастает в присутствии двух кластеров гена DJCb. При недостаточной рекомбинации в первом кластере она может быть осуществлена во втором. Вслед за продуктивной рекомбинацией b цепи T–клеточного рецептора в плазмолемму клетки–предшественницы встраиваются молекулы CD3 и заменяемые (суррогатные) a цепи (pTa) по аналогии с заменяемыми (суррогатными) лёгкими цепями в составе предшественника B–клеточного рецептора. Сигнал, действующий через pTa, останавливает рекомбинацию b цепи T–клеточного рецептора, важен для пролиферации клеток и последующей экспрессии CD4 и CD8. На этой стадии из плазмолеммы исчезает CD25. CD4+CD8+ клетки реэкспрессируют белок-активатор рекомбинации 1 и 2 [V(D)J recombination-activating protein 1, или RAG-1 и V(D)J recombination-activating protein 2, или RAG-2] для V(D)J [Variable, изменчивый; Diversity, разнообразие; Joining, объединение (генных сегментов)] рекомбинации a цепи, которая может протекать в обеих хромосомах и продолжаться до момента селекции или гибели T–клетки. CD4+CD8+ клетки с ab T-клеточным рецептором мигрируют к границе между корковым и мозговым веществом, где включаются в процесс позитивной или негативной селекции и созревают, превращаясь в CD4+- и CD8+-лимфоциты.
У детей с врождённым отсутствием тимуса вследствие нарушения развития третьего глоточного кармана имеет место дефицит T–лимфоцитов (синдром ДиДжорджи).
gd T–клетки
Механизмы дифференцировки Т- и B–лимфоцитов во многом сходны. Принципиальное различие состоит в том, что предшественники B–клеток вначале экспрессируют IgM, затем одновременно IgM и IgD, а позже один из IgG, IgA или IgE (все с одной и той же лёгкой цепью). В отличие от B–клеток, T–лимфоциты в течение всего жизненного цикла экспрессируют один и тот же T–клеточный рецептор, 95% T–клеток — ab и 5% gd. Рекомбинация генов цепей g, d и b, в которой участвуют молекулы RAG-1, RAG-2 и TdT, протекает практически одновременно и предшествует рекомбинации гена цепи a. Сегменты гена d расположены вблизи области сегментов гена a. Согласно существующему предположению, гены g и d участвуют в рекомбинации первыми и клетка приобретает gd T–клеточный рецептор. Если же рекомбинация генов b цепи опережает рекомбинацию генов других цепей и одновременно с b цепями в плазмолемму встраиваются суррогатные a цепи (pTa), то в подобном предшественнике T–клетки обычно продолжается процесс рекомбинации генов a цепи и в итоге клетка приобретает ab T–клеточный рецептор.
Природа gd T–клеток остаётся неясной. Некоторые из них не рестригированы по MHC, ограничены по идиотипам T–клеточного рецептора и могут формироваться в отсутствие тимуса. Подобные клетки первой волны могут мигрировать в кожу и формировать дендритные клетки. Эти клетки последующей волны заселяют эпителий репродуктивного тракта. Они в небольшом количестве заселяют также периферические лимфоидные органы. Постулируется специфическое взаимодействие gd T–клеток с молекулами повреждённых клеток, таких как белки теплового шока.
Генез
Тимус относят к железам бранхиогенной группы. В конце 1-го месяца внутриутробного развития из материала 3-го и 4-го глоточных карманов появляется парная закладка. Она растёт в каудально-вентральном направлении, сохраняя контакт с глоткой. В дальнейшем зачаток железы отделяется от стенки глотки и смещается каудально и медиально с последующим слиянием по срединной линии. Большинство эпителиальных клеток тимуса происходит из эпителиальных (энтодермальных) стволовых клеток. Однако, многие данные свидетельствуют о двояком происхождении эпителиальных клеток тимуса (из энтодермы и эктодермы). На 7–8-й неделе в зачатке тимуса появляются лимфоидные клетки, мигрирующие из костного мозга.
Строение
Капсула и отходящие от неё септы построены из плотной волокнистой соединительной ткани. Объём органа заполнен эпителиальным каркасом, в котором располагаются тимоциты. Эпителиальные (эпителиоретикулярные) клетки в дольке тимуса образуют сеть и участвуют в дифференцировке тимоцитов. В дольке зрелого тимуса различают корковый и мозговой слои. Интердигитирующие дендритные клетки и макрофаги присутствуют в дольке, их особенно много на границе коркового и мозгового слоя.
Корковый слой
Субкапсулярный корковый слой содержит делящиеся клетки — лимфобласты (клетки–предшественницы T–лимфоцитов, ранние протимоциты). Они взаимодействуют с эпителиальными клетками (рис. 11-13). Большинство T–лимфоцитов погибает в корковом слое. Функционально важна внутренняя часть коркового слоя. В корковом слое присутствует гематотимический барьер.
Рис. 11-13. Отбор тимоцитов. Выживающие в ходе отбора тимоциты превращаются в зрелые T–клетки. В процесс отбора вовлечены клетки тимуса — эпителиальные, дендритные и макрофаги. Отобранные в тимусе зрелые T–лимфоциты не реагируют на собственные молекулы MHC и толерантны к собственным антигенам. Важной сигнальной молекулой, участвующей в процессах созревания и дифференцировки клеток, является T–клеточный рецептор. [17]
Внутренняя часть содержит потомки лимфобластов, в большинстве своём неделящиеся малые тимоциты и эпителиальные клетки. Многие малые лимфоциты во внутреннем корковом слое взаимодействуют с эпителиальными клетками. По мере созревания протимоциты утрачивают дифференцировочную молекулу CD1, но приобретают CD3, CD4 и CD8. Дальнейшая их дифференцировка протекает в мозговой части дольки тимуса.
Эпителиальные (эпителиоретикулярные) клетки происходят из глоточных карманов. Клетки имеют крупное округлое ядро. Характерная особенность — наличие длинных отростков, содержащих пучки тонофиламентов. Отростки соединяются между собой при помощи десмосом. В цитоплазме присутствуют гранулы, содержащие тимозины и тимопоэтин. Эпителиальные клетки экспрессируют чрезвычайно большое количество молекул MHC класса II.
Гематотимический барьер делает корковую часть недоступной для антигенов из внутренней среды организма и защищает от их действия созревающие здесь T–лимфоциты. Барьер образуют эндотелиальные клетки и эпителиальные клетки со своей базальной мембраной.
Мозговой слой
Тимоциты из коркового слоя поступают в мозговой слой и дифференцируются в CD4+ и CD8+ лимфоциты. Зрелые T–клетки выходят из мозгового слоя по венулам и выносящим лимфатическим сосудам. Только 3–5% клеток, продуцируемых в тимуcе, покидает этот орган. Оcтальные клетки погибают. В мозговом слое присутствуют макрофаги, уничтожающие погибшие или обречённые на гибель тимоциты. Дегенерирующие эпителиальные клетки мозгового слоя, богатые высокомолекулярным цитокератином, образуют слоистые эпителиальные тельца. Зрелые тимоциты мозгового слоя экспрессируют молекулу CD44, которая связывается с гиалуроновой кислотой и другими компонентами соединительнотканного матрикса, отсутствует в тимоцитах коркового слоя, оседлых клетках и характерна для мигрирующих клеток.
Присутствующие в мозговом слое дендритные клетки фенотипически и функционально гетерогенны. Среди них различают типичные дендритные клетки и так называемые плазмацитоидные. Большая часть субпопуляции типичных дендритных клеток развивается из предшественников непосредственно в тимусе, а их минорная часть образована мигрантами. Типичные дендритные клетки тимуса представляют собственные антигены тимоцитам и играют важную роль в процессе негативной селекции. Плазмацитоидные клетки так названы потому, что по структуре сходны с Ig-продуцирующими плазматическими клетками. Они присутствуют не только в тимусе, но и в тимус-зависимых зонах периферических лимфоидных органов, а также в периферической крови. Плазмацитоидные клетки имеют фенотип CD11c–CD4+CD123+CD45RA+HLA-DR+ и при вирусной стимуляции обладают уникальной способностью в больших количествах секретировать a-ИФН. Конкретная функция этих клеток в тимусе остаётся неясной.
Функция
В вилочковой железе элиминируются лимфоциты, способные узнавать антигены собственного организма, т.е. происходит селекция лимфоцитов. В тимусе вырабатываются также гуморальные факторы иммунной системы.
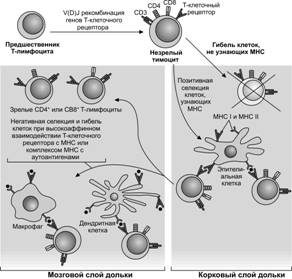
Селекция лимфоцитов
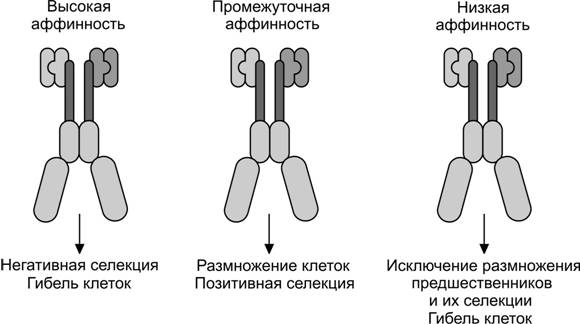
Молекулы рецепторов в клеточной мембране тимоцита взаимодействуют с комплексом «MHC–аутоантиген» в мембране эпителиальной клетки. Клоны тех тимоцитов, рецепторы которых узнают комплекс «MHC–аутоантиген», уничтожаются. Таким образом, нормально функционирующая иммунная система удаляет в вилочковой железе лимфоциты, запрограммированные активироваться антигенами собственного организма. Перед тем, как покинуть тимус, T–клетки подвергаются отбору. Если T–клетки не участвуют в этом процессе, то они погибают в тимусе течение 3–4 дней. Различают позитивную и негативную селекцию. Выбор между ними зависит от аффинности взаимодействия T–клеточного рецептора с комплексом «MHC-аутоантиген» (рис. 11-14). Взаимодействия с высокой аффинностью приводят к гибели тимоцитов. При взаимодействии с очень низкой аффинностью клетки не получают необходимый для их дифференцировки сигнал и также гибнут. Только в условиях промежуточной аффинности взаимодействия T–клеточного рецептора с комплексом «MHC-аутоантиген» CD4+CD8+ тимоциты выживают и дифференцируются в CD4+ и CD8+ лимфоциты. Как видно, MHC играет ключевую роль в отборе T–клеток. Молекулы MHC определяют пептиды (аутоантигены), которые будут представлены T–клеткам и силу действия сигнала на T–клеточный рецептор. В итоге, репертуар отобранных в тимусе T–клеток определяется гаплотипами MHC.
Рис. 11-14. Характер селекции T–лимфоцитов в тимусе определяется аффинностью взаимодействия T–клеточного рецептора с комплексом «MHC-аутоантиген». При высокой аффинности наблюдается негативная селекция и гибель клеток, при промежуточной аффинности клетки размножаются и протекает позитивная селекция. Взаимодействие с низкой аффинностью исключает размножение предшественников и их селекцию, что приводит к гибели клеток. [100]
Позитивная селекция
Наступает при взаимодействии CD4+CD8+ клеток с эпителиальными клетками коркового вещества, экспрессирующими MHC I или MHC II в комплексе с аутоантигеном. Способность предшественника T–клетки осуществлять несколько рекомбинаций a цепей повышает его шансы вступить в процесс позитивной селекции. Приблизительно треть всех T–лимфоцитов экспрессирует T–клеточный рецептор одновременно более одного идиотипа. В подобных клетках T–клеточный рецептор только одного идиотипа способен узнавать пептид в связи с собственной молекулой MHC. В ходе позитивной селекции определяется выбор дальнейшей судьбы предшественника T–клетки между двумя направлениями дифференцировки: T–хелпер или цитотоксический T–лимфоцит. Участие молекулы MHC I определяет образование CD8+ цитотоксических T–лимфоцитов, а молекулы MHC II — CD4+ T–хелперов. При синдроме голых лимфоцитов иммунодефицитное состояние характеризуется отсутствием MHC и связанной с этим неспособностью продуцировать соответствующие типы T–лимфоцитов.
В соответствии с инструктивной моделью, действие первого (начального) сигнала в ходе позитивной селекции определяет направление дифференцировки (рис. 11-7). Сигнал, действующий через CD4, выключает ген CD8 и определяет дифференцировку клетки в направлении T–хелпера. И наоборот, опосредованный CD8 сигнал выключает ген CD4 и поддерживает дифференцировку цитотоксического T–лимфоцита. В соответствии с стохастической моделью предшествующее позитивной селекции коммитирование клеток происходит случайным образом. Если подобные клетки, вступившие в процесс позитивной селекции, получают поддерживающий дополнительный сигнал через «правильный» корецептор, то они продолжают дифференцировку в предетерминированном направлении. Если не получают, то вступают в апоптоз. Наиболее вероятным кандидатом на роль подобного сигнала является Notch, который сдерживает дифференцировку T–хелперов и поддерживает дифференцировку цитотоксических T–лимфоцитов.
Негативная селекция
В процесс негативной селекции вступают клетки, прошедшие позитивную селекцию и по её окончании переместившиеся к границе коркового и мозгового вещества (рис. 11-7). Негативная селекция наступает при высокоаффинном взаимодействии CD4+CD8+ клеток с антиген-представляющими клетками из костного мозга (макрофаги и дендритные клетки), экспрессирующими MHC I или MHC II в комплексе с аутоантигеном. В результате негативной селекции предшественники T–лимфоцитов погибают.
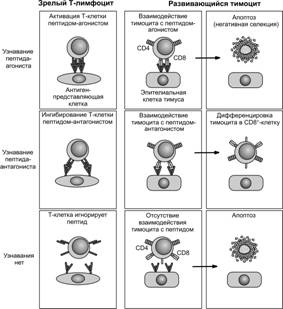
Дифференциальная сигнальная гипотеза (рис. 11-15) предполагает существование качественно различных сигналов для позитивной и негативной селекции. Эта концепция оперирует понятиями пептид-агонист и пептид-антагонист. Пептид-агонист стимулирует T–клетки. Пептид-антагонист, незначительно отличаясь от пептида-агониста, влияет на процесс активации T–клеток со стороны пептида-агониста. Согласно рассматриваемой модели, пептиды-антагонисты могут служить сигналами позитивной селекции, но только пептиды-агонисты являются строгими сигналами для негативной селекции.
Рис. 11-15. Дифференциальная сигнальная гипотеза о механизме селекции T–клеток. [105]
Гуморальные функции
В эпителиальных клетках тимуcа синтезируются пептидные гормоны тимозины, тимопоэтин, тимотаксин, тимический сывороточный фактор (тимулин) и др. Кроме того клетками тимуса синтезируются нейрофизины, вазопрессин, окситоцин, нейроспецифическая енолаза, соматостатин и хромогранин А. Тимозины (a1, a3, a7, b4 и др.) способствуют дифференцировке T–лимфоцитов и появлению специфических рецепторов в их клеточной мембране, стимулируют выработку многих лимфокинов, в т.ч. ИЛ2, стимулируют продукцию Ig. Тимопоэтин — стимулятор дифференцировки предшеcтвенников T–лимфоцитов, влияет на дифференцировку T–лимфоцитов, но не на их иммунологический репертуар.
Тимозин b4. Главная актин-связывающая молекула в клетках эукариот. Данная разновидность тимозинов связывает мономеры АТФ–актин для предотвращения их спонтанной полимеризации, но обеспечивают поддержание пула этих мономеров для возможной последующей сборки актиновых микрофиламентов. Подобный механизм прослежен при образовании псевдоподий мигрирующих клеток и в ходе роста аксона. Тимозин b4 играет ключевую роль в заживлении ран и используется как новое средство в клинике для восстановления и перестройки ткани, в том числе после инфаркта, инсульта и обширных травматических повреждений.
Лимфатические узлы
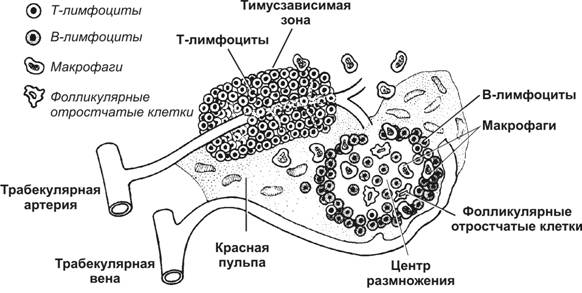
Сеть лимфатических узлов фильтрует антиген из интерстициальной жидкости и лимфы. Лимфатические узлы появляются в конце 2-го–начале 3-го месяцев внутриутробного развития, расположены преимущественно в области разветвлений лимфатических сосудов и всегда присутствуют в таких анатомических областях как шея, подмышечная впадина, паховая область, средостение, брюшная полость. Лимфатический узел (рис. 11-16, 11-16А) имеет округлую или почковидную форму размером 2-10 мм, снаружи покрыт соединительнотканной капсулой, от которой отходят трабекулы. Лимфа поступает в узел через несколько приносящих лимфатических сосудов. Через ворота (hilus) узла проходят кровеносные и выносящий лимфатический сосуд. В лимфатическом узле различают корковую и мозговую части, а также синусы. На границе между корковой и мозговой частями расположена тимус-зависимая паракортикальная зона. В лимфатическом узле T–лимфоциты взаимодействуют с B–лимфоцитами и фолликулярными отростчатыми клетками. Из паренхимы лимфатического узла лимфоциты поступают в выносящий лимфатический сосуд. В лимфатическом узле происходит созревание В- и T–клеток, в результате которого B–лимфоциты приобретают способность продуцировать АТ, T–хелперы — поддерживать цитокинами взаимодействие иммунокомпетентных клеток, а цитотоксические T–лимфоциты — уничтожать инфицированные и опухолевые клетки.
Рис. 11-16. Лимфатический узел разделён на корковую и мозговую части. В корковой части расположены лимфатические фолликулы, от которых в мозговую часть отходят мозговые тяжи. Тимус-зависимая паракортикальная зона заштрихована. [17]
Рис. 11-16А. Лимфатический узел. В корковом веществе присутствуют лимфатические фолликулы (1), от которых в мозговое вещество направляются мякотные тяжи (2). Хорошо видна капсула (3) с отходящими от неё трабекулами. Окраска гематоксилином и эозином.
Корковая часть
Корковая часть — B–клеточная зона. По периферии лимфатического узла, в корковой его части, расположены многочисленные лимфатические фолликулы и корковые синусоиды.
Лимфатические фолликулы
В их ретикулярной строме располагаются B–лимфоциты, дендритные клетки и макрофаги. В центральной части активированного фолликула присутствует светлая зона — центр размножения (зародышевый центр), — окружённая мантией из лимфоцитов. Присутствующие здесь B–клетки в большом количестве содержат IgM и IgD. Активированные фолликулы с зародышевыми центрами имеют два типа дендритных клеток: фолликулярные отростчатые клетки, которые представляют нативный антиген B–лимфоцитам, и CD11c+-клетки, процессирующие антиген и представляющие его фрагмент T–хелперам. Обычно в центре размножения B–клетки представляют антиген T–лимфоцитам, но здесь дендритные клетки являются более мощными антиген-представляющими клетками, чем B–лимфоциты; кроме того, дендритные клетки могут поддерживать взаимодействие Т- и B–лимфоцитов в центре размножения.
В зародышевом центре B–лимфоциты постоянно вступают в апоптоз. Но если B–лимфоцит встречается со своим антигеном и в пределах светлой зоны зародышевого центра взаимодействует с активированным T–лимфоцитом (молекула CD40 B–лимфоцита с молекулой CD40L T–лимфоцита), пришедшим сюда из тимус-зависимых зон вторичных лимфоидных органов, то апоптоз этого B–лимфоцита откладывается, и клетка начинает активно пролиферировать со скоростью, удваивающей здесь количество B–лимфоцитов каждые 6 часов. Пролиферирующие B–клетки смещают неактивированные B–лимфоциты на периферию и в совокупности образуют тёмную зону. Часть пролиферирующих B–клеток дифференцируется в плазматические клетки.
Селекция B–клеток в зародышевом центре
Зародышевый центр — специализированная структура лимфатических фолликулов, появление которого сопровождает иммунный ответ. В тёмной зоне центра в B–клетках осуществляется процесс соматической рекомбинации генов иммуноглобулинов. Этому процессу сопутствует негативная селекция B–клеток в светлой зоне. Путём FAS-опосредованного апоптоза удаляются клетки, B–клеточный рецептор которых в результате соматической рекомбинации приобрёл свойство связываться с антигеном при низкой аффинности. В B–клетках экспрессия гена FAS достигает максимума, когда клетки находятся именно в зародышевом центре, где протекает их негативная селекция. B–клетки входят в зародышевый центр с уже активированной программой FAS-опосредованного апоптоза. Массовую гибель B–клеток в зародышевом центре сдерживает мощный ингибитор апоптоза белок C-FLIP. Регуляция экспрессии C-FLIP осуществляется через B–клеточный рецептор и молекулу CD40.
Транспорт хемокинов, цитокинов и антигенов в лимфатическом узле. Пространство между отростками ретикулярных клеток и ретикулиновыми волокнами формирует кондуит, обеспечивающий диффузию хемокинов, цитокинов и антигенов из лимфатических сосудов в периваскулярное пространство. Кондуит способствует быстрому транспорту молекул через лимфатическую систему к Аг-представляющим фолликулярным дендритным клеткам, макрофагам и посткапиллярным венулам, через которые происходит миграция лимфоцитов из кровеносного русла. Хемокины модулируют адгезивные свойства высоких эндотелиальных клеток посткапиллярных венул, стимулируя выход лимфоцитов из кровеносных сосудов в паракортикальную зону лимфатического узла.
Мозговая часть
Центральная часть узла содержит мозговые тяжи и синусоиды. Мозговые тяжи образованы скоплением Т- и B–лимфоцитов, плазматических клеток, многочисленных макрофагов. Большинство клеток в тяжах — мигранты из корковой части.
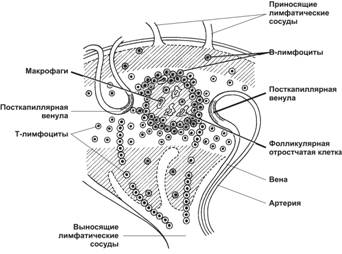
Тимус-зависимая зона
Тимус-зависимая зона — паракортикальная зона лимфатического узла (рис. 11-17). В тимус-зависимой зоне большинство клеток готово к реакции с антигеном. T–лимфоциты располагаются преимущественно в этой зоне, откуда они мигрируют в мозговые синусы и поступают в выносящий лимфатический сосуд. Эта зона содержит многочисленные антигенпредставляющие (дендритные) клетки, экспрессирующие на своей поверхности большое количество молекул MHC класса II (рис. 11-18). В этой же зоне присутствуют посткапиллярные венулы с кубическими (высокими) эндотелиальными клетками, где происходит хоминг лимфоцитов — именно здесь из циркуляции в лимфатический узел поступают В- и T–лимфоциты. Через стенку этих венул в лимфатический узел за 1 с поступает до 10 000 лимфоцитов. Венулы с кубическим эндотелием — характерная морфологическая особенность всех вторичных лимфоидных органов, кроме селезёнки.
В паракортикальной зоне активируются цитотоксические T–лимфоциты. Здесь они распознают антиген на поверхности инфицированных вирусом макрофагов или дендритных клеток (рис. 11-18) и служат мишенями воздействия цитокинов из активированных TH-клеток. Будучи активированными, цитотоксические T–лимфоциты пролиферируют и рециркулируют, часть из них вновь поступает во вторичные лимфоидные органы с последующей возможной активацией, а другая часть выходит из крови в ткань для уничтожения инфицированных вирусом клеток.
Рис. 11-17. Распределение Т- и B–лимфоцитов в лимфатическом узле. Тимус-зависимая зона — светлая. Тимус-независимая зона заштрихована. T–лимфоциты поступают в паренхиму узла из посткапиллярных венул и вступают в контакт с фолликулярными отростчатыми клетками и B–лимфоцитами. [17]
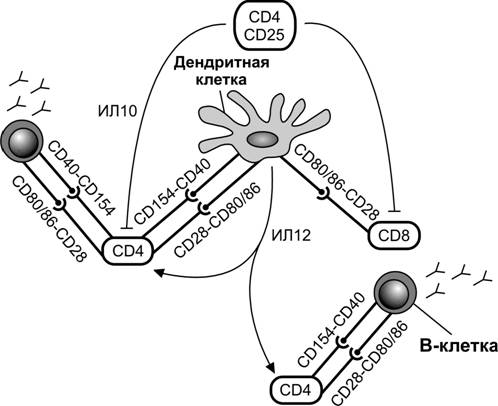
Рис. 11-18. Взаимодействие дендритной клетки с клеточными партнерами в лимфатическом узле. Молекула CD40, принадлежащая B–лимфоцитам и дендритным клеткам играет важную роль в их коммуникации с CD4+-клетками. Продуцируемый CD4+CD25+-клетками ИЛ10, действуя опосредованно через CD4+- и CD8+-клетки, сдерживает активацию дендритных клеток на начальных стадиях. Секретируемый дендритными клетками ИЛ12 поддерживает активность CD4+-клеток. [63]
Синусы
Под капсулой расположен краевой синус, куда поступает лимфа из приносящих лимфатических сосудов. Краевой синус через промежуточные синусы переходит в синусы мозгового вещества, а из них лимфа по выносящему лимфатическому сосуду в области ворот выходит из органа.
Селезёнка закладывается на 5-й неделе внутриутробного развития, снаружи покрыта соединительнотканной капсулой, содержащей ГМК и большое количество эластина. От капсулы отходят трабекулы. В паренхиме органа различают белую и красную пульпу (рис. 11-19). В отличие от всех других вторичных лимфоидных органов селезёнка не содержит венул с высоким эндотелием и не имеет приносящих лимфатических сосудов, поэтому антиген попадает в орган только через кровь. Следовательно, селезёнка является фильтром для патогенов, циркулирующих в крови.
Красная пульпа
Красная пульпа представлена синусами и тяжами, содержащими ретикулярные клетки макрофаги, эритроциты, тромбоциты, гранулоциты, лимфоциты и многочисленные плазматические клетки. В ретикулярной строме красной пульпы преобладают эритроциты, и присутствуют многочисленные макрофаги, уничтожающие отжившие эритроциты.
Белая пульпа
Белая пульпа — совокупность лимфоидной ткани селезёнки, представленная скоплениями T–лимфоцитов вокруг артерий, выходящих из трабекул, и артериол (тимус-зависимая зона). Лимфатические фолликулы — тимус-независимая зона (рис. 11-19А). После взаимодействия в тимус-зависимой зоне с антиген-представляющими клетками T–лимфоциты перемещаются в лимфатические фолликулы, где активируют B–лимфоциты.
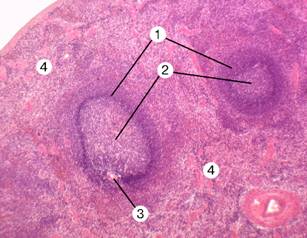
Рис. 11-19. Селезёнка. Белая пульпа (островки сине-фиолетового цвета) — совокупность лимфатических фолликулов (1). В фолликулах видны центры размножения (2); центральная артерия (3) лежит несколько эксцентрично от геометрического центра фолликула. Красная пульпа (4) — участки розово-красного цвета — содержит многочисленные эритроциты. Окраска гематоксилином и эозином.
Рис. 11-19А. Тимус-зависимая и тимус-независимая зоны селезёнки. Скопление T–лимфоцитов (светлые клетки) вокруг артерий, вышедших из трабекул, образует тимус-зависимую зону. Лимфатический фолликул и окружающая его лимфоидная ткань белой пульпы — тимус-независимая зона. Здесь присутствуют B–лимфоциты (тёмные клетки), макрофаги и фолликулярные отростчатые клетки. [17]
Лимфатический фолликул
Центр размножения
В центральной части фолликулов (центр размножения, или реактивный центр) присутствуют макрофаги, фолликулярные отростчатые клетки и B–лимфоциты. Скопления B–лимфоцитов расположены и по периферии фолликула.
Краевая зона
Краевая зона (рис. 11-19) — граница между фолликулом и красной пульпой. Здесь присутствуют многочисленные активно фагоцитирующие макрофаги, антигенпредставляющие клетки, медленно рециркулирующие B–лимфоциты и NK–клетки. Во внутренней части краевой зоны расположены синусы, куда поступает кровь из артериальных сосудов фолликула. В краевой зоне кровь вступает в контакт с паренхимой органа. Здесь из кровеносного русла в ткань выходят Т- и B–лимфоциты, распределяющиеся по специфическим для каждого клеточного типа зонам селезёнки.
Кровообращение
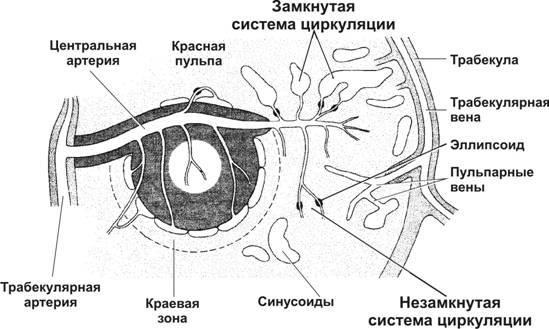
Артерии, входящие в ворота органа (рис. 11-19, 11-20, 11-21), разветвляются на более мелкие трабекулярные артерии. Они покидают трабекулы и входят в пульпу (пульпарные артерии).
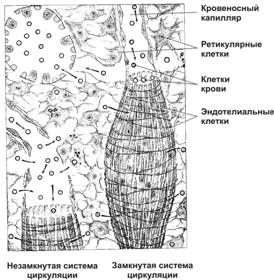
Рис. 11-20. Синусоиды в красной пульпе селезёнки. По теории незамкнутой циркуляции (слева), кровь из капилляров поступает в красную пульпу, а затем — в синусоиды. По теории замкнутой циркуляции (справа), капилляры открываются прямо в синусоиды. [17]
Рис. 11-21. Кровоток в селезёнке. Трабекулярные артерии ® пульпарные артерии ® артериолы и капилляры фолликула ® синусы краевой зоны ® выход Т- и B–лимфоцитов из сосудистого русла. Артериолы фолликула ® кисточковые артериолы красной пульпы ® капилляры-синусоиды. [17]
Центральные артерии
От пульпарных артерий в фолликулы отходят артериолы (традиционно называемые центральными артериями), разветвляющиеся на капилляры в составе фолликулов белой пульпы. Тимус-зависимая зона — муфты из T–лимфоцитов, окружающие эти ветви пульпарных артерий.
Кисточковые артериолы
Центральные артерии выходят из фолликула в красную пульпу и делятся на расходящиеся ветви — кисточковые артериолы, входящие в состав эллипсоидов. Эллипсоиды содержат скопления макрофагов, окружающих сосуды. В пределах эллипсоидов артериолы переходят в капилляры. По теории незамкнутой циркуляции, кровь из капилляров поступает в ретикулярную ткань красной пульпы, а затем — в синусоиды. По теории замкнутой циркуляции, капилляры открываются прямо в синусоиды. С использованием таннина–осмия и сканирующей электронной микроскопии показано, что артериальное русло заканчиваются образованием одной или двух концевых пор диаметром 3–4 мкм, которые открываются в окружающую ретикулярную ткань в пределах селезёночных тяжей в красной пульпе и краевой зоны лимфатических фолликулов белой пульпы. Эндотелиальные клетки терминальной части артериального отдела образуют расширения с отверстиями между клетками диаметром 1–2 мкм, через которые могут проходить эритроциты. Сканирующая электронная микроскопия кровеносных сосудов, заполненных метакрилатом, выявила присутствие концов артерий не в синусах, а в ретикулуме тяжей. Приведённые данные подтверждают теорию незамкнутой циркуляции селезёнки.
Синусоиды
Ретикулярная строма красной пульпы пронизана синусоидами диаметром до 40 мкм. Эндотелиальные клетки синусоидов расположены продольно и выпячиваются в просвет сосудов. Между эндотелиальными клетками имеются продольные щели, через которые проходят форменные элементы крови.
Венозный отток
Кровь из синусоидов поступает в пульпарные вены, далее в трабекулярные вены к воротам органа.
Функции
Селезёнка продуцирует Ig. После спленэктомии наблюдают cнижение уровня cывороточных АТ.
Cелезёнка — место образования гуморальных факторов, влияющих на систему мононуклеарных фагоцитов. Тафтсин — тетрапептид, стимулирующий активность фагоцитов. У лиц без селезёнки циркулирующего в крови тафтсина мало, отсюда и снижение резистентности к инфекциям. Спленин — функциональный аналог тимопоэтина.
Фагоцитоз повреждённых и старых эритроцитов и тромбоцитов. Закончившие жизненный цикл эритроциты и тромбоциты распознаются и фагоцитируются макрофагами. Этот процесс протекает в красной пульпе.
Селезёнка — депо эритроцитов, гранулоцитов и тромбоцитов.
Лимфоидная ткань в слизистой оболочке
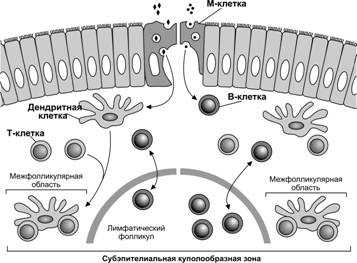
Слизистая оболочка ЖКТ, воздухоносных и мочевыделительных путей содержит значительное количество ретикулиновых волокон, одного из элементов поддерживающего каркаса органов кроветворения. Здесь, как правило, скапливаются лимфоциты, зачастую формирующие лимфатические фолликулы. Типичным примером лимфоидной ткани в слизистой оболочке являются пейеровы бляшки. В них присутствуют венулы с высоким эндотелием, через стенку которых в бляшку поступают лимфоциты. Бляшка имеет выносящие, но (в отличие от лимфатического узла) не имеет приносящих лимфатических сосудов. Антиген из просвета кишки «подаётся» в бляшку при помощи М-клеток. Собственный слой слизистой оболочки содержит дендритные клетки, отростки которых проникают в эпителий. Они так же, как и М-клетки, взаимодействуют с бактериальной микрофлорой.
Поверхность слизистой оболочки в дыхательной и пищеварительной системах защищена слизью, дефензинами и секреторным IgA. Транспорт, процессинг и представление антигена осуществляются при тесном взаимодействии организованной лимфоидной ткани и ассоциированного с фолликулами эпителия. Периферия лимфатических фолликулов в слизистой оболочке содержат большое количество T–лимфоцитов. В фолликулах присутствуют также B–клетки, дендритные клетки и венулы с высоким эндотелием. В кишке эндотелий подобных венул экспрессирует слизистый адрессин MadCAM-1, который распознаётся клетками, несущими рецептор хоминга a4b7 интегрин. Молекулу MadCAM-1 распознают также неактивированные лимфоциты, экспрессирующие L-селектин. В пейеровых бляшках каждый фолликул отделён от эпителия субэпителиальной куполообразной зоной, богатой Т-, B–лимфоцитами и дендритными клетками. Ассоциированный с фолликулами эпителий содержит М-клетки, которые транспортируют чужеродные макромолекулы и микроорганизмы к антигенпредставляющим клеткам, расположенным по другую сторону эпителиального барьера.
М-клетка — типичная эпителиальная клетка с полярной дифференцировкой, формирующая плотные контакты. Отличительной её особенностью является наличие расположенного в базолатеральной части инвагинированного субдомена, который увеличивает поверхность клетки и образует интраэпителиальный карман. С плазмолеммой этого кармана взаимодействуют интраэпителиальные лимфоциты при участии молекул адгезии. Мембрана апикальной части клетки не участвует в формировании всасывательной каёмки, имеет нерегулярные микроворсинки и микроскладки и приспособлена для прикрепления чужеродных молекул, частиц и микроорганизмов. Здесь же присутствуют области, участвующие в клатрин-опосредованном эндоцитозе окружённых лигандом частиц, молекул адгезии и вирусов. Апикальная часть клетки не покрыта гликокаликсом и лишена интегральных мембранных гидролитических ферментов. Карман, образованный М-клеткой, содержит В- и T–лимфоциты и реже дендритные клетки (рис. 11-22). Из T–клеток здесь в основном находятся CD4+-лимфоциты, большинство из которых экспрессирует маркёр CD45RO T–клеток памяти. Среди присутствующих в кармане B–лимфоцитов неактивированные B–клетки и B–клетки памяти, которые могут происходить из клеток, лежащих вне фолликулов.
Рис. 11-22. Роль М-клеток в трансэпителиальном переносе антигенов. В рамках первой (1) гипотезы макромолекулы и микроорганизмы могут быть захвачены дендритными клетками (ДК), расположенными в кармане М-клеток или субэпителиальной куполообразной зоне. Эти дендритные клетки могут процессировать или представлять антиген локально, мигрировать в соседние межфолликулярные области в собственном слое слизистой оболочки или в брыжеечные лимфатические узлы для взаимодействия с T–клетками (Т). Согласно другому предположению (2), макромолекулы и микроорганизмы связываются с B–клетками памяти (B) в кармане М-клеток с последующим представлением фрагментов антигена расположенным здесь же T–клеткам. [58]
Ассоциированный с фолликулами эпителий покрыт толстым гликокаликсом, который отличается от гликокаликса соседних энтероцитов. Специфический характер гликозилирования его молекул, связанный с особой экспрессией гликозилтрансферазы, важен для узнавания и адгезии микроорганизмов. Гликокаликс содержит меньшее количество связанных с мембраной гидролаз, участвующих в процессе пищеварения. Ассоциированный с фолликулами эпителий продуцирует меньше слизи и в криптах содержит меньшее количество продуцирующих дефензин и лизоцим клеток Панета. Этот эпителий лишён рецепторов Ig и неспособен транспортировать IgA из стенки кишки в её просвет (рис. 11-23). Всё это указывает на то, что ассоциированный с фолликулами эпителий специализирован для осуществления наилучшего контакта с антигенами, в том числе патогенами, находящимися на поверхности слизистой оболочки. В случае ассоциированного с фолликулами эпителия в подлежащей соединительной ткани собственного слоя слизистой оболочки отсутствуют миофибробласты, которые образуют практически сплошной слой под обычным эпителием ворсинок. Базальная мембрана здесь не имеет ламинина 2 и содержит большее количество пор и отверстий для усиленной миграции клеток в эпителий и из него. Ассоциированный с фолликулами эпителий пейеровых бляшек экспрессирует хемокин CCL20 (MIP-3a), который не экспрессируется эпителием других отделов тонкой кишки.
Рис. 11-23. Роль секреторного IgA в захвате антигенов М-клетками. Димер IgA продуцируется плазматическими клетками, локализованными в подэпителиальной соединительной ткани. Димер IgA передаётся в просвет кишки энтероцитами крипт, которые экспрессируют полимерные рецепторы IgA. Клетки ассоциированного с фолликулами эпителия не способны к подобному переносу, т.к. не имеют подобных рецепторов. Выделенный в просвет IgA связывается с антигеном в просвете кишки и образованный комплекс взаимодействует с апикальной поверхностью М-клетки через пока неидентифицированный рецепторный вход. Последующее поглощение образованного комплекса «антиген-IgA» может индуцировать или модулировать иммунный ответ в организованной лимфоидной ткани слизистой оболочки. [58]
Субэпителиальная куполообразная зона расположена тотчас под ассоциированным с фолликулами эпителием и представлена густой сетью дендритных клеток. В пейеровых бляшках эти клетки образуют по крайней мере три популяции. CD11c+CD8a+ клетки расположены в межфолликулярных Т-зависимых зонах. В самой зоне в подавляющем большинстве это CD11c+CD11b–CD8a– клетки и в меньшем количестве CD11c+CD11bint клетки. Все эти дендритные клетки являются неактивированными. Полагают, что они захватывают большинство антигенов, транспортируемых М-клетками через ассоциированный с фолликулами эпителий.
Локализация пейеровых бляшек в строго определённых участках пищеварительного тракта детерминирована генетически и прослеживается в плодном периоде. Сигнальными молекулами в морфогенезе пейеровых бляшек и других лимфоидных структур в слизистой оболочке служат рецепторы ИЛ7, представители семейства фактора некроза опухоли (TNF) и семейства его рецепторов.
В современной иммунологии [17а] лимфоидную ткань слизистых оболочек и кожи рассматривают как неинкапсулированную лимфоидную ткань. К ней относятся лимфоидная ткань слизистых оболочек, субпопуляция лимфоцитов печени и лимфоидная подсистема кожи.
· Лимфоидная ткань слизистых оболочек (MALT — mucosal–associated lymphoid tissue). В том числе:
Ú Лимфоидная ткань, ассоциированная с ЖКТ (GALT — gut–associated lymphoid tissue) — миндалины, аппендикс, пейеровы бляшки, а также субпопуляция внутриэпителиальных лимфоцитов слизистой оболочки ЖКТ.
Ú Лимфоидная ткань, ассоциированная с бронхами и бронхиолами (BALT — bronchus–associated lymphoid tissue), а также внутриэпителиальные лимфоциты слизистой оболочки дыхательной системы.
Ú Лимфоидная ткань, ассоциированная с женскими половыми путями (VALT — vulvovaginal–associated lymphoid tissue), а также внутриэпителиальные лимфоциты слизистой оболочки.
Ú Лимфоидная ткань, ассоциированная с носоглоткой (NALT — nose–associated lymphoid tissue), а также внутриэпителиальные лимфоциты слизистой оболочки.
· Субпопуляция лимфоцитов печени, которая в качестве лимфоидного барьера «обслуживает» кровь воротной вены, несущей все всосавшиеся в кишечнике вещества.
· Лимфоидная подсистема кожи — диссеминированные внутриэпителиальные лимфоциты и регионарные лимфатические узлы и сосуды лимфодренажа.