Глава 10
Сердце и кровеносные сосуды образуют замкнутую разветвлённую сеть — сердечно-сосудистую систему.
Кровеносные сосуды присутствуют почти во всех тканях. Их нет лишь в эпителиях, ногтях, хрящах, эмали зубов, в некоторых участках клапанов сердца и в ряде других областей, которые питаются за счёт диффузии необходимых веществ из крови. В зависимости от строения стенки кровеносного сосуда и его калибра, в сосудистой системе различают артерии, артериолы, капилляры, венулы и вены. Стенка артерий и вен состоит из трёх оболочек: внутренней (t. intima), средней (t. media) и наружной (t. adventitia).
Артерии — кровеносные сосуды, транспортирующие кровь от сердца. Стенка артерий амортизирует ударную волну крови (систолический выброс) и переправляет далее выбрасываемую с каждым ударом сердца кровь. Артерии, расположенные вблизи сердца (магистральные сосуды), испытывают наибольший перепад давления. Поэтому они обладают выраженной эластичностью. Периферические артерии имеют развитую мышечную стенку, способны изменять величину просвета, а следовательно, скорость кровотока и распределение крови в сосудистом русле.
План строения
Внутренняя оболочка. Поверхность t. intima выстлана пластом находящихся на базальной мембране плоских эндотелиальных клеток. Под эндотелием расположен слой рыхлой соединительной ткани (подэндотелиальный слой, или слой Лангханса).
Внутренняя эластическая мембрана (membrana elastica interna) отделяет внутреннюю оболочку сосуда от средней.
Средняя оболочка. В состав t. media, помимо соединительнотканного матрикса с небольшим количеством фибробластов, входят ГМК и эластические структуры (эластические мембраны и эластические волокна). Соотношение этих элементов — главный критерий классификации артерий: в артериях мышечного типа преобладают ГМК, а в артериях эластического типа — эластические элементы.
Наружная оболочка образована волокнистой соединительной тканью с сетью кровеносных сосудов (vasa vasorum) и сопровождающими их нервными волокнами (nervi vasorum, преимущественно терминальные ветвления постганглионарных аксонов симпатического отдела нервной системы).
Артерии эластического типа
К артериям эластического типа (рис. 10-1) относят аорту, лёгочный ствол, общую сонную и подвздошные артерии. В состав их стенки в большом количестве входят эластические мембраны и эластические волокна. Толщина стенки артерий эластического типа составляет примерно 15% диаметра их просвета.
Рис. 10-1. Аорта. Стенка построена из внутренней (1), средней (2) и наружной оболочек. Выраженная средняя оболочка содержит окончатые эластические мембраны (3). Окраска орсеином и пикроиндигокармином.
Внутренняя оболочка
Внутренняя оболочка представлена эндотелием и подэндотелиальным слоем.
Эндотелий. Просвет аорты выстлан крупными эндотелиальными клетками полигональной или округлой формы, связанными плотными и щелевыми контактами. В цитоплазме присутствуют электроноплотные гранулы, многочисленные светлые пиноцитозные пузырьки, митохондрии. В области ядра клетка выпячивается в просвет сосуда. Эндотелий отделён от подлежащей соединительной ткани хорошо выраженной базальной мембраной.
Подэндотелиальный слой содержит эластические, коллагеновые и ретикулиновые волокна (коллагены типа I и III), фибробласты, продольно ориентированные ГМК, микрофибриллы (коллаген типа VI). Микрофибриллы находятся в непосредственной близости от клеток и коллагеновых фибрилл, “заякоривая” их в межклеточном матриксе.
Средняя оболочка
Средняя оболочка имеет толщину около 500 мкм и содержит окончатые эластические мембраны, ГМК, коллагеновые и эластические волокна. Окончатые эластические мембраны имеют толщину 2–3 мкм, их около 50–75. С возрастом количество и толщина окончатых эластических мембран увеличиваются. Между эластическими мембранами располагаются спирально ориентированные ГМК. ГМК артерий эластического типа специализированы для синтеза эластина, коллагена и компонентов аморфного межклеточного вещества с высоким содержанием сульфатированных гликозаминогликанов. В средней оболочке аорты и лёгочного ствола присутствуют кардиомиоциты.
Наружная оболочка
Наружная оболочка содержит пучки коллагеновых и эластических волокон, ориентированных продольно или идущих по спирали. Адвентиция содержит мелкие кровеносные и лимфатические сосуды, а также миелиновые и безмиелиновые нервные волокна. Vasa vasorum кровоснабжают наружную оболочку и наружную треть средней оболочки. Ткани внутренней оболочки и внутренних двух третей средней оболочки питаются за счёт диффузии веществ из крови, находящейся в просвете сосуда.
Артерии мышечного типа
Их суммарный диаметр (толщина стенки + диаметр просвета) достигает 1 см, диаметр просвета варьирует от 0,3 до 10 мм. Артерии мышечного типа относят к распределительным (рис. 10-1А).
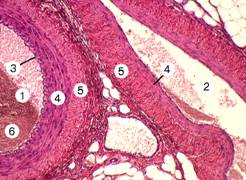
Рис. 10-1А. Артерия мышечного типа и сопровождающая вена. Артерия имеет зияющий круглый просвет (1), просвет вены — спавшийся, щелевидный (2). На границе внутренней и средней оболочек артерии видна волнистая тёмноокрашенная линия — внутренняя эластическая мембрана (3). Средняя оболочка (4), толстая в артерии и тонкая в вене, образована циркулярно ориентированными гладкомышечными клетками. Соединительнотканная волокнистая наружная оболочка (5) более выражена в вене. В просвете артерии виден тромб (6). Окраска гематоксилином и эозином.
Внутренняя эластическая мембрана не во всех артериях мышечного типа развита одинаково хорошо. Сравнительно слабо она выражена в артериях мозга и его оболочек, в ветвях лёгочной артерии, а в пупочной артерии полностью отсутствует.
Средняя оболочка содержит 10-40 плотно упакованных слоёв ГМК. ГМК ориентированы спирально, что обеспечивает регуляцию просвета сосуда в зависимости от тонуса ГМК. Вазоконстрикция (сужение просвета) происходит при сокращении ГМК средней оболочки. Вазодилатация (расширение просвета) происходит при расслаблении ГМК. Снаружи средняя оболочка ограничена наружной эластической мембраной, выраженной слабее, чем внутренняя. Наружная эластическая мембрана имеется лишь в крупных артериях; в артериях меньшего калибра она отсутствует.
Наружная оболочка в артериях мышечного типа развита хорошо. Внутренний её слой — плотная волокнистая соединительная ткань, а наружный — рыхлая соединительная ткань. Обычно в наружной оболочке присутствуют многочисленные нервные волокна и окончания, сосуды сосудов, жировые клетки. В наружной оболочке коронарных и селезёночной артерий присутствуют ориентированные продольно (по отношению к продольной оси сосуда) ГМК.
Полиморфность артерий
Структура некоторых артерий организована особым образом. Мозговые артерии имеют тонкую стенку и не содержат наружной эластической мембраны. В пупочных артериях мало эластических структур и преобладают ГМК, которые в средней оболочке образуют чётко различимые продольный и циркулярный слои.
Коронарные артерии относят к артериям мышечного типа. В большинстве участков этих сосудов эндотелий максимально приближен к внутренней эластической мембране. В участках ветвления внутренняя оболочка утолщена (особенно в раннем детском возрасте). Здесь присутствуют ГМК, вырабатывающие эластин.
Артериолы
Артерии мышечного типа переходят в артериолы — короткие сосуды, имеющие важное значение для регуляции артериального давления (АД). Стенка артериолы состоит из эндотелия, внутренней эластической мембраны, нескольких слоёв циркулярно ориентированных ГМК и наружной оболочки. Снаружи к артериоле прилегают периваскулярные соединительнотканные клетки, безмиелиновые нервные волокна, пучки коллагеновых волокон. В артериолах наименьшего диаметра внутренняя эластическая мембрана отсутствует, исключение составляют приносящие артериолы в почке; несмотря на свой малый диаметр (10-15 мкм), они имеют прерывистую эластическую мембрану. Отростки эндотелиальных клеток проходят через отверстия во внутренней эластической мембране и образуют с ГМК щелевые контакты.
Терминальная артериола содержит продольно ориентированные эндотелиальные клетки и непрерывный слой циркулярно ориентированных ГМК. Снаружи от ГМК расположены фибробласты.
Метартериола отходит от терминальной и во многих участках, разбросанных примерно вдоль первой половины сосуда, содержит циркулярно ориентированные ГМК.
Капилляры
Разветвлённая капиллярная сеть соединяет артериальное и венозное русла. Капилляры участвуют в обмене веществ между кровью и тканями. Общая обменная поверхность (поверхность капилляров и венул) составляет не менее 1000 м2, а в пересчёте на 100 г ткани — 1,5 м2. В регуляции капиллярного кровотока принимают непосредственное участие артериолы и венулы. Плотность капилляров в различных органах существенно варьирует. Так, на 1 мм3 миокарда, головного мозга, печени, почек приходится 2500–3000 капилляров; в скелетной мышце — 300–1000 капилляров; в соединительной, жировой и костной тканях их значительно меньше.
Типы капилляров
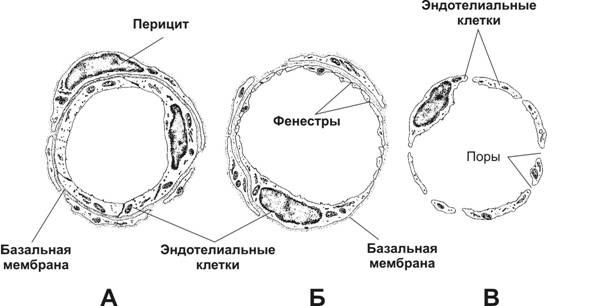
Стенка капилляра образована эндотелием, его базальной мембраной и перицитами. Различают три основных типа капилляров (рис. 10-1-1): с непрерывным эндотелием, с фенестрированным эндотелием и с прерывистым эндотелием.
Рис. 10-1-1. Типы капилляров: А — капилляр с непрерывным эндотелием, Б — с фенестрированным эндотелием, В — капилляр синусоидного типа. [17]
Капилляры с непрерывным эндотелием
Капилляры с непрерывным эндотелием — наиболее распространённый тип. Диаметр их просвета менее 10 мкм. Эндотелиальные клетки связаны при помощи плотных контактов, содержат множество пиноцитозных пузырьков, участвующих в транспорте метаболитов между кровью и тканями. Капилляры этого типа характерны для мышц.
Капилляры с фенестрированным эндотелием
Капилляры с фенестрированным эндотелием присутствуют в капиллярных клубочках почки, эндокринных железах, ворсинках кишки, в эндокринной части поджелудочной железы. Фенестра — истончённый участок эндотелиальной клетки диаметром 50–80 нм. Предполагают, что фенестры облегчают транспорт веществ через эндотелий. Наиболее чётко фенестры видны на электронограммах капилляров почечных телец.
Капилляр с прерывистым эндотелием
Капилляр с прерывистым эндотелием называют также капилляром синусоидного типа, или синусоидом. Подобный тип капилляров присутствует в кроветворных органах, состоит из эндотелиальных клеток с щелями между ними и прерывистой базальной мембраны.
Барьеры
Частный случай капилляров с непрерывным эндотелием — капилляры, формирующие гематоэнцефалический и гематотимический барьеры. Для эндотелия капилляров барьерного типа характерно умеренное количество пиноцитозных пузырьков и плотные контакты.
Гематоэнцефалический барьер
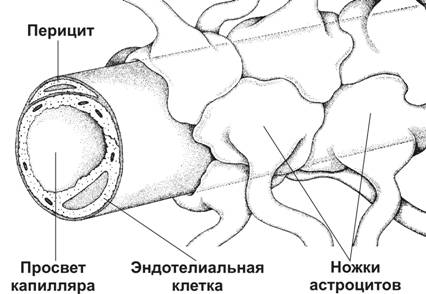
Гематоэнцефалический барьер (рис. 10-2) надёжно изолирует мозг от временных изменений состава крови. Непрерывный эндотелий капилляров — основа гематоэнцефалического барьера: эндотелиальные клетки связаны при помощи непрерывных цепочек плотных контактов. Снаружи эндотелиальная трубка покрыта базальной мембраной. Капилляры почти полностью окружены отростками астроцитов. Гематоэнцефалический барьер функционирует как избирательный фильтр. Наибольшей проницаемостью обладают вещества, растворимые в липидах (например, никотин, этиловый спирт, героин). Глюкоза транспортируется из крови в мозг при помощи соответствующих транспортёров. Особое значение для мозга имеет система транспорта тормозного нейромедиатора — аминокислоты глицина. Его концентрация в непосредственной близости от нейронов должна быть значительно ниже, чем в крови. Эти различия в концентрации глицина обеспечивают транспортные системы эндотелия.
Рис. 10-2. Гематоэнцефалический барьер образован эндотелиальными клетками капилляров мозга. Базальная мембрана, окружающая эндотелий, и перициты, а также астроциты, ножки которых полностью охватывают капилляр снаружи, не являются компонентами барьера. [17]
Микроциркуляторное русло
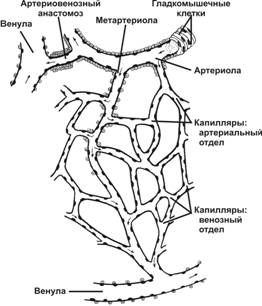
Совокупность артериол, капилляров и венул составляет структурно-функциональную единицу сердечно-сосудистой системы — микроциркуляторное (терминальное) русло (рис. 10-3). Терминальное русло организовано следующим образом: под прямым углом от терминальной артериолы отходит метартериола, пересекающая всё капиллярное русло и открывающаяся в венулу. От артериол берут начало анастомозирующие истинные капилляры, образующие сеть; венозная часть капилляров открывается в посткапиллярные венулы. В месте отделения капилляра от артериол имеется прекапиллярный сфинктер — скопление циркулярно ориентированных ГМК. Сфинктеры контролируют локальный объём крови, проходящей через истинные капилляры; объём же крови, проходящей через терминальное сосудистое русло в целом, определяется тонусом ГМК артериол. В микроциркуляторном русле присутствуют артериовенозные анастомозы, связывающие артериолы непосредственно с венулами или мелкие артерии с мелкими венами. Стенка сосудов анастомоза содержит много ГМК. Артериовенозные анастомозы в большом количестве присутствуют в некоторых участках кожи, где они играют важную роль в терморегуляции (мочка уха, пальцы).
Рис. 10-3. Микроциркуляторное русло. Артериола ® метартериола ® капиллярная сеть с двумя отделами — артериальный и венозный ® венула. Артериовенозные анастомозы соединяют артериолы с венулами. [17]
Вены
Кровь из капилляров терминальной сети последовательно поступает в посткапиллярные, собирательные, мышечные венулы и попадает в вены.
Венулы
Посткапиллярная венула
Посткапиллярная венула (диаметр от 8 до 30 мкм) служит обычным местом выхода лейкоцитов из циркуляции. По мере увеличения диаметра посткапиллярной венулы увеличивается количество перицитов, ГМК отсутствуют. Гистамин (через гистаминовые рецепторы) вызывает резкое увеличение проницаемости эндотелия посткапиллярных венул, что приводит к отёку окружающих тканей.
Собирательная венула
Собирательная венула (диаметр 30–50 мкм) имеет наружную оболочку из фибробластов и коллагеновых волокон.
Мышечная венула
Мышечная венула (диаметр 50–100 мкм) содержит 1–2 слоя ГМК, причём, в отличие от артериол, ГМК не полностью охватывают сосуд. В эндотелиальных клетках присутствует большое количество актиновых микрофиламентов, играющих важную роль для изменения формы клеток. Наружная оболочка сосуда содержит пучки коллагеновых волокон, ориентированных в различных направлениях, фибробласты. Мышечная венула переходит в мышечную вену, содержащую несколько слоёв ГМК.
Вены
Вены — сосуды, по которым кровь оттекает от органов и тканей к сердцу. Около 70% объёма циркулирующей крови находится в венах. В стенке вен, как и в стенке артерий, различают те же три оболочки: внутреннюю (интиму), среднюю и наружную (адвентициальную). Вены, как правило, имеют больший диаметр, чем одноимённые артерии. Их просвет, в отличие от артерий, не зияет (табл. 10-1). Стенка вены тоньше; средняя оболочка менее выражена, а наружная оболочка, напротив, более толстая, чем у одноимённых артерий (см. рис. 10-1А). Некоторые вены имеют клапаны. Большие вены, как и артерии крупного калибра, имеют vasa vasorum.
Внутренняя оболочка
Внутренняя оболочка состоит из эндотелия, снаружи от которого расположен подэндотелиальный слой (рыхлая соединительная ткань и ГМК). Внутренняя эластическая мембрана выражена слабо и часто отсутствует.
Средняя оболочка
Средняя оболочка вен мышечного типа содержит циркулярно ориентированные ГМК. Между ними располагаются преимущественно коллагеновые и в меньшем количестве эластические волокна. Количество ГМК в средней оболочке вен существенно меньше, чем в средней оболочке сопровождающей артерии. В этом отношении отдельно стоят вены нижних конечностей. Здесь (преимущественно в подкожных венах) средняя оболочка содержит значительное количество ГМК, во внутренней части средней оболочки они ориентированы продольно, а в наружной — циркулярно.
Таблица 10-1. Сравнительная морфологическая характеристика артерии мышечного типа и сопровождающей вены
|
Характеристика |
Артерия |
Вена |
|
Просвет |
Зияет |
Спавшийся |
|
Толщина стенки |
Толстая |
Тонкая |
|
Внутренняя оболочка |
Извилистая |
Гладкая |
|
Различимость слоёв |
Выражена |
Слабая |
|
Внутренняя эластическая мембрана |
Присутствует |
Слабо выражена или отсутствует |
|
Наружная оболочка |
Тонкая |
Толстая |
Полиморфность вен
Структура стенки различных вен характеризуется многообразием. Не во всех венах имеются все три оболочки. Средняя оболочка хорошо развита в венах конечностей, особенно нижних, и отсутствует во всех безмышечных венах — головного мозга, мозговых оболочек, сетчатки глаза, трабекул селезёнки, костей, в мелких венах внутренних органов. Верхняя полая вена, плече-головные и яремные вены содержат безмышечные участки (нет средней оболочки). Средняя и наружная оболочки отсутствуют в синусах твёрдой мозговой оболочки, а также в её венах. Средняя оболочка значительно развита в подкожных венах нижних конечностей. Во внутренней её части ГМК ориентированы продольно, а в толстой наружной части — циркулярно. В крупных венах выражен подэндотелиальный слой, в средней оболочке сравнительно мало ГМК, наружная оболочка значительно превосходит толщину остальных и в своей внутренней части содержит многочисленные продольно ориентированные пучки ГМК.
Клапаны
Клапаны вен пропускают кровь только к сердцу; представляют собой складки интимы. Соединительная ткань образует структурную основу створок клапанов, а вблизи их фиксированного края располагаются ГМК. Клапаны отсутствуют в венах брюшной полости, грудной клетки, мозга, сетчатки и костей.
Венозные синусы
Это пространства в соединительной ткани, выстланные эндотелием. Заполняющая их венозная кровь не выполняет метаболическую функцию, а придаёт ткани особые механические свойства (упругость, эластичность и др.). Подобным образом организованы коронарные синусы, синусы твёрдой мозговой оболочки и кавернозных тел.
Сосудистые афференты
Изменения pO2, рСО2 крови, концентрация Н+, молочной кислоты, пирувата и ряда других метаболитов оказывают как локальные эффекты на стенку сосудов, так и регистрируются встроенными в стенку сосудов хеморецепторами, а также барорецепторами, реагирующими на давление в просвете сосудов. Эти сигналы достигают центров регуляции кровообращения и дыхания. Ответы ЦНС реализует двигательная вегетативная иннервация ГМК стенки сосудов и миокарда. Кроме того, существует мощная система гуморальных регуляторов ГМК стенки сосудов (вазоконстрикторы и вазодилататоры) и проницаемости эндотелия. Барорецепторы особенно многочисленны в дуге аорты и в стенке крупных вен, лежащих близко к сердцу. Эти нервные окончания образованы терминалями волокон, проходящих в составе блуждающего нерва. В рефлекторной регуляции кровообращения участвуют каротидный синус и каротидное тельце (рис. 10-4), а также подобные им образования дуги аорты, лёгочного ствола, правой подключичной артерии.
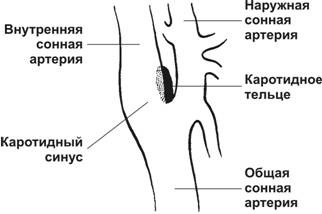
Каротидный синус
Каротидный синус расположен вблизи бифуркации общей сонной артерии, это расширение просвета внутренней сонной артерии тотчас у места её ответвления от общей сонной артерии. В области расширения средняя оболочка сосуда истончена, а наружная, напротив, утолщена. Здесь, в наружной оболочке, присутствуют многочисленные барорецепторы. Если учесть, что средняя оболочка сосуда в пределах каротидного синуса относительно тонка, то легко представить, что нервные окончания в наружной оболочке высокочувствительны к любым изменениям АД. Отсюда информация поступает в центры, регулирующие деятельность сердечно-сосудистой системы. Нервные окончания барорецепторов каротидного синуса — терминали волокон, проходящих в составе синусного нерва (Херинга) — ветви языкоглоточного нерва.
Рис. 10-4. Локализация каротидного синуса и каротидного тельца. Каротидный синус расположен в утолщении стенки внутренней сонной артерии вблизи бифуркации общей сонной артерии. Здесь же, тотчас в области бифуркации, находится каротидное тельце. [17]
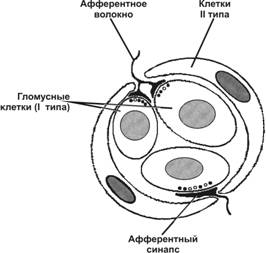
Рис. 10-5. Клубочек каротидного тельца состоит из 2–3 клеток типа I (гломусные клетки), окружённых клетками типа II. Клетки типа I образуют синапсы (нейромедиатор — дофамин) с терминалями афферентных нервных волокон. [17]
Каротидное тельце
Каротидное тельце (рис. 10-5) реагирует на изменения химического состава крови. Тельце расположено в стенке внутренней сонной артерии и состоит из клеточных скоплений, погружённых в густую сеть широких капилляров синусоидоподобного типа. Каждый клубочек каротидного тельца (гломус) содержит 2–3 гломусных клетки, или клетки типа I, а на периферии клубочка расположены 1–3 клетки типа II. Афферентные волокна для каротидного тельца содержат вещество P и относящиеся к кальцитониновому гену пептиды.
Клетки типа I
Клетки типа I образуют синаптические контакты с терминалями афферентных волокон. Для клеток типа I характерно обилие митохондрий, светлых и электронно-плотных синаптических пузырьков. Клетки типа I синтезируют ацетилхолин, содержат фермент синтеза этого нейромедиатора (холинацетилтрансфераза), а также эффективно работающую систему захвата холина. Физиологическая роль ацетилхолина остаётся неясной. Клетки типа I имеют н- и м-холинорецепторы. Активация любого из этих типов холинорецепторов вызывает или облегчает освобождение из клеток типа I другого нейромедиатора — дофамина. При снижении pO2 секреция дофамина из клеток типа I возрастает. Клетки типа I могут формировать между собой контакты, похожие на синапсы.
Эфферентная иннервация
На гломусных клетках заканчиваются волокна, проходящие в составе синусного нерва, и постганглионарные волокна из верхнего шейного симпатического ганглия. Терминали этих волокон содержат светлые (ацетилхолин) или гранулярные (катехоламины) синаптические пузырьки.
Функция
Каротидное тельце регистрирует изменения рСО2 и рО2, а также сдвиги рН крови. Возбуждение передаётся через синапсы на афферентные нервные волокна, по которым импульсы поступают в центры, регулирующие деятельность сердца и сосудов. Афферентные волокна от каротидного тельца проходят в составе блуждающего и синусного нервов (Херинга).
Главные клеточные типы сосудистой стенки
Гладкомышечная клетка
Просвет кровеносных сосудов уменьшается при сокращении ГМК средней оболочки или увеличивается при их расслаблении, что изменяет кровоснабжение органов и величину АД.
ГМК сосудов имеют отростки, образующие с соседними ГМК многочисленные щелевые контакты. Такие клетки электрически сопряжены, через щелевые контакты возбуждение (ионный ток) передаётся от клетки к клетке. Это обстоятельство важно, т.к. в контакте с двигательными терминалями находятся только ГМК, расположенные в наружных слоях t. media. ГМК стенки сосудов (в особенности артериол) имеют рецепторы к разным гуморальным факторам.
Вазоконстрикторы и вазодилататоры
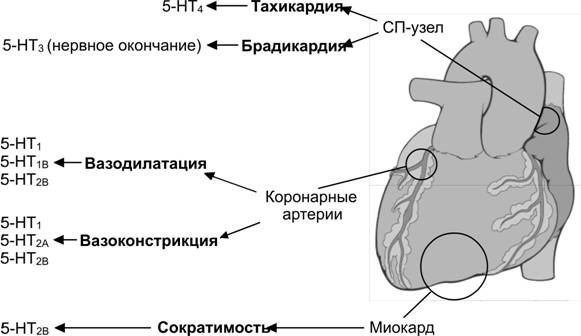
Эффект вазоконстрикции реализуется при взаимодействии агонистов с a-адренорецепторами (табл. 10-2, 10-4, 10-7), рецепторами серотонина, ангиотензина II, вазопрессина, тромбоксана. Стимуляция a-адренорецепторов приводит к сокращению ГМК сосудов. Норадреналин — по преимуществу агонист a-адренорецепторов. Адреналин — агонист a- и b-адренорецепторов. Если сосуд имеет ГМК с преобладанием a-адренорецепторов, то адреналин вызывает сужение просвета таких сосудов.
Таблица 10-2. Вазоактивные вещества
|
Вазоконстрикторы |
Вазодилататоры |
|
Ангиотензин II |
Брадикинины |
|
Аргинин вазопрессин |
Гистамин |
|
Катехоламины через a1-адренорецепторы |
Катехоламины через b2-адренорецепторы |
|
Серотонин |
Оксид азота |
|
Эндотелины |
Предсердный натриуретический пептид (ANP) |
|
|
Простагландины PGE2, PGI2 |
Вазодилататоры. Если в ГМК преобладают b-адренорецепторы, то адреналин вызывает расширение просвета сосуда. Агонисты, вызывающие в большинстве случаев расслабление ГМК: атриопептин, брадикинин, VIP, гистамин, относящийся к кальцитониновому гену пептид, простагландины, оксид азота (табл. 10-3).
Таблица 10-3. Вазодилататорное действие медиаторов, высвобождаемых вместе с ацетилхолином из постганглионарных парасимпатических волокон
|
Медиатор |
Второй посредник |
Главные мишени |
|
Вазоактивный интестинальный пептид (VIP) |
цАМФ |
Фосфорилирование киназы лёгкой цепи миозина |
|
Относящийся к кальцитониновому гену пептид |
цАМФ |
Фосфорилирование киназы лёгкой цепи миозина |
|
Оксид азота |
цГМФ ® Ca2+¯ |
цГМФ-зависимая протеинкиназа |
Таблица 10-4. Сигнальные каскады (рецепторы и G–белки) для наиболее значимых вазоактивных веществ
|
Агонист |
Рецептор |
Активируемая a субъединица G–белка |
|
Ангиотензин I |
AT1 |
Gaq |
|
Ангиотензин II |
AT2 |
Gai |
|
Предсердный натриуретический пептид (ANP) |
|
Gaq |
|
Эндотелин-1 |
ETА |
Gaq |
|
Катехоламины |
a-адренорецептор |
Gaq |
|
Катехоламины |
b-адренорецептор |
Gas |
|
Ацетилхолин |
м-холинорецептор |
Gai |
Двигательная вегетативная иннервация
Вегетативная нервная система регулирует величину просвета сосудов.
Адренергическая иннервация расценивается как преимущественно сосудосуживающая. Сосудосуживающие симпатические волокна (рис. 10-5А) обильно иннервируют мелкие артерии и артериолы кожи, скелетных мышц, почек и чревной области. Плотность иннервации одноимённых вен значительно меньше. Сосудосуживающий эффект реализуется при помощи норадреналина — агониста a-адренорецепторов.
Рис. 10-5А. Симпатическая иннервация сосудов. Видны терминальные разветвления симпатических волокон, окружающих артериолу. Лёгкая исчерченность артериолы обусловлена циркулярно ориентированными гладкомышечными клетками. Импрегнация азотнокислым серебром по Бильшовскому–Гросс.
Холинергическая иннервация. Парасимпатические холинергические волокна иннервируют сосуды наружных половых органов. При половом возбуждении вследствие активации парасимпатической холинергической иннервации происходит выраженное расширение сосудов половых органов и увеличение в них кровотока. Холинергический сосудорасширяющий эффект прослежен также в отношении мелких артерий мягкой мозговой оболочки.
Пролиферация
Численность популяции ГМК сосудистой стенки контролируют факторы роста и цитокины. Так, цитокины макрофагов и B–лимфоцитов (трансформирующий фактор роста b, ИЛ1, g-ИФН) сдерживают пролиферацию ГМК. Эта проблема имеет важное значение при атеросклерозе, когда пролиферация ГМК усиливается под действием факторов роста, вырабатываемых в сосудистой стенке [фактор роста из тромбоцитов (PDGF), щелочной фактор роста фибробластов (bFGF), инсулиноподобный фактор роста 1 (IGF-1) и фактор некроза опухоли a (TNFa)].
Фенотипы ГМК
Различают два варианта ГМК сосудистой стенки: сократительный и синтетический.
Сократительный фенотип. ГМК имеют многочисленные миофиламенты и отвечают на воздействие вазоконстрикторов и вазодилататоров. Гранулярная эндоплазматическая сеть в них выражена умеренно. Подобные ГМК не способны к миграции и не вступают в митозы, т.к. нечувствительны к эффектам факторов роста.
Синтетический фенотип. ГМК имеют хорошо развитые гранулярную эндоплазматическую сеть и комплекс Гольджи; клетки синтезируют компоненты межклеточного вещества (коллаген, эластин, протеогликан), цитокины и факторы роста. ГМК в области атеросклеротического поражения сосудистой стенки перепрограммируются с сократительного на синтетический фенотип. При атеросклерозе ГМК вырабатывают факторы роста [например, фактор роста из тромбоцитов (PDGF), щелочной фактор роста фибробластов (bFGF)], усиливающие пролиферацию соседних ГМК.
Регуляция фенотипа ГМК. Эндотелий вырабатывает и секретирует гепариноподобные вещества, поддерживающие сократительный фенотип ГМК. Факторы паракринной регуляции, продуцируемые эндотелиальными клетками, контролируют тонус сосудов. Среди них — производные арахидоновой кислоты (простагландины, лейкотриены и тромбоксаны), эндотелин-1, оксид азота NO и др. Одни из них вызывают вазодилатацию (например, простациклин, оксид азота NO), а другие — вазоконстрикцию (например, эндотелин-1, ангиотензин II). Недостаточность NO вызывает повышение АД, образование атеросклеротических бляшек; избыток NO может привести к коллапсу.
Эндотелиальная клетка
Стенка кровеносного сосуда очень тонко реагирует на изменения гемодинамики и химического состава крови. Своеобразным чувствительным элементом, улавливающим эти изменения, является эндотелиальная клетка, которая с одной стороны омывается кровью, а другой обращена к структурам сосудистой стенки.
Эндотелий — тонкий слой плоских клеток, образует внутреннюю выстилку всех кровеносных сосудов и камер сердца. Стенка мелких кровеносных сосудов и капилляров представлена только этим клеточным типом. Общее количество эндотелиальных клеток в организме достигает 6´1013 и составляет по весу 1 кг. Эндотелиальные клетки содержат тельца Вайбеля–Паладе, окружённые мембраной удлинённые структуры шириной 0,1 мкм и длиной 3 мкм. Тельца содержат фактор фон Виллебранда и Р-селектин. Эндотелиальные клетки не только образуют селективный барьер проницаемости, который контролирует транспорт веществ из крови в ткань и в обратном направлении, но и участвуют в выполнении многих других функций. Эндотелий продуцирует молекулы внеклеточного матрикса, участвует в переходе лейкоцитов из крови в ткань (рис. 10-6 и 10-7), связан с процессами вазоконстрикции и вазодилатации, свёртывания крови (образовании тромба и фибринолизе), формирования новых кровеносных сосудов (ангиогенеза), иммунного ответа и воспаления. В клубочках почки и гематоэнцефалическом барьере эндотелий специализирован на выполнение функции клеточного фильтра. Наиболее значимые внутриклеточные сигнальные пути для адгезии и выживания эндотелия показаны на рисунке 10-8.
Функции эндотелия нарушаются при сосудистых заболеваниях и при наиболее распространённом из них — атеросклерозе. Один из ключевых механизмов дисфункции эндотелия связан со снижением уровня оксида азота часто вследствие повышения содержания диметиларгинина, который угнетает процесс образования оксида азота из L-аргинина.
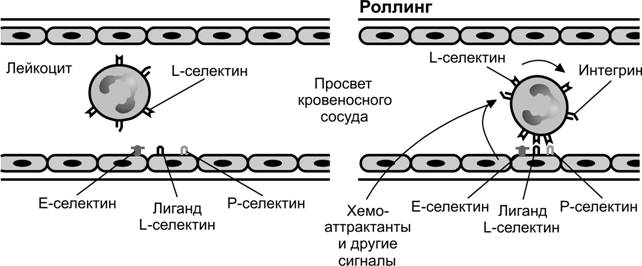
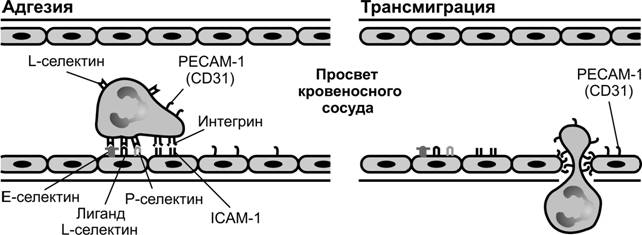
Рис. 10-6. Взаимодействие клеток крови с эндотелиальными клетками малых кровеносных сосудов. Лейкоцит формирует временные адгезионные контакты с эндотелиальной клеткой. В образовании контактов участвуют белки семейства селектинов: E-селектин на поверхности эндотелиальной клетки, P-селектин на поверхности эндотелиальной клетки и тромбоцита, L-селектин на поверхности многих лейкоцитов. [97]
Рис. 10-7. Адгезия клеток крови и эндотелия и последующая трансмиграция клеток крови через эндотелий. В адгезии участвуют со стороны эндотелиальных клеток представители надсемейства Ig молекулы ICAM-1 и VCAM-1, со стороны лейкоцитов интегрины VLA-4, LFA-1. В диапедезе лейкоцитов через стенку венул участвует молекула PECAM-1 (CD31), также принадлежащая надсемейству Ig. [97]
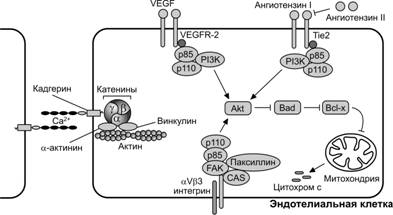
Рис. 10-8. Межклеточные взаимодействия и сигналы в эндотелии. Эндотелиальные клетки используют молекулы адгезии, такие как интегрины и селектины, для прикрепления друг к другу и для связи с внеклеточным матриксом. Сосудистый эндотелиальный кадгерин участвует в Ca2+-зависимом взаимодействии соседних клеток и в образовании барьера проницаемости. Короткий цитоплазматический хвост молекулы сосудистого эндотелиального кадгерина взаимодействует с плакоглобиновым комплексом (a-, b- и g–катенин). В свою очередь, данный комплекс взаимодействует с a–актинином и винкулином и через эти посредники интегрируется в актиновый цитоскелет. Сосудистый эндотелиальный кадгерин вместе с рецептором сосудистого эндотелиального фактора роста 2 (VEGFR-2, или Flk-1) через фосфоинозитол-3-киназа/протеинкиназа Akt сигнальный путь поддерживают выживание эндотелиальных клеток. В адгезии эндотелиальных клеток с молекулами внеклеточного матрикса участвуют поверхностные гетеродимерные интегрины (например, aVb3). Взаимодействие интегринов с молекулами внеклеточного матрикса активирует молекулы фокальных адгезионных контактов, таких как киназа фокального контакта. Активированная киназа рекрутирует молекулу Src, которая фосфорилирует киназу фокального контакта с последующей мобилизацией таких сигнальных молекул, как фосфатидилинозитол-3-киназа и паксиллин для поддержания фокальных адгезионных контактов. Выживание эндотелиальной клетки поддерживается не только с участием молекулярных механизмов, связанных с фокальными адгезионными контактами. Сигналы, действующие через рецепторы, связанные с тирозинкиназами, такие как сосудистый эндотелиальный фактор роста VEGF (рецептор VEGFR-2) и ангиопоэтин-1 (рецептор Tie2), также поддерживают выживание эндотелиальной клетки. [101]
Свёртывание крови. Эндотелиальная клетка — важный компонент процесса гемокоагуляции. На поверхности эндотелиальных клеток может происходить активация протромбина факторами свёртывания. С другой стороны, эндотелиальная клетка проявляет антикоагуляционные свойства. Прямое участие эндотелия в свёртывании крови состоит в секреции эндотелиальными клетками некоторых плазменных факторов свёртывания (например, фактора VIII, или фактора фон Виллебранда). В нормальных условиях эндотелий слабо взаимодействует с форменными элементами крови, как и с факторами свёртывания крови. Эндотелиальная клетка вырабатывает простациклин PGI2, тормозящий адгезию тромбоцитов.
Восстановление кровотока при тромбозе. Воздействие лигандов (АДФ и серотонин, тромбин) на эндотелиальную клетку стимулирует секрецию NO. Его мишени — расположенные поблизости ГМК. В результате расслабления ГМК просвет сосуда в области тромба увеличивается, и кровоток может восстановиться. К аналогичному эффекту приводит активация других рецепторов эндотелиальной клетки: гистамина, м-холинорецепторов, a2-адренорецепторов.
Факторы роста и цитокины. Эндотелиальные клетки синтезируют и секретируют факторы роста и цитокины, влияющие на поведение других клеток сосудистой стенки. Этот аспект имеет важное значение в механизме развития атеросклероза, когда в ответ на патологическое воздействие со стороны тромбоцитов, макрофагов и ГМК эндотелиальные клетки вырабатывают фактор роста из тромбоцитов (PDGF), щелочной фактор роста фибробластов (bFGF), инсулиноподобный фактор роста 1 (IGF-1), ИЛ1, TGFb. С другой стороны, эндотелиальные клетки являются мишенями факторов роста и цитокинов. Например, митозы эндотелиальных клеток индуцируются щелочным фактором роста фибробластов (bFGF), а пролиферацию только эндотелиальных клеток стимулирует фактор роста эндотелиальных клеток, вырабатываемый тромбоцитами. Цитокины из макрофагов и B–лимфоцитов — TGFb, ИЛ1 и g-ИФН — угнетают пролиферацию эндотелиальных клеток.
Процессинг гормонов. Эндотелий участвует в модификации циркулирующих в крови гормонов и других биологически активных веществ. Так, в эндотелии сосудов лёгких происходит конверсия ангиотензина I в ангиотензин II.
Инактивация биологически активных веществ. Эндотелиальные клетки метаболизируют норадреналин, серотонин, брадикинин, простагландины.
Расщепление липопротеинов. В эндотелиальных клетках происходит расщепление липопротеинов с образованием триглицеридов и холестерина. В мембране эндотелия капилляров жировой ткани и скелетных мышц присутствует липопротеиновая липаза, расщепляющая триглицериды с образованием жирных кислот и глицерола.
Хоминг лимфоцитов. Венулы в паракортикальной зоне лимфатических узлов, миндалин, пейеровой бляшки подвздошной кишки, содержащих скопления лимфоцитов, имеют высокий эндотелий, экспрессирующий на своей поверхности т.н. сосудистый адрессин, узнаваемый молекулой CD44 циркулирующих в крови лимфоцитов. В этих областях лимфоциты прикрепляются к эндотелию и выходят из кровотока (хоминг).
Барьерная функция. Эндотелий контролирует проницаемость сосудистой стенки. Наиболее наглядно эта функция проявляется в гематоэнцефалическом и гематотимическом барьерах.
Поддержание гемопоэза. Эндотелий синусоидов костного мозга и сосудов пуповины поддерживает пролиферацию и дифференцировку стволовых кроветворных клеток. Эндотелиальные клетки из этих сосудов с встроенными генами тромбопоэтина, эритропоэтина, GM-CSF и некоторых других активных молекул (c-kit, flt3/flk-2) устойчиво стимулируют гемопоэз и рассматриваются как перспективный инструмент для активации стволовых клеток при их использовании с целью коррекции дефектов кроветворения.
Генез и поддержание популяции эндотелиальных клеток. Эндотелий происходит из мезодермальных клеток спланхноплевры. Во взрослом организме предполагается существование циркулирующей эндотелиальной стволовой клетки костномозгового происхождения. Её ранние коммитированные потомки (ангиобласты) составляют менее 1% в популяции всех CD34+-клеток из костного мозга, экспрессирует рецептор 2 сосудистого эндотелиального фактора роста (VEGFR-2) и антиген стволовой кроветворной клетки AC133. Ключевым фактором, поддерживающим дифференцировку эндотелиальных клеток из ранних клеток–предшественниц, служит сосудистый эндотелиальный фактор роста (VEGF).
Ангиогенез — процесс роста и ветвления уже существующих кровеносных сосудов. Ангиогенез следует отличать от васкулогенеза — формирования кровеносных сосудов de novo. Ангиогенез происходит как в нормальных условиях (например, в области фолликула яичника после овуляции), так и в патологических (при заживлении ран, росте опухоли, в ходе иммунных реакций; наблюдается при неоваскулярной глаукоме, ревматоидном артрите и т.д.). Для выживания клеток необходимы кислород и питательные вещества. Минимальное расстояние для эффективной диффузии газа от кровеносного сосуда (источник кислорода) до клетки составляет 100–200 мкм. В случае превышения этой величины образуются новые кровеносные сосуды. Ангиогенез вызывают низкое pO2, снижение pH или гипогликемия, механическое напряжение в ткани вследствие пролиферации клеток, инфильтрация ткани иммунокомпетентными или поддерживающими воспаление клетками, мутации (например, активация онкогенов или делеция генов супрессоров опухоли, контролирующих образование ангиогенных факторов).
Генез клеток сосудистой стенки
Образование кровеносных сосудов контролируют ангиогенные факторы. Это факторы роста, продуцируемые опухолями, компоненты внеклеточного матрикса, ангиогенные факторы, вырабатываемые самими эндотелиальными клетками (табл. 10-5). Ангиогенез стимулируют сосудистые эндотелиальные факторы роста (VEGF-A, -B, -C, -D, -E), ангиогенин, факторы роста фибробластов (aFGF — кислый и bFGF — щелочной), трансформирующие факторы роста a (TGFa) и b (TGFb), плацентарный фактор роста (PLGF), факторы роста из тромбоцитов (PDGF-A, B, C, D), фактор роста гепатоцитов (HGF), эндотелиальный фактор роста из тромбоцитов (PD–ECGF), фактор некроза опухоли a (TNFa), ИЛ8, ангиопоэтины 1 и 2, сфингозин 1-фосфат, оксид азота и др., всего более 20.
В ответ на действие ангиогенного фактора эндотелиальные клетки начинают размножаться и менять свой фенотип. Пролиферативная активность клеток может увеличиваться в 100 раз. Эндотелиальные клетки через собственную базальную мембрану проникают в прилежащую соединительную ткань, участвуя в формировании почки капилляра. По окончании действия ангиогенного фактора фенотип эндотелиальных клеток возвращается в исходное «спокойное» состояние. На более поздних стадиях ангиогенеза в ремоделировании сосуда участвует ангиопоэтин-1, с действием которого также связывают стабилизирующее влияние на сосуд.
Все ангиогенные факторы можно подразделить на две группы: первая — прямо действующие на эндотелиальные клетки и стимулирующие их митозы и подвижность, и вторая — факторы непрямого влияния, воздействующие на макрофаги, которые, в свою очередь, выделяют факторы роста и цитокины. К факторам второй группы относят, в частности, ангиогенин. В ответ на действие ангиогенного фактора эндотелиальные клетки начинают размножаться и менять свой фенотип. Пролиферативная активность клеток может увеличиваться в 100 раз. Эндотелиальные клетки через собственную базальную мембрану проникают в прилежащую соединительную ткань, участвуя в формировании почки капилляра. По окончании действия ангиогенного фактора фенотип эндотелиальных клеток возвращается в исходное «спокойное» состояние. На более поздних стадиях ангиогенеза в ремоделировании сосуда участвует ангиопоэтин-1, с действием которого также связывают стабилизирующее влияние на сосуд.
Сосудистый эндотелиальный фактор роста (VEGF)
Вначале VEGF был идентифицирован как фактор роста эндотелиальных клеток, стимулирующий ангиогенез и проницаемость сосудистой стенки. Позднее был выявлен ряд факторов с аналогичным действием, которые объединены в одно семейство. Оно включает VEGF-A (ранее просто VEGF), VEGF-B, VEGF-C, VEGF-D, VEGF-E и плацентарный фактор роста (PLGF). VEGF-A главным образом участвует в ангиогенезе. VEGF-C и VEGF-D вовлечены в генез лимфатических сосудов. Ангиогенное действие VEGF реализуется через эндотелиальную форму синтазы оксида азота. VEGF стимулирует активность этого фермента и, следовательно, образование оксида азота. VEGF играет важную роль в процессах эмбрионального развития, в ангиогенезе при заживлении ран и в ходе менструального цикла. VEGF обладает аутокринным действием в отношении опухолевых клеток, защищая их от гипоксии, хемо и радиотерапевтических воздействий. Ингибирование действия VEGF рассматривается как перспективный терапевтический подход в онкологии.
Молекулярные формы рецепторов VEGF
Известно несколько молекулярных форм рецепторов VEGF. Это VEGFR-1 (Flt-1), VEGFR-2 (Flk-1/KDR), VEGFR-3 (Flt-4), нейропилин-1 и нейропилин-2. VEGFR-1 (Flt-1), VEGFR-2 (Flk-1/KDR) и нейропилины участвуют в ангиогенезе. VEGFR-3 (Flt-4) поддерживает формирование лимфатических сосудов. VEGFR-1 (Flt-1), VEGFR-2 (Flk-1/KDR) и VEGFR-3 (Flt-4) обладают тирозинкиназной активностью и функционально сходны с рецепторами семейства факторы роста из тромбоцитов (PDGF). В то же время VEGFR-1 (Flt-1), VEGFR-2 (Flk-1/KDR) и VEGFR-3 (Flt-4) имеют Ig домены и могут рассматриваться как члены надсемейства Ig. VEGF-A взаимодействует с рецепторами VEGFR1 и VEGFR2. Плацентарный фактор роста (PLGF) и VEGF-B связываются только с рецептором VEGFR1. Факторы роста VEGF-C и VEGF-D действуют через рецепторы VEGFR2 и VEGFR3. Через рецептор VEGFR-2 (Flk-1/KDR) VEGF поддерживает выживание, миграцию и пролиферацию эндотелиальных клеток. Уже находящаяся в составе сосудистой стенки эндотелиальная клетка получает сигнал для дифференцировки через рецептор VEGFR-1.
Ангиогенные факторы роста
Торможение ангиогенеза имеет важное значение, его можно рассматривать как потенциально эффективный метод борьбы с развитием опухолей на ранних стадиях, а также других заболеваний, связанных с ростом кровеносных сосудов (например, неоваскулярная глаукома, ревматоидный артрит). Ингибиторы ангиогенеза — факторы, тормозящие пролиферацию главных клеточных типов сосудистой стенки: ангиостатин, эндостатин, ингибиторы матриксной металлопротеиназы, a-ИФН, b-ИФН, g-ИФН, ИЛ4, ИЛ12, ИЛ18, пролактин, плазменный фактор свёртывания крови IV (табл. 10-5). Естественный источник факторов, тормозящих ангиогенез, — ткани, не содержащие кровеносных сосудов (эпителий, хрящ).
Опухоли. Злокачественные опухоли требуют для роста интенсивного кровоснабжения и достигают заметных размеров после развития в них системы кровоснабжения. В опухолях происходит активный ангиогенез, связанный с синтезом и секрецией опухолевыми клетками ангиогенных факторов.
Таблица 10-5. Активаторы и ингибиторы ангиогенеза
|
Активаторы |
Ингибиторы |
|
Ангиогенин |
2-Метоксиэстрадиол |
|
Ангиопоэтин-1 |
a-, b-, g-Интерфероны (a-, b-, g-ИФН) |
|
Факторы роста фибробластов (aFGF — кислый и bFGF — щелочной) |
Ангиоаррестин |
|
Фоллистатин |
Ангиостатин (фрагмент плазминогена) |
|
Колониестимулирующий фактор гранулоцитов (G-CSF) |
Антиангиогенный антитромбин III |
|
Фактор роста гепатоцитов (HGF)/Фактор рассеивания (SF) |
Вазостатин (фрагмент кальретикулина) |
|
ИЛ8 |
Васкулостатин |
|
Лептин |
Гепариназы |
|
Мидкин |
ИЛ12 |
|
Плацентарный фактор роста (PLGF) |
Ингибитор активатора плазминогена |
|
Эндотелиальный фактор роста из тромбоцитов (PD–ECGF) |
Ингибитор плацентарной РНКазы |
|
Фактор роста из тромбоцитов BB (PDGF-BB) |
Ингибиторы металлопротеиназы |
|
Плейотрофин |
Интерферон индуцирующий белок (IP-10) |
|
Програнулин |
Пролифериноподобный белок (PRP) |
|
Пролиферин |
Ретиноиды |
|
Трансформирующий фактор роста a (TGFa) |
Тетрагидрокортизол-S |
|
Трансформирующий фактор роста b (TGFb) |
Трансформирующий фактор роста b (TGFb) |
|
Фактор некроза опухоли a (TNFa) |
Тромбоспондин-1 (TSP-1) |
|
Сосудистый эндотелиальный фактор роста (VEGF)/сосудистый фактор проницаемости (VPF) |
Фактор тромбоцитов PF4 |
|
|
Фрагмент гепарин гексасахарида |
|
|
Фрагмент комплемента CD59 |
|
|
Фрагмент плазминогена Kringle 5 |
|
|
Фрагмент пролактина 16 кД |
|
|
Фрагмент фибронектина |
|
|
Хорионический гонадотропин человека |
|
|
Хрящевой ингибитор (CDI) |
|
|
Эндостатин (фрагмент коллагена XVIII) |
Перициты могут дифференцироваться из различных предшественников, включая клетки нервного гребня и мезодермальные клетки, которые вместе образуют группу так называемых «гладкомышечных предшественников». Источником перицитов также может служить общая сосудистая клетка–предшественница. Дифференцировку всех этих предшественников в направлении образования перицитов и ГМК поддерживает фактор роста из тромбоцитов BB (PDGF-BB), а дифферон для эндотелиальных клеток определяется VEGF. Эти общие клетки–предшественницы, а также эмбриональные стволовые клетки, циркулирующие стволовые клетки и экспрессирующие молекулу Sca-1 (Stem cell antigen) стволовые клетки присутствуют в адвентициальной оболочке сосуда. Эндотелиальные клетки, фибробласты, ГМК сосудистой стенки, клетки стромы костного мозга и адвентициальные миофибробласты имеют с перицитами общие фенотипические свойства и источники происхождения.
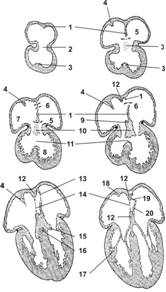
Сердце
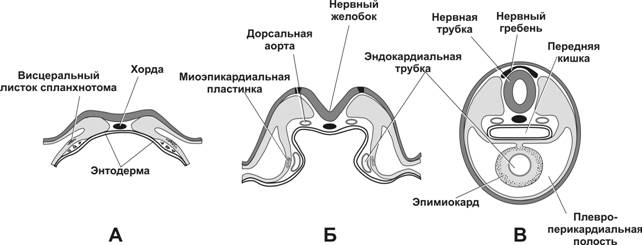
Сердце закладывается на 3-й неделе внутриутробного развития (рис. 10-9 и 10-10). В мезенхиме между энтодермой и висцеральным листком спланхнотома образуются две эндокардиальные трубки, выстланные эндотелием. Эти трубки — зачаток эндокарда. Трубки растут и окружаются висцеральным листком спланхнотома. Эти участки спланхнотома утолщаются и дают начало миоэпикардиальным пластинкам. По мере смыкания кишечной трубки обе закладки сердца сближаются и срастаются. Теперь общая закладка сердца (сердечная трубка) имеет вид двухслойной трубки. Из эндокардиальной её части развивается эндокард, а из миоэпикардиальной пластинки — миокард и эпикард.
Наиболее интенсивно размеры сердца увеличиваются в позднем плодном и в постнатальном периодах. Именно в эти периоды отмечено снижение синтеза ДНК в миокарде.
Мигрирующие из нервного гребня клетки участвуют в формировании выносящих сосудов и клапанов сердца (дефекты нервного гребня — причина 10% врождённых пороков сердца, например, транспозиции аорты и лёгочного ствола).
Рис. 10-9. Закладка сердца. А — 17-суточный эмбрион; Б — 18-суточный эмбрион; В — эмбрион на стадии 4-х сомитов (21 сутки). [17]
Рис. 10-10. Развитие сердца. 1 — первичная межпредсердная перегородка; 2 — атриовентрикулярный (АВ) канал; 3 — межжелудочковая перегородка; 4 — septum spurium; 5 — первичное отверстие; 6 — вторичное отверстие; 7 — правое предсердие; 8 — левый желудочек; 9 — вторичная перегородка; 10 — подушка АВ–канала; 11 — межжелудочковое отверстие; 12 — вторичная перегородка; 13 — вторичное отверстие в первичной перегородке; 14 — овальное отверстие; 15 — АВ–клапаны; 16 — предсердно-желудочковый пучок; 17 — сосочковая мышца; 18 — пограничный гребень; 19 — функциональное овальное отверстие; 20 — первичная перегородка, превратившаяся в клапан овального отверстия. [17]
S-образная сердечная трубка
В течение 24–26-х суток первичная сердечная трубка быстро удлиняется и приобретает S-образную форму. Это оказывается возможным благодаря локальным изменениям формы клеток сердечной трубки. На этом этапе отчётливо выделяются следующие отделы сердца: венозный синус — камера на каудальном конце сердца, в неё впадают крупные вены. Краниальнее венозного синуса располагается расширенная часть сердечной трубки, образующая область предсердия. Из средней изогнутой части сердечной трубки развивается желудочек сердца. Желудочковая петля изгибается в каудальном направлении, что перемещает будущий желудочек, находившийся краниальнее предсердия, в дефинитивное положение. Область сужения желудочка и его перехода в артериальный ствол — конус. Между предсердием и желудочком просматривается отверстие — атриовентрикулярный (АВ) канал.
Разделение на правое и левое сердце
Сразу же после образования предсердия и желудочка появляются признаки разделения сердца на правую и левую половины, которое протекает в течение 5-й и 6-й недель. На этом этапе формируются межжелудочковая перегородка, межпредсердная перегородка и эндокардиальные подушки. Межжелудочковая перегородка растёт из стенки первичного желудочка в направлении от верхушки к предсердию. Одновременно с формированием межжелудочковой перегородки в суженной части сердечной трубки между предсердием и желудочком образуются две большие массы рыхло организованной ткани — эндокардиальные подушки. Эндокардиальные подушки, состоящие из плотной соединительной ткани, участвуют в образовании правого и левого АВ–каналов. В конце 4-й недели на краниальной стенке предсердия появляется срединная перегородка в форме полукруглой складки — первичная межпредсердная перегородка (septum primum). Одна дуга складки проходит по вентральной стенке предсердия, а другая — по дорсальной. Дуги сливаются вблизи АВ–канала, но между ними остаётся первичное межпредсердное отверстие (ostium primum). Одновременно с этими изменениями венозный синус перемещается вправо и открывается в предсердие справа от межпредсердной перегородки. В этом месте формируются венозные клапаны.
Полное разделение сердца
Полное разделение сердца происходит после развития лёгких и их сосудистой сети. Когда первичная перегородка сливается с эндокардиальными подушками АВ–клапана, первичное межпредсердное отверстие закрывается. Массовая гибель клеток в краниальной части первичной перегородки приводит к образованию множества мелких отверстий, образующих вторичное межпредсердное отверстие (ostium secundum); оно контролирует равномерное поступление крови в обе половины сердца. Вскоре в правом предсердии между венозными клапанами и первичной межпредсердной перегородкой формируется вторичная межпредсердная перегородка (septum secundum). Вогнутый её край направлен вверх к месту впадения синуса, а в дальнейшем — нижней полой вены. Формируется вторичное отверстие (овальное окно, foramen ovale). Остатки первичной межпредсердной перегородки, закрывающие овальное отверстие во вторичной межпредсердной перегородке, формируют клапан, распределяющий кровь между предсердиями.
Резюме по закладке сердца
При гаструляции кардиогенные клетки–предшественницы входят в промежуточный зародышевый листок (мезодерму) и мигрируют в латеральном направлении, образуя в головном отделе сердечное полулуние. На последующей стадии первичная полость тела целом отделяет материал для сердечной трубки (спланхническая мезодерма) от материала для перикарда (соматическая мезодерма). На этой стадии можно различить клетки миокарда и эпикарда, которые экспрессируют транскрипционные факторы. Кардиогенные предшественники мигрируют в вентральном направлении, а затем, вследствие роста головных складок, в каудальном. Вначале миокард открыт в дорсальном отделе и переходит в перикардиальную мезодерму. Эта открытая область затем восполняется дорсальным миокардом, который на всём протяжении соприкасается с вентральной частью переднего отдела первичной кишки, а затем остаётся соединённым с ней только в области полюсов зачатка сердца. На последующей стадии сердечная трубка удлиняется и образуется сердечная петля, что контролируется универсальным механизмом становления оси «левое — правое». В ходе образования петли сердца формируются основные камеры, эндокардиальные подушки, зачатки сердечных клапанов и части перегородки. На последующих стадиях перестройка сердца продолжается.
Элементы проводящей системы сердца (синусно-предсердный узел, предсердно-желудочковый узел, предсердно-желудочковый пучок, ножки пучка) закладываются в первичном внекамерном миокарде. Миокард камер и внекамерный миокард характеризуются дифференциальной экспрессией генов. Так, маркёром миокарда камер служит продукт гена Nppa — предсердный натриуретический фактор (ANF), а внекамерного миокарда — транскрипционный фактор Tbx2. Дистальные ветви пучка и волокна Пуркинье формируются соответственно в миокарде межжелудочковой перегородки и стенки желудочков. Миокард камер сердца формируется в области наружной кривизны петли сердца.
Направление потока крови
Поскольку выходное отверстие нижней полой вены лежит вблизи овального отверстия, то кровь из нижней полой вены попадает через него в левое предсердие. При сокращении левого предсердия кровь прижимает створку первичной перегородки к овальному отверстию. В результате кровь не поступает из правого предсердия в левое, а перемещается из левого предсердия в левый желудочек. Первичная перегородка функционирует как односторонний клапан в овальном отверстии вторичной перегородки. Кровь поступает из нижней полой вены через овальное отверстие в левое предсердие. Кровь из нижней полой вены смешивается с кровью, поступающей в правое предсердие из верхней полой вены.
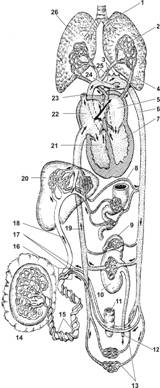
Кровоснабжение плода
Обогащённая кислородом кровь из плаценты с относительно низкой концентрацией СО2 по пупочной вене поступает в печень, а из печени — в нижнюю полую вену (рис. 10-11). Часть крови из пупочной вены через венозный проток, минуя печень, сразу попадает в систему нижней полой вены. В нижней полой вене кровь перемешивается. Кровь с высоким содержанием СО2 поступает в правое предсердие из верхней полой вены, которая собирает кровь из верхней части тела. Через овальное отверстие часть крови поступает из правого предсердия в левое. При сокращении предсердий клапан закрывает овальное отверстие, и кровь из левого предсердия поступает в левый желудочек и далее в аорту, т.е. в большой круг кровообращения. Из правого желудочка кровь направляется в лёгочный ствол, который артериальным протоком связан с аортой. Следовательно, через артериальный проток сообщаются малый и большой круги кровообращения. На ранних этапах внутриутробной жизни потребность в крови в несформированных лёгких ещё не велика, кровь из правого желудочка поступает в бассейн лёгочной артерии. Поэтому уровень развития правого желудочка будет определяться уровнем развития лёгкого. По мере развития лёгких и увеличения их объёма всё больше крови направляется к ним и всё меньше проходит через артериальный проток. Артериальный проток закрывается вскоре после рождения, когда лёгкие забирают всю кровь из правого сердца. После рождения перестают функционировать и редуцируются, превращаясь в соединительнотканные тяжи, и другие сосуды (пуповины и венозный проток). Овальное отверстие закрывается также после рождения.
Рис. 10-11. Схема кровоснабжения плода при рождении. Большая стрелка в сердце указывает ток крови из правого предсердия в левое во время диастолы. При сокращении предсердия овальное отверстие закрывается, и кровь из левого предсердия поступает в левый желудочек. 1 — бронх; 2 — лёгочные капилляры (пока не функционируют); 3 — артерии, приносящие кровь к верхней части тела; 4 — лёгочная вена; 5 — левое предсердие (смешанная кровь); 6 — дорсальная аорта; 7 — левый желудочек, откуда кровь поступает в большой круг; 8 — ЖКТ; 9 — надпочечник; 10 — почка; 11 — прямая кишка; 12 — мочеточник; 13 — артерии, приносящие кровь к нижним конечностям; 14 — плацента; 15 — пуповина; 16 — пупочное кольцо; 17 — пупочные артерии; 18 — пупочная вена; 19 — нижняя полая вена; 20 — печень; 21 — правый желудочек, из которого кровь поступает в малый и большой круги кровообращения; 22 — правое предсердие (смешанная кровь); 23 — верхняя полая вена; 24 — артериальный (боталлов) проток; 25 — лёгочная артерия; 26 — лёгкое. [17]
Клеточные и молекулярные аспекты развития миокарда. Из кардиогенной мезодермы происходят клетки эндотелия эндокарда, среди которых в виде отдельной ветви выделяют клетки эндокардиальной подушки. Два других направления дифференцировки клеток–предшественниц из кардиогенной мезодермы заканчиваются формированием типичных и атипичных кардиомиоцитов предсердий и желудочков. Предшественники из нервного гребня преимущественно дифференцируются в ГМК аорты и интрамуральные вегетативные нейроны. Клеточные и молекулярные аспекты развития миокарда важны в связи с необходимостью получения новых кардиомиоцитов для замещения погибших. Представляются перспективными три подхода. Один связан с респецификацией (трансдифференцировкой, перепрограммированием) в кардиомиогенном направлении малодифференцированных клеток–предшественниц, предназначенных для других дифферонов. Чаще с этой целью тестируют возможности трансдифференцировки региональных стволовых клеток и их малодифференцированных потомков в кардиомиоциты. Примером могут служить предшественники эндотелиальных клеток, клетки костного мозга, миобласты скелетной мышцы. Второй подход связан с идентификацией в миокарде взрослого организма стволовых кардиогенных клеток. В этом направлении получены первые обнадёживающие результаты и даже выявлены факторы [фактор роста гепатоцитов (HGF), инсулиноподобный фактор роста I (IGF-I)], которые активируют стволовые кардиогенные клетки и их ранних коммитированных потомков. Наконец, третий подход предполагает поиск путей для стимуляции пролиферации уже дифференцированных кардиомиоцитов из миокарда взрослого человека.
В координации морфогенеза миокарда и его кровеносных сосудов важную роль играют взаимодействия между миоцитами, эндотелием и клетками из проэпикардиального органа и нервного гребня. Эти взаимодействия реализуются при помощи различных морфогенетических сигналов (табл. 10-6). Наиболее значимы из них BMP, FGF, сосудистый эндотелиальный фактор роста A (VEGF-A) и, предположительно, гипоксия.
Таблица 10-6. Координирующие кардиомиогенез молекулы
|
Кардиомиоциты |
Проэпикардиальный орган |
Эндотелий |
Нервный гребень |
|
Сосудистый эндотелиальный фактор роста A (VEGF-A) |
Транскрипционный фактор Tbx5 |
Эфрин B2 (EfnB2) |
Рецептор морфогенетического белка кости 1a (BMPR1a) |
|
Рецептор морфогенетического белка кости 1a (BMPR1a) (ALK3) |
Рецептор ретиноевой кислоты RXRa |
Митоген-активируемая протеинкиназа 7 (MAPK7) |
Транскрипционный фактор PAX3 |
|
Рецепторы факторов роста фибробластов 1 и 2 (FGFR1/2) |
Транскрипционный фактор WT1 |
Фосфатидилинозитолтрифосфат 3-фосфатаза и фосфатаза двойной белковой специфичности |
|
|
Митоген-активируемая протеинкиназа 1 (MAPK14, или p38) |
|
Нейрофибромин (NF1) |
|
|
Экспрессируемый в сердце и в дериватах нервного гребня белок 1 (Hand1) |
|
Каспаза-8 |
|
|
Экспрессируемый в сердце и в дериватах нервного гребня белок 2 (Hand2) |
|
|
|
|
Транскрипционный фактор GATA4 |
|
|
|
|
Регулятор транскрипции белок цинковых пальцев ZFPM2 (FOG2) |
|
|
|
|
Транскрипционный фактор SRF |
|
|
|
|
Митохондриальная тиоредоксин редуктаза 2 (Txnrd2) |
|
|
|
Приведённые в таблице молекулы и связанные с ними сигнальные пути могут служить потенциальными мишенями фармакологического воздействия для стимуляции регенерации миокарда и улучшения его кровоснабжения при сердечной недостаточности.
Проэпикардиальный (эпикардиальный) орган
Коронарный васкулогенез начинается вскоре после формирования сердечной петли, когда сердце имеет форму трубки. Источником этого морфогенетического процесса служит проэпикардиальный орган. У птиц это обособленный орган, клетки которого происходят из мезенхимы печени. У млекопитающих он является частью поперечной перегородки. Несмотря на это, в большинстве публикаций по коронарному васкулогенезу млекопитающих используют термин «проэпикардиальный орган». Процесс миграции клеток из проэпикардиального органа в миокард сопровождается обрастанием миокарда листком эпикарда. Выселяющиеся из проэпикардиального органа клетки в миокарде дифференцируются в эндотелиальные клетки, ГМК коронарных сосудов и периваскулярную соединительную ткань. Мигранты равномерно распределяются по всему объёму зачатка сердца, а затем формируют трубки для будущих сосудов, размеры которых увеличиваются по мере нарастания массы миокарда. Трубка коронарного сосуда в области устья сливается с зачатком аорты тотчас выше аортального клапана. Миграцию клеток из проэпикардиального органа регулирует транскрипционный фактор Tbx5. Дефект этого фактора отмечен при синдроме Холт-Орама (дефекты межпредсердной или межжелудочковой перегородки в сочетании с различными деформациями предплечья и кисти). Для дифференцировки клеток–предшественниц из проэпикардиального органа особо значим другой транскрипционный фактор — SRF, продуцируемый кардиомиоцитами.
Стволовые клетки для кардиомиоцитов. Получены данные о принципиальной возможности эмбриональной стволовой клетки дифференцироваться в кардиомиогенном направлении и при трансплантации в миокард интегрироваться в его ткань, формируя структурные связи с кардиомиоцитами реципиента и индуцируя ритмическую электрическую и контрактильную активность. О дифференцировке эмбриональных стволовых клеток человека в кардиомиоциты судят по экспрессии мезодермальных маркёров (brachyury), транскрипционных факторов (Nkx2.5, Gata-4) и специфических для кардиомиоцитов генов [тяжёлых цепей миозина a и b, предсердного натриуретического пептида, лёгких цепей миозина 2v и 2A, Ca2+-АТФазы саркоплазматической сети (SERCA2), рианодинового рецептора типа 2 (RyR2), Na/Ca ионообменника 1 (Ncx1), кальсеквестрина, фосфоламбана].
Стенка сердца состоит из трёх оболочек: эндокард, миокард и эпикард.
Эндокард
Эндокард — аналог t. intima сосудов — выстилает полости сердца. В желудочках он тоньше, чем в предсердиях.
Эндотелий
Внутренняя часть эндокарда представлена плоскими полигональными эндотелиальными клетками, расположенными на базальной мембране. Клетки содержат небольшое количество митохондрий, умеренно выраженный комплекс Гольджи, пиноцитозные пузырьки, многочисленные филаменты диаметром 10 нм. Эндотелиальные клетки эндокарда имеют рецепторы атриопептина и a1-адренорецепторы.
Подэндотелиальный слой
Подэндотелиальный (внутренний соединительнотканный) слой представлен рыхлой соединительной тканью.
Мышечно-эластический слой
Мышечно-эластический слой, расположенный кнаружи от эндотелия, содержит ГМК, коллагеновые и эластические волокна.
Наружный соединительнотканный слой
Наружная часть эндокарда состоит из волокнистой соединительной ткани. Здесь можно встретить островки жировой ткани, мелкие кровеносные сосуды, нервные волокна.
Миокард
В состав мышечной оболочки сердца входят рабочие кардиомиоциты, миоциты проводящей системы, поддерживающая рыхлая волокнистая соединительная ткань, коронарные сосуды. Эндокринная функция кардиомиоцитов — синтез и секреция натриуретических факторов, включая атриопептин.
Важные для клиники особенности молекулярной биологии кардиомиоцитов
В кардиомиоциатах присутствуют две изоформы тяжёлой цепи миозина a и b. Экспрессия тяжёлой цепи миозина a коррелирует со скоростью сокращения. При сердечной недостаточности содержание этой формы миозина уменьшается с 35% до 2%.
При сердечной недостаточности накапливаются компоненты внеклеточного матрикса, что индуцирует изменение в экспрессии генов в кардиомиоцитах. В сердце экспрессируется ряд интегринов, и действующие через них сигналы задействованы в механизме развития гипертрофии. Взаимодействие клетки с внеклеточным матриксом оказывает регулирующее влияние на экспрессию гена мозгового натриуретического пептида (BNP) в миокарде желудочков. Ингибирование действия сигналов через интегрины снижает поддерживаемое растяжением действие BNP. Увеличение в кардиомиоцитах экспрессии b1 интегрина увеличивает экспрессию гена предсердного натриуретического пептида (ANP) и синтез белка.
Роль Са2+ в регуляции сократительной активности кардиомиоцитов
Нейрогуморальные агонисты ангиотензин II, эндотелин и др. через Ca2+ поддерживают гипертрофию кардиомиоцитов. Содержание [Ca2+]I увеличивается в результате поступления иона через Ca2+-каналы и обменники с последующим массированным выходом Ca2+ из цистерн саркоплазматического сети и активаций сократительных белков. Расслабление кардиомиоцитов в ходе диастолы осуществляется в результате удаления Ca2+ из цитозоля. При этом Ca2+ поступает обратно в цистерны саркоплазматической сети за счёт работы Ca2+-АТФазы, а также выходит из клетки через Na+-Ca2+ обменник, функционирующий в составе сарколеммы. При гипертрофии миокарда и при хронической сердечной недостаточности экспрессия гена Ca2+-АТФазы снижается, а гена Na+-Ca2+ обменника, наоборот, возрастает.
В росте кардиомиоцитов участвует Ca2+-связывающий белок кальмодулин. Молекулярной мишенью кальмодулина служит кальмодулин-зависимая киназа (CaMK), экспрессия которой при гипертрофии кардиомиоцитов возрастает. Кальмодулин-зависимая киназа II (CaMKII) индуцирует экспрессию гена предсердного натриуретического пептида (ANP).
Кальцинейрин — Ca2+/кальмодулин зависимая серин треониновая фосфатаза. При увеличении внутриклеточного содержания Ca2+ комплекс Ca2+/кальмодулин связывается с каталитической субъединицей кальцинейрина, что приводит к активации фосфатазы кальцинейрина. Кальцинейрин, в отличие от кальмодулин-зависимой киназы II и MAP киназ, регулируется не быстрыми изменениями концентрации Ca2+, а связан с более медленными изменениями Ca2+ в цитозоле. В ответ на гипертрофический стимул, например действие ангиотензина II, кальцинейрин дефосфорилирует транскрипционный фактор NFAT3, который при этом приобретает способность транслоцироваться из цитоплазмы в ядро.
Гипертрофия миокарда
Кардиомиоциты в миокарде взрослого человека терминально дифференцированы, возможность их образования из клеток–предшественниц и путём пролиферации исключена. Поэтому патологические стимулы, которые в отношении других клеточных типов оказывают митогенное влияние, при действии на кардиомиоциты, приводят к их гипертрофии и увеличению массы миокарда. Гипертрофия миокарда является приспособительной реакцией кардиомиоцитов к изменяющимся условиям гемодинамики. В то же время она считается опасной, т.к. возрастает риск повреждения сократительных нитей, в первую очередь молекулярных форм миозина, при кратковременных увеличениях содержания внутриклеточного Ca2+ в ходе генерации потенциала действия.
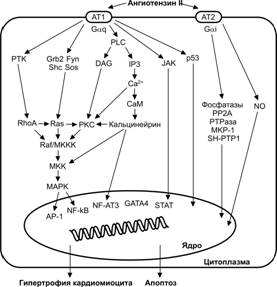
Гипертрофию миокарда вызывают сердечные пептиды миотрофин и кардиотрофин, а также катехоламины, ангиотензин II, эндотелин-1, IGF-II, TGFb, ИЛ1 и др. (рис. 10-12). В гипертрофии кардиомиоцитов участвуют транскрипционные факторы белок активатор 1 (AP1), GATA4, сывороточный реактивный фактор (SRF — Serum Response Factor), Elk-1, ядерный фактор активированных T–клеток 3 (NFAT3), ядерный фактор kB (NF- kB) и усиливающий фактор миоцитов 2 (MEF2).
Экспрессия транскрипционных факторов, таких как GATA4, SRF, Sp1, а также принадлежащих семейству TEF-1, возрастает в ответ на активацию MAP киназного каскада. В свою очередь, активация этого каскада происходит в результате воздействия на кардиомиоцит катехоламинов и ангиотензина II.
Рис. 10-12. Внутриклеточные сигнальные пути при развитии гипертрофии кардиомиоцитов. Существующая концепция предполагает ключевую роль ангиотензина II. AP-1 — белок активатор 1; ATx — подтип рецепторов ангиотензина II; CaM — кальмодулин; DAG — диацилглицерол; IP3 — инозитолтрифосфат; JAK — Янус киназа; MAPK — митоген активируемая протеинкиназа; MKK — киназа митоген активируемой протеинкиназы; MKKK — киназа киназы митоген активируемой протеинкиназы; NFAT3 — ядерный фактор активированных T–клеток; NF-kB — ядерный фактор каппа B; NO — оксид азота; PKC — протеинкиназа С; PLC — фосфолипаза С; PP2A — фосфатаза 2A; PTK — тирозинкиназа; PTPаза — тирозинфосфатаза; SH-PTP1 — Src гомологичный домен, содержащий тирозинфосфатазу 1; STAT — передатчик сигнала и активатор транскрипции. [101]
Роль Ca2+ в гипертрофии миокарда. Внутриклеточный Ca2+ запускает процесс гипертрофии и одновременно образует одно из звеньев в цепи молекулярных событий, приводящих к гипертрофии. Этот сигнальный каскад выглядит следующим образом: повышение внутриклеточного содержания Ca2+ ® активация Ca2+-зависимой фосфатазы кальцинейрина ® дефосфорилирование транскрипционного фактора NFAT3 ® взаимодействие NFAT3 с GATA4 ® активация генов, ответственных за гипертрофию.
Механические факторы и гипертрофия. Растяжение кардиомиоцитов индуцирует экспрессию специфических генов. Сенсором механических воздействий служит специальный белок MLP [Muscle LIM Protein, белок «цинковых пальцев», содержащий богатый цистеином LIM домен (от названия двух его содержащих белков Lin11 и Mec3 у червей, у которых он был впервые идентифицирован), участвующий в организации цитоскелета. Растяжение активирует каскад фосфорилирования протеинкиназ: Raf-1, регулируемой внеклеточным сигналом киназы (ERK) и специфическими MAP киназами, объединёнными в отдельное подсемейство SAPK (Stretch-Activated Protein Kinase). Эти киназы регулируют экспрессию генов путём активации транскрипционного фактора AP-1. В результате изменяется экспрессия многих генов, но наибольшее значение имеет изменение экспрессии генов, продукты которых участвуют в самом процессе сокращения или его регуляции. В этом отношении следует обратить особое внимание на снижение уровня мРНК для белков Ca2+-каналов, фосфоламбана и Ca2+-помпы в мембране саркоплазматической сети (SERCA2). Кроме того, показано сопутствующее увеличение содержания мРНК a–актина, который в нормальных условиях присутствует в кардиомиоцитах плода и отсутствует в кардиомиоцитах взрослого человека. Одновременно при гипертрофии возрастает экспрессия VEGF.
Позитивные инотропные агенты. Усиливающие сократимость миокарда факторы, действуя на плазматическую мембрану кардиомиоцита, увеличивают внутриклеточное содержание Ca2+ путём активации Ca2+-каналов, ингибирования работы Na-Ca обменника или Ca2+-АТФазы. К подобным факторам относят адренергические агонисты (рис. 10-13), сердечные гликозиды, повышенное внутриклеточное содержание Ca2+, пониженное внеклеточное содержание Na2+ и учащение сердечных сокращений.
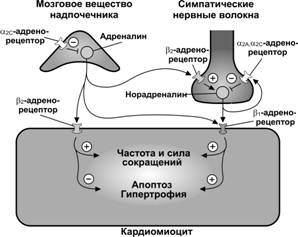
Механизм действия адренергических агонистов. Катехоламины адреналин и норадреналин связываются с b1-адренорецепторами, что вызывает активацию a субъединицы гетеротримерного G–белка типа Gs. Активированная as субъединица участвует в увеличении внутриклеточного содержания цАМФ с последующей стимуляцией активности протеинкиназы А, что в конечном итоге приводит к увеличению сократимости и скорости расслабления (рис. 10-13). Кроме того, активированная as субъединица G–белка непосредственно участвует в открытии Ca2+ каналов L-типа в плазмолемме кардиомиоцита, что приводит к увеличению потока Ca2+ внутрь клетки в ходе потенциала действия, увеличению[Ca2+]i и сократимости.
Рис. 10-13. Роль b1-, b2-, a2A- и a2C-адренорецепторов в регуляции работы сердца и судьбе кардиомиоцитов. Пресинаптические a2A- and a2C-адренорецепторы контролируют секрецию норадреналина и адреналина соответственно из симпатических терминалей и мозгового вещества надпочечников. b- и в меньшей мере b2-адренорецепторы в мембране кардиомиоцитов опосредуют увеличение содержания цАМФ и последующее увеличение частоты и силы сердечных сокращений. Через рецепторы этих двух подтипов клетка выбирает противоположные по направленности ответы в отношении апоптоза и гипертрофии. Норадреналин, действуя через b1-рецепторы поддерживают вступление кардиомиоцитов в апоптоз или их гипертрофию, адреналин из надпочечников, действуя через b2-рецепторы, наоборот сдерживает вступление клеток в апоптоз и развитие гипертрофии кардиомиоцитов. a-Адренорецепторы, через которые реализуется эффект усиления сократимости миокарда с участием инозитолтрифосфата и Ca2+-зависимого механизма, на рисунке не обозначены. [45]
Гибель кардиомиоцитов. При ишемической болезни сердца, гипертензии и терминальных стадиях сердечной недостаточности кардиомиоциты погибают путём апоптоза. В условиях патологии (гипертрофии миокарда, сердечной недостаточности, переохлаждении) кардиомиоциты могут погибать путём аутофагии, который, наряду с апоптозом и некрозом, рассматривается как третий возможный способ гибели клеток.
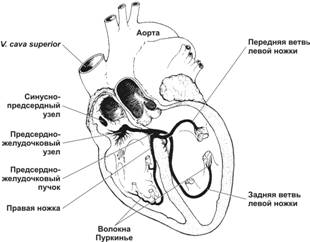
Проводящая система
Атипичные кардиомиоциты (рис. 10-14) образуют синусно-предсердный узел, предсердно-желудочковый узел (АВ–узел), предсердно-желудочковый ствол (АВ–ствол). Клетки АВ–ствола (пучок Гиса) и ножек пучка Гиса переходят в волокна Пуркинье. Существуют и дополнительные пути. Клетки проводящей системы при помощи десмосом и щелевых контактов формируют волокна. Назначение атипичных кардиомиоцитов — автоматическая генерация импульсов и их проведение к рабочим кардиомиоцитам. Аритмии — нарушения формирования импульса возбуждения или его проведения, проявляются нарушением ритма сердечных сокращений.
Синусно-предсердный узел — номотопный водитель ритма, определяет автоматию сердца (главный водитель ритма), генерирует 60–90 импульсов в минуту.
Предсердно-желудочковый узел. При патологии синусно-предсердного узла его функция переходит к АВ–узлу (частота генерации импульсов — 40–50 в минуту).
Предсердно-желудочковый пучок Гиса состоит из ствола, правой и левой ножек. Левая ножка распадается на переднюю и заднюю ветви. Скорость проведения по пучку Гиса — 1–1,5 м/с (в рабочих кардиомиоцитах возбуждение распространяется со скоростью 0,5–1 м/c), частота генерации импульсов — 30–40/ мин.
Волокна Пуркинье. Скорость проведения импульса по волокнам Пуркинье — 2–4 м/c, частота генерации импульсов — 20–30/ мин.
Рис. 10-14. Проводящая система сердца. Импульсы генерируются в синусно-предсердном узле и передаются по стенке предсердия в АВ–узел, а затем по пучку Гиса, его правой и левой ножкам до волокон Пуркинье в стенке желудочков. [17]
Натриуретические пептиды
Натриуретические пептиды — мощные гипотензивные факторы. Атриопептин и натриуретический фактор мозга синтезируют кардиомиоциты правого предсердия, кардиомиоциты желудочков сердца у плода и в послеродовом периоде, кардиомиоциты желудочков сердца при его гипертрофии, а также некоторые нейроны ЦНС.
Известны три формы натриуретического пептида, предсердный (ANP), мозговой (BNP) и С-типа (CNP). Предсердный натриуретический пептид (ANP) наиболее изучен. Он прямо участвует в регуляции выведения солей из организма, поддерживает вазодилатацию, ингибирует систему ренин-ангиотензин-альдостерон, т.е. в целом контролирует системное артериальное давление. Кроме того, для ANP показан более широкий спектр вазоактивных эффектов, которые вступают в антагонистические взаимоотношения с действием известных гормональных и негормональных вазоконстрикторов. Этот гормон влияет на эффекты других гормонов, а также цитокинов и факторов роста. ANP оказывает влияние на сигнальные пути при развитии фиброза, воспаления, гипертрофии и перестройке ткани. Недавно установлена липолитическая функция ANP. CNP поддерживает рост костей и участвует в развитии ЦНС и половой системы.
Коронарные сосуды
Обе коронарные артерии отходят от основания аорты. Задняя стенка левого желудочка, некоторые отделы перегородки и значительная часть правого желудочка кровоснабжаются правой коронарной артерией. Остальные отделы сердца получают кровь из левой коронарной артерии. Ишемическая болезнь сердца развивается в результате локального сужения просвета крупной или среднего калибра коронарной артерии вследствие пролиферации ГМК внутренней оболочки (интима) и отложения в ней липидов. В зоне первичного повреждения эндотелия развивается атеросклеротическая бляшка. ГМК интимы пролиферируют вследствие повреждения эндотелия. В центре бляшки скапливаются окружённые ГМК клеточный детрит, кристаллы и эфиры холестерина, кальций.
Эпикард
Эпикард (epicardium) — висцеральный листок перикарда образован тонким слоем соединительной ткани, срастающейся с миокардом. Свободная поверхность покрыта мезотелием.
Перикард
Основу перикарда (pericardium) составляет соединительная ткань с многочисленными эластическими волокнами. Поверхность перикарда выстлана мезотелием. Артерии перикарда образуют густую сеть, в которой выделяют поверхностные и глубокие сплетения. В перикарде присутствуют капиллярные клубочки и артериоло-венулярные анастомозы. Эпикард и перикард разделены щелевидным пространством — перикардиальной полостью (cavitas pericardiaca), содержащей до 50 мл жидкости, которая облегчает скольжение серозных поверхностей.
Регуляция функций
Регуляция функций сердца осуществляется вегетативной двигательной иннервацией, гуморальными факторами и автоматией сердца.
Иннервация
Работу сердца контролируют сердечные центры продолговатого мозга и моста через парасимпатические и симпатические волокна, которые влияют на частоту сокращений (хронотропное действие), силу сокращений (инотропное действие) и скорость предсердно-желудочкового проведения (дромотропное действие). Холинергические и адренергические (преимущественно безмиелиновые) волокна образуют в стенке сердца несколько нервных сплетений, содержащих внутрисердечные ганглии. Скопления ганглиев в основном сосредоточены в стенке правого предсердия и в области устьев полых вен. В целом стимуляция симпатических нервов увеличивает частоту спонтанной деполяризации мембран водителей ритма, облегчает проведение импульса в волокнах Пуркинье и увеличивает частоту и силу сокращения рабочих кардиомиоцитов. Стимуляция парасимпатических нервов, наоборот, уменьшает частоту генерации импульсов пейсмейкерами, снижает скорость проведения импульса в волокнах Пуркинье и уменьшает силу и частоту сокращения миокарда.
Парасимпатическая иннервация
Преганглионарные парасимпатические волокна для сердца проходят в составе блуждающего нерва с обеих сторон. Волокна правого блуждающего нерва иннервируют правое предсердие и образуют густое сплетение в области синусно-предсердного узла. Волокна левого блуждающего нерва подходят преимущественно к предсердно-желудочковому узлу. Поэтому правый блуждающий нерв влияет главным образом на частоту сокращений, а левый — на предсердно-желудочковое проведение. Желудочки имеют менее выраженную парасимпатическую иннервацию. Внутрисердечные нейроны почти все холинергические (парасимпатические). На них, а также на МИФ-клетках заканчиваются терминали холинергических аксонов блуждающего нерва. Отростки нейронов внутрисердечных ганглиев также вступают в контакт с МИФ-клетками. Под действием парасимпатических волокон сила сокращений предсердий уменьшается (отрицательный инотропный эффект), снижается частота сокращений сердца (отрицательный хронотропный эффект) и увеличивается предсердно-желудочковая задержка проведения — отрицательный дромотропный эффект (вплоть до полной преходящей предсердно-желудочковой блокады).
Симпатическая иннервация
Преганглионарные симпатические волокна для сердца идут от боковых рогов верхних грудных сегментов спинного мозга. Постганглионарные адренергические волокна образованы аксонами нейронов ганглиев симпатической нервной цепочки (звёздчатый и отчасти верхний шейный симпатические узлы). Они подходят к органу в составе нескольких сердечных нервов и равномерно распределяются по всем отделам сердца. Терминальные ветви пронизывают миокард, сопровождают коронарные сосуды и подходят к элементам проводящей системы. Миокард предсердий имеет более высокую плотность адренергических волокон. Каждый пятый кардиомиоцит желудочков снабжается адренергической терминалью, заканчивающейся на расстоянии 50 мкм от плазмолеммы кардиомиоцита. Под действием симпатических волокон сила сокращений предсердий и желудочков увеличивается (положительный инотропный эффект), возрастает частота сокращений сердца (положительный хронотропный эффект), укорачивается интервал между сокращениями предсердий и желудочков (положительный дромотропный эффект).
Афферентная иннервация
Чувствительные нейроны ганглиев блуждающих нервов и спинномозговых узлов (C8–Th6) образуют свободные и инкапсулированные нервные окончания в стенке сердца. Афферентные волокна проходят в составе блуждающих и симпатических нервов.
Гуморальная регуляция
Кардиомиоциты имеют a1-адренорецепторы, b-адренорецепторы, м-холинорецепторы. Активация a1-адренорецепторов способствует поддержанию силы сокращения (табл. 10-7). Агонисты b-адренорецепторов вызывают увеличение частоты и силы сокращения, м-холинорецепторов — уменьшение частоты и силы сокращения. Норадреналин выделяется из аксонов постганглионарных симпатических нейронов и действует на b1-адренорецепторы рабочих кардиомиоцитов предсердий и желудочков, а также пейсмейкерные клетки синусно-предсердного узла. Дальнейшая последовательность событий может быть представлена следующим образом: взаимодействие норадреналина с b1-адренорецептором ® активация GS белка ® повышение активности аденилатциклазы ® увеличение уровня цАМФ ® активация протеинкиназы А ® фосфорилирование и изменения активности многих молекулярных мишеней.
В рабочих кардиомиоцитах b1 агонисты активируют внутриклеточный сигнальный путь, связанный с протеинкиназой А, и опосредованно через as субъединицу G–белка активируют Ca2+-каналы L-типа. В результате мышечные сокращения становятся сильнее и их частота возрастает.
В пейсмейкерных клетках агонисты b1-рецепторов стимулируют Ca2+ ток через Ca2+-каналы T-типа и Na+-ток в период диастолы через неселективные катионные каналы. Оба процесса усиливают диастолическую деполяризацию, в итоге диастола укорачивается, частота сердечных сокращений возрастает.
В рабочих кардиомиоцитах в результате активации м2-холинорецепторов развивается следующая цепь событий: активация G–белка ® активация фосфолипазы C ® активация синтазы оксида азота ® стимуляция гуанилатциклазы ® увеличение уровня цГМФ ® угнетение работы Ca2+-каналов L-типа ® снижение притока Ca2+ в клетку ® уменьшение силы сокращения.
В пейсмейкерных клетках ацетилхолин также действует через м2-холинорецепторы. Нейромедиатор запускает сигнальный каскад, который начинается не с a субъединицы, а с гетеродимера bg G–белка. Этот гетеродимер прямо открывает выпрямляющие K+-каналы (GIRK). Увеличение K+-проницаемости, а также уменьшение Ca2+ тока служит причиной снижения частоты сердечных сокращений.
Выпрямляющие К+-каналы. Ассоциация двух различных мембранных белков KVLQT1 и IsK образует медленные выпрямляющие К+-каналы, ответственные за проведение IKs-тока в мембране кардиомиоцита и участвующие в реполяризации мембраны кардиомиоцитов после потенциала действия. Дисфункция этих каналов вызывает аритмии и является причиной синдрома удлинённого интервала QT (LQT-синдром), врождённый порок, увеличивающий риск внезапной сердечной смерти. KVLQT1 имеет строение типичного потенциалозависимого К+-канала, в котором селективно пропускающая ионы К+ порообразующая часть расположена рядом с шестью трансмембранными участками. IsK — небольшой гликопротеин, имеющий один мембранный участок, для которого не выявлены гомологи в клонированных молекулах других каналов.
Коронарные сосуды. Симпатические влияния почти всегда приводят к увеличению коронарного кровотока. a1-Адренорецепторы и b-адренорецепторы неравномерно распределены по коронарному руслу. a1-Адренорецепторы присутствуют в ГМК сосудов крупного калибра, их стимуляция вызывает сужение артериол и вен сердца. b-Адренорецепторы чаще встречаются в мелких коронарных артериях. Стимуляция b-адренорецепторов расширяет артериолы.
Адренорецепторы в гладкомышечных клетках сосудистой стенки
Эффект адренергического влияния на конкретный сосуд зависит от характера агониста (адреналин в случае надпочечника или норадреналин в случае симпатических нервных волокон), типа и подтипа адренорецептора. Взаимодействие агониста с адренорецептором может приводить к вазоконстрикции или вазодилатации. Наиболее выраженные эффекты адреналина и норадреналина проявляются при их связывании с b-рецепторами. Норадреналин с большей аффинностью связывается с a-рецепторами, чем с b-рецепторами. b1-рецепторы с одинаковой аффинностью связываются с адреналином и норадреналином. b2-рецепторы имеют большую аффинность к адреналину, чем к норадреналину. Через a-, преимущественно al-, адренорецепторный вход реализуется вазоконстрикторное действие. Секретируемый из нервных терминалей норадреналин, взаимодействуя с a1-рецептором, связанным с Gq белком, активирует фосфолипазу C и образование инозитолтрифосфата. Это приводит к увеличению внутриклеточного содержания Ca2+ и сократимости ГМК. В случае вазодилатации, которая осуществляется через b2-рецепторы, активируется путь цАМФ−протеинкиназа А с последующим фосфорилированием киназы лёгкой цепи миозина. В результате фосфорилирования снижается чувствительность киназы лёгкой цепи миозина к влиянию со стороны комплекса Ca2+–кальмодулин, и ГМК расслабляются.
ГМК большинства кровеносных сосудов содержат a- и b-рецепторы. От преобладания рецепторов конкретного подтипа зависит ответ сосуда. Для решения практических задач особенно важно учитывать соотношение a1- и b2-рецепторов.
Кровеносные сосуды кожи имеют только a1-рецепторы. В ответ на действие адреналина или норадреналина просвет этих сосудов уменьшается. Иная картина наблюдается в коронарных сосудах, где b2 рецепторов больше, чем a1-рецепторов. Здесь адреналин вызывает вазодилатацию.
Таблица 10-7. Пути влияния симпатических и парасимпатических волокон на сердечно-сосудистую систему [114]
|
Физиологический ответ |
Анатомический путь |
Нейромедиатор |
Рецептор |
G–белок |
Фермент или белок |
Второй посредник |
|
Тахикардия |
Симпатический отдел |
Норадреналин |
b1 на пейсмейкерных клетках |
GaS |
Аденилатциклаза |
[цАМФ]i |
|
Брадикардия |
Парасимпатический отдел |
Ацетилхолин |
м2 на пейсмейкерных клетках |
Прямое действие димера Gibg |
Выпрямляющие K+-каналы |
|
|
Усиление сократимости |
Симпатический отдел |
Норадреналин |
b1 на кардиомиоцитах |
GaS Прямое действие GaS наC2+-каналы L-типа |
Аденилатциклаза |
[цАМФ]i |
|
Ослабление сократимости |
Парасимпатический отдел |
Ацетилхолин |
м2 на кардиомиоцитах. Пресинаптические м2-холинорецепторы на норадренергических нейронах |
Gai
Gai |
¯Аденилатциклаза |
¯[цАМФ]i
¯[цАМФ]i в нейронах |
|
Вазоконстрикция большинства кровеносных сосудов (например, в коже) |
Симпатический отдел |
Норадреналин |
a1 на ГМК |
Gaq |
Фосфолипаза С |
[Ca2+]i |
|
Вазоконстрикция некоторых кровеносных сосудов |
Симпатический отдел |
Норадреналин |
a2 на ГМК |
Gai/q |
¯Аденилатциклаза |
¯[цАМФ]i |
|
Вазодилатация большинства кровеносных сосудов (например, в мышце) |
Мозговое вещество надпочечника |
Адреналин |
b2 на ГМК |
GaS |
Аденилатциклаза |
[цАМФ]i |
|
Вазодилатация кровеносных сосудов эректильных органов |
Парасимпатический отдел |
Ацетилхолин |
Пресинаптические м2 рецепторы на норадренергических нейронах |
Gai |
¯Аденилатциклаза |
¯[цАМФ]i в нейронах |
|
|
|
Ацетилхолин |
м3 на эндотелиальных клетках |
Gaq |
Фосфолипаза C, освобождение Ca2+, активация NO-синтазы |
Диффузия NO к ГМК |
|
|
|
Оксид азота |
Гуанилатциклаза в ГМК |
|
Стимулирование гуанилатциклазы |
↑[цГМФ]i |
|
|
|
VIP |
VIP-рецептор на ГМК |
GaS |
Стимулирование аденилатциклазы |
↑[цАМФ]i |
|
Вазодилатация кровеносных сосудов слюнных желёз |
Парасимпатический отдел |
Ацетилхолин |
м рецептор на клетках желёз |
|
Активация калликреина |
Кинины |
|
Вазодилатация кровеносных сосудов в мышце в режиме «бороться или лететь» |
Симпатический отдел |
Ацетилхолин |
Пресинаптические м2 рецепторы на норадренергических нейронах |
Gai |
Ингибирование аденилатциклазы |
↓[цАМФ]i в нейронах |
|
|
|
NANC (Non-Adrenergic/Non-Cholinergic) |
Рецепторы на ГМК |
|
|
|
Вазоконстриктор ангиотензин II
Этот пептид взаимодействует со связанными с G–белком рецепторами AT1A в плазматической мембране ГМК сосудистой стенки. Активируемая вслед за тем фософолипаза С увеличивает содержание Ca2+ в цитозоле и сократимость клеток. Ангиотензин II повышает артериальное давление, действуя не только на ГМК сосудистой стенки, но и на другие мишени:
Ú увеличивает сократимость миокарда;
Ú замедляет почечный кровоток, увеличивая реабсорбцию Na+ в почках;
Ú стимулирует высвобождение альдостерона из клеток надпочечников;
Ú обладает центральным действием, вызывает жажду и стимулирует высвобождение другого вазоконстриктора — аргинин вазопрессина;
Ú усиливает секрецию нейромедиатора норадреналина из постганглионарных симпатических волокон;
Ú выступает в роли сердечного фактора роста и участвует в развитии гипертрофии миокарда.
Гистамин и брадикинины расслабляют ГМК сосудистой стенки, но вызывают сокращение ГМК внутренних органов, например бронхов при астме.
Серотонин поддерживает сократительную активность миокарда через рецепторы 5-HT2B (рис. 10-15). Действуя на клетки синусно-предсердного узла через рецепторы 5-HT4, серотонин вызывает учащение сердечных сокращений (тахикардию). Эффект серотонина на эфферентные нервные окончания в пределах того же узла, опосредуемый рецепторами 5-HT3, приводит к замедлению ритма (брадикардии). Вазодилатация коронарных артерий поддерживается через рецепторы 5-HT1, 5-HT1B, 5-HT2B, а вазоконстрикция — через рецепторы 5-HT1, 5-HT2A и 5-HT2B.
Рис. 10-15. Влияние серотонина на частоту сердечных сокращений, сократимость миокарда и тонус коронарных артерий. СП — синуснопредсердный узел. [136]