· Мышечные ткани
Мышечная ткань осуществляет двигательные функции организма. У части гистологических элементов мышечной ткани в световой микроскоп видны сократительные единицы — саркомеры. Это обстоятельство позволяет различать два типа мышечных тканей. Один из них — поперечнополоcатая (скелетная и сердечная) и второй — гладкая. Во всех сократительных элементах мышечных тканей [поперечнополосатое скелетное мышечное волокно, кардиомиоциты, гладкомышечные клетки (ГМК)], а также в немышечных контрактильных клетках (миоэпителиальные клетки, миофибробласты и др.) функционирует актомиозиновый хемомеханический преобразователь, активирующийся при повышении концентрация Ca2+ в цитозоле в ответ на химический или электрический сигнал. Вместе с тем, каждый тип мышечной ткани имеет уникальные структурно-функциональные характеристики, определяющие скорость, силу и продолжительность сокращения, тип метаболизма и степень утомляемости. Например, скелетная и сердечная мышцы должны генерировать быстрые сокращения, при этом скелетная мышца может длительно поддерживать силу сокращения, тогда как деятельность сердечной мышцы характеризуется непрерывным чередованием периодов сокращения и расслабления с каждым ударом сердца на протяжении всей жизни. Гладкая мышца, как и скелетная должна иметь широкий спектр скорости, силы и продолжительности сокращения. Сфинктеры, образованные гладкой мышечной тканью, в состоянии длительного сокращения должны быть устойчивы к утомлению, а ГМК семявыносящего протока (ductus deferens) иметь высокие скоростные характеристики, способствующие выбрасыванию сперматозоидов во время эякуляции. Сократительную функцию скелетной мышечной ткани (произвольная мускулатура) контролирует нервная система (соматическая двигательная иннервация). Непроизвольные мышцы (сердечная и гладкая) имеют вегетативную двигательную иннервацию, а также развитую систему гуморального контроля их сократительной активности. Для ГМК характерна выраженная физиологическая и репаративная регенерация. В составе же скелетных мышечных волокон присутствуют стволовые клетки (клетки-сателлиты), поэтому скелетная мышечная ткань потенциально способна к регенерации. Кардиомиоциты находятся в фазе G0 клеточного цикла, а стволовые клетки в сердечной мышечной ткани отсутствуют. По этой причине погибшие кардиомиоциты замещаются соединительной тканью.
Скелетная мышечная ткань
У человека более 600 скелетных мышц (около 40% массы тела). Скелетная мышечная ткань обеспечивает осознанные и осознаваемые произвольные движения тела и его частей. Основные гистологические элементы: скелетные мышечные волокна (функция сокращения), клетки-сателлиты (камбиальный резерв).
Развитие
Источник развития гистологических элементов скелетной мышечной ткани — миотомы, откуда выселяются и мигрируют в места закладки конкретных мышц самые ранние клетки миогенного клеточного типа. Из дорсомедиальной части миотомов выселяются клетки, дающие начало миобластам мышц спины, а из клеток вентромедиальной части дифференцируются миобласты, образующие мышцы груди, живота и конечностей. Мезенхима сомитов головного отдела зародыша формирует скелетные мышцы черепно-лицевой области. Мимическая мускулатура происходит из клеток нервного гребня. Миогенный клеточный тип в эмбриогенезе последовательно складывается из следующих гистологических элементов: клетки миотома (миграция) ® миобласты митотические (пролиферация) ® миобласты постмитотические (слияние) ® мышечные трубочки (синтез сократительных белков, формирование саркомеров) ® мышечные волокна (функция сокращения). В области закладки мышц уже присутствуют клетки мезенхимы — источник соединительнотканных структур мышцы, сюда прорастают кровеносные капилляры, а позднее (при образовании мышечных трубочек) — аксоны двигательных и чувствительных нейронов соматического отдела нервной системы.
Клетки миотомов
Выселяющиеся из сомитов клетки уже детерминированы в направлении образования миогенных элементов. Миграция клеток миотома контролируется гомеозисными генами, содержащими гомеобокс (Pax3, с-Met, msx1, Lbx1). Репрессор миогенеза MyoR (myogenic repressor), блокирует дифференцировку клеток–предшественниц в миобласты во время их миграции. В местах закладки скелетных мышц клетки–предшественницы миобластов образуют скопления и вступают в дифференцировку. Миогенез инициирует Pax3, контролирующий активность мышечно-специфических транскрипционных факторов [MyoD (myogenic differentiation), Myf5 (myogenic factor 5), миогенин, MRF4 (myogenic regulatory factors)], имеющих мотив "спираль-поворот-спираль" для связывания с ДНК. MyoD и Myf5 контролируют образование миобластов из клеток миотомов, а миогенин и MRF4 отвечают за терминальную дифференцировку мышечных волокон, активируя экспрессию мышечно-специфических белков (скелетно-мышечные актин, миозины, тропомиозины).
Дефекты миграции и дифференцировки клеток миотома. Клетки–предшественницы мышц конечностей выселяются из миотомов и образуют скопления на дорсальной и вентральной поверхностях зачатков конечностей. При мутации Pax3 и с-Met блокируется миграция клеток в зачатки конечностей. Инактивация генов MyoD и Myf5 блокирует дифференцировку клеток миотома в миобласты.
Миобласты
Митотические миобласты (G1-миобласты) последовательно проходят ряд завершающихся митозами клеточных циклов (пролиферативные митозы). На этой стадии часть G1-миобластов обособляется в виде клеток-сателлитов.
Постмитотические миобласты (G0-миобласты) — клетки, необратимо вышедшие из клеточного цикла (результат квантального митоза) и уже начавшие синтез сократительных белков. G0-миобласты сливаются и образуют симпласты — мышечные трубочки (миотубы).
Мышечная трубочка
После ряда митотических делений миобласты приобретают вытянутую форму, выстраиваются в параллельные цепи и начинают сливаться, образуя мышечные трубочки (миотуба). В мышечных трубочках происходит терминальная миогенная дифференцировка: синтез контрактильных белков, сборка миофибрилл — сократительных структур с характерной поперечной исчерченностью. Перемещение ядер симпласта на периферию завершает формирование поперечнополосaтого мышечного волокна. Окончательная дифференцировка мышечной трубочки происходит только после её иннервации. Мышечное волокно — заключительная стадия миогенеза скелетной мышцы.
Клетки-сaтеллиты
Обособившиеся в ходе миогенеза G1-миобласты, расположенные между базальной мембраной и плазмолеммой мышечных волокон. Ядра этих клеток составляют 30% у новорождённых, 4% у взрослых и 2% у пожилых от суммарного количества ядер скелетного мышечного волокна. Клетки-сателлиты — камбиальный резерв мышечной ткани скелетного типа. Они сохраняют способность к миогенной дифференцировке (клетки-сaтеллиты ® миобласты ® миотубы ® мышечные волокна) в течение всей жизни, что обеспечивает рост мышечных волокон в длину в постнатальном периоде. Клетки-сaтеллиты также участвуют в репаративной регенерации скелетной мышечной ткани, в ходе которой наблюдается повторение событий эмбрионального миогенеза.
Маркёры клеток-сaтеллитов: MNF (myocyte nuclear factor — ядерный фактор миоцитов), c-Met [рецепторная тирозин киназа фактора роста гепатоцитов (HGF/SF)], молекулы адгезии M-кадгерин, NCAM и VCAM-1, транскрипционные факторы Pax7 и Sca-1 (stem cell antigen-1).
SP клетки
SP (side population) клетки — добавочная популяция стволовых клеток в скелетных мышцах и красном костном мозге, способны дифференцироваться в миобласты и клетки крови. SP-клетки специфически взаимодействуют с ядерным красителем Hoechst 33342, связывающимся с ДНК. После окрашивания Hoechst 33342 SP клетки могут быть выделены из ткани с помощью лазерного сортера.
· Регенерация красного костного мозга. В эксперименте 100 SP клеток, полученные из скелетной мышцы, полностью восстанавливают красный костный мозг у летально облучённых мышей.
· Регенерация скелетной мышцы. Внутривенное введение SP клеток мутантным мышам mdx (модель мышечной дистрофии Дюшенна, см. ниже) восстанавливает экспрессию дистрофина в скелетных мышцах mdx мышей.
Маркёры миогенного клеточного типа
Миогенные факторы транскрипции (в т.ч. миогенин и MyoD) экспрессируются только в гистологических элементах скелетной мышцы на разных стадиях миогенеза.
Десмин — мышечноспецифический белок класса промежуточных филаментов цитоскелета. Десмин найден в гистологических элементах всех мышечных тканей. В скелетномышечном миогенезе десмин начинает экспрессироваться в цитоплазме миобластов, а с началом миофибриллогенеза десминовые нити вплетаются в Z-диски или их аналоги в ГМК (плотные тельца). При различных миопатиях происходит накопление десмина в саркоплазме.
Сократительные белки актомиозинового хемомеханического преобразователя — миозины, актины, тропонины, тропомиозины, а также вспомогательные белки тонких (актиновых), толстых (миозиновых) нитей миофибрилл и Z-дисков.
Креатинфосфокиназа
Миоглобин
Скелетное мышечное волокно
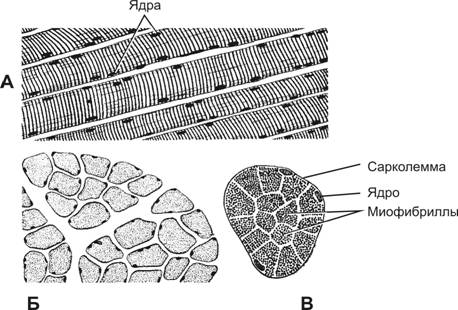
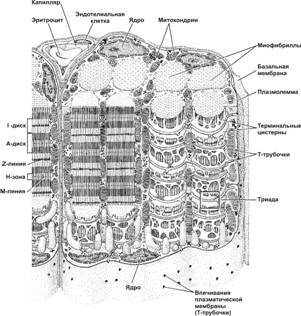
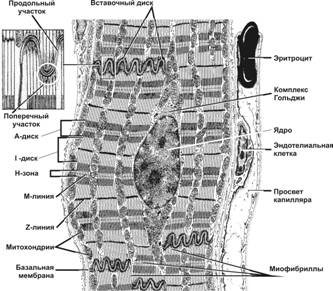
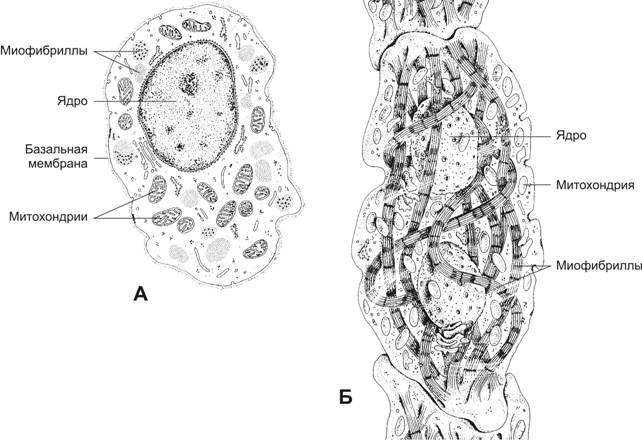
Структурно-функциональная единица скелетной мышцы — симпласт — скелетное мышечное волокно (рис. 7-1, 7-2, 7-2А), имеет форму протяжённого цилиндра с заострёнными концами. Этот цилиндр достигает в длину 40 мм при диаметре до 0,1 мм. Термином «оболочка волокна» (сaрколемма) обозначают две структуры: плазмолемму симпласта и его базальную мембрану. В стабилизации сарколеммы и её защите от избыточного напряжения, возникающего при сокращении мышечного волокна, участвует дистрофин-дистрогликановый комплекс (рис. 7-19). Между плазмолеммой и базальной мембраной расположены клетки-сателлиты с овальными ядрами. Палочковидной формы ядра мышечного волокна лежат в цитоплазме (саркоплазма) под плазмолеммой. В саркоплазме симпласта расположен контрактильный аппарат — миофибриллы, депо Ca2+ — гладкая эндоплазматическая (саркоплазматическая) сеть (ретикулум), митохондрии, включения (гранулы гликогена). От поверхности мышечного волокна к расширенным участкам саркоплазматического ретикулума направляются трубковидные впячивания сарколеммы — поперечные трубочки (Т-трубочки). Рыхлая волокнистая соединительная ткань между отдельными мышечными волокнами (эндомизий) содержит кровеносные и лимфатические сосуды, нервные волокна. Группы мышечных волокон и окружающая их в виде чехла волокнистая соединительная ткань (перимизий) формируют пучки. Их совокупность образует мышцу, плотный соединительнотканный чехол которой именуют эпимизий (рис. 7-2).
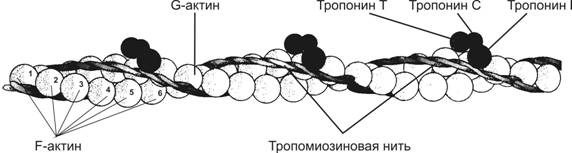
Рис. 7-1. Скелетная мышца состоит из поперечнополосaтых мышечных волокон. Значительный объём мышечного волокна занимают миофибриллы. Расположение светлых и тёмных дисков в параллельных друг другу миофибриллах совпадает, что приводит к появлению поперечной исчерченности. Структурная единица миофибрилл — саркомер, сформированный из толстых (миозиновых) и тонких (актиновых) нитей. Расположение тонких и толстых нитей в саркомере показано слева и слева внизу. G–актин — глобулярный, F–актин — фибриллярный актин. [26]
Рис. 7-2. Скелетная мышца в продольном и поперечном разрезе. А — продольный разрез; Б — поперечный разрез; В — поперечный срез отдельного мышечного волокна. [17]
Рис. 7-2А. Скелетная мышца. В продольном сечении мышечные волокна имеют цилиндрическую форму (1), чередование тёмных и светлых дисков обеспечивает хорошо выраженную поперечную исчерченность. В поперечном сечении (2) мышечные волокна имеют многоугольную форму. Ядра (3) располагаются под сарколеммой по периферии мышечного волокна. Окраска гематоксилином и эозином.
Миофибриллы
Поперечная исчерченность скелетного мышечного волокна определяется регулярным чередованием в миофибриллах различно преломляющих поляризованный свет участков (дисков) — изотропных и анизотропных: светлые (Isotropic, I-диски) и тёмные (Anisotropic, А-диски) диски. Разное светопреломление дисков определяется упорядоченным расположением по длине саркомера тонких и толстых нитей; толстые нити находятся только в тёмных дисках, светлые диски не содержат толстых нитей. Каждый светлый диск пересекает Z-линия. Участок миофибриллы между соседними Z-линиями определяют как саркомер.
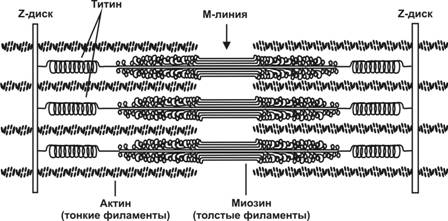
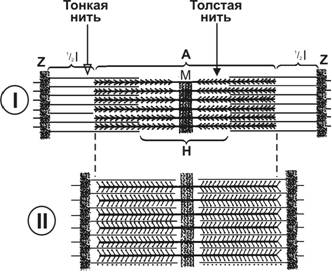
Саркомер. Структурно-функциональная единица миофибриллы, находящаяся между соседними Z-линиями (рис. 7-3). Саркомер образуют расположенные параллельно друг другу тонкие (актиновые) и толстые (миозиновые) нити. I-диск содержит только тонкие нити. В середине I-диска проходит Z-линия. Один конец тонкой нити прикреплён к Z-линии, а другой конец направлен к середине сaркомера. Толстые нити занимают центральную часть сaркомера — А-диск. Тонкие нити частично входят между толстыми. Содержащий только толстые нити участок сaркомера — Н-зона. В середине Н-зоны проходит М-линия. I-диск входит в состав двух сaркомеров. Следовательно, каждый сaркомер содержит один А-диск (тёмный) и две половины I-диска (светлого), формула саркомера — ½ I + А + ½ I.
Рис. 7-3. Саркомер содержит один А-диск (тёмный) и две половины I-диска (светлого). Толстые миозиновые нити занимают центральную часть саркомера. Титин соединяет свободные концы миозиновых нитей с Z-линией. Тонкие актиновые нити одним концом прикреплены к Z-линии, а другим направляются к середине сaркомера и частично входят между толстыми нитями. [17]
· Толстая нить. Каждая миозиновая нить состоит из 300–400 молекул миозина и С–белка. Половина молекул миозина обращена головками к одному концу нити, а вторая половина — к другому. Гигантский белок титин связывает свободные концы толстых нитей с Z-линией.
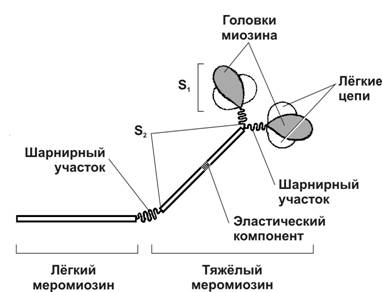
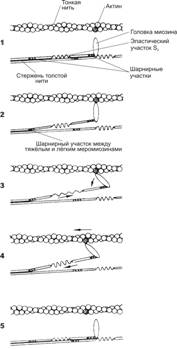
à Миозин (рис. 7-4). В молекуле миозина различают тяжёлый и лёгкий меромиозины. Тяжёлый меромиозин имеет два субфрагмента (S). S1 содержит глобулярные головки миозина, S2 — эластический компонент, допускающий отхождение S1 на расстояние до 55 нм. Концевую часть хвостовой нити миозина длиной 100 нм образует лёгкий меромиозин. Миозин имеет два шарнирных участка, позволяющих молекуле изменять конформацию. Один шарнирный участок находится в области соединения тяжёлого и лёгкого меромиозинов, другой — в области шейки молекулы миозина (соединение S1-S2). Лёгкий меромиозин лежит в толще толстой нити, тогда как тяжёлый меромиозин (благодаря шарнирным участкам) выступает на её поверхность (рис. 7-5).
Рис. 7-4. Молекула миозина. Лёгкий меромиозин обеспечивает агрегацию молекул миозина, тяжёлый меромиозин имеет связывающие актин участки и обладает активностью АТФазы. [17]
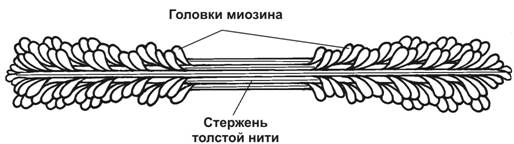
Рис. 7-5. Толстая нить. Молекулы миозина способны к самосборке и формируют веретенообразный агрегат диаметром 15 нм и длиной 1,5 мкм. Фибриллярные хвосты молекул образуют стержень толстой нити, головки миозина расположены спиралями и выступают над поверхностью толстой нити. [17]
à Титин — наибольших размеров полипептид (из известных) с Mr 3000 кД — работает наподобие молекулярной пружины, обеспечивая структурную целостность миофибрилл во время сокращения. Один конец молекулы проникает в Z-линию и через a-актинин связывается с молекулой титина соседнего саркомера, другой конец приближается к М-линии и при помощи миомезина (М-белок) прикрепляется к свободному концу молекулы титина второй половины саркомера. В I-диске титин ассоциирован с тонкими нитями, а в А-диске этот белок связывается с толстыми нитями. Контактируя в области Z-линии и М-линии, молекулы титина образуют непрерывную цепь.
à С-белок стабилизирует структуру миозиновых нитей. Влияя на агрегацию молекул миозина, обеспечивает одинаковый диаметр и стандартную длину толстых нитей.
à Креатинфосфокиназа ассоциирована с толстыми нитями в середине тёмного диска, способствует быстрой регенерации АТФ из АДФ при сокращении.
· Тонкая нить состоит из актина, тропомиозина и тропонинов (рис. 7-6).
Рис. 7-6. Тонкая нить — две спирально скрученные нити F–актина. В канавках спиральной цепочки залегает двойная спираль тропомиозина, вдоль которой располагаются молекулы тропонина. [17]
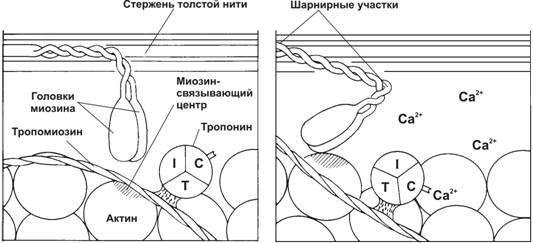
à Актин. Молекулы глобулярного актина (G–актин) полимеризуются и образуют фибриллярный актин (F–актин). В состав тонкой нити входят две спирально закрученные цепочки F–актина.
à Тропомиозин состоит из двух полипептидных цепей и имеет конфигурацию двойной спирали. Полярные молекулы тропомиозина длиной 40 нм укладываются конец в конец в желобке между двумя спирально закрученными цепочками F–актина. Существует как минимум четыре гена, кодирующих мышечные и немышечные изоформы тропомиозина.
Немалиновая миопатия — мутация гена тропомиозина-3, передающаяся по аутосомно-доминантному типу. При биопсии в саркоплазме мышечных волокон I типа обнаруживаются палочковидные включения, формирующиеся из материала Z-линий.
à Тропонин (Tn) — комплекс, образованный тремя глобулярными СЕ: TnT, TnI, TnC. ТnT имеет участки для связи с тропомиозином. TnC — Ca2+-связывающий белок. TnI препятствует взаимодействию актина с миозином. Тропониновый комплекс прикреплён к молекулам тропомиозина с интервалами 40 нм.
à Небулин — фибриллярный белок, ассоциированный с тонкими нитями. Небулин проходит от Z-линии до свободного конца тонких нитей и контролирует их длину.
à a–Актинин, десмин и виментин — входят в состав Z-линии, в которую вплетён один конец тонкой нити.
Саркоплазматическая сеть
Каждая миофибрилла окружена регулярно повторяющимися элементами сaркоплазматического ретикулума — анастомозирующими мембранными трубочками, заканчивающимися терминальными цистернами (рис. 7-7). На границе между тёмным и светлым дисками две смежные терминальные цистерны контактируют с Т-трубочками, образуя так называемые триады. Саркоплазматический ретикулум — модифицированная гладкая эндоплазматическая сеть, выполняющая функцию депо кальция. Ca2+-связывающий белок кальсеквестрин находится внутри саркоплазматической сети. Ca2+ через кальциевые каналы (рецепторы рианодина RyR1), высвобождается из депо в саркоплазму в момент сокращения мышечного волокна. Са2+-транспортирующие АТФазы (SERCA — sarcoplasmic and endoplasmic reticulum calcium ATPase) в мембране саркоплазматического ретикулума откачивают Ca2+ из саркоплазмы обратно в депо кальция при расслаблении мышечного волокна. При гидролизе одной молекулы АТФ SERCA обеспечивает перенос через мембрану цистерны сaркоплазматического ретикулума двух H+ и двух Ca2+.
Рис. 7-7. Фрагмент скелетного мышечного волокна. Цистерны саркоплазматического ретикулума окружают каждую миофибриллу. Т-трубочки подходят к миофибриллам на уровне границ между тёмными и светлыми дисками и вместе с терминальными цистернами саркоплазматического ретикулума образуют триады. Между миофибриллами залегают митохондрии. [17]
Сопряжение возбуждения и сокращения
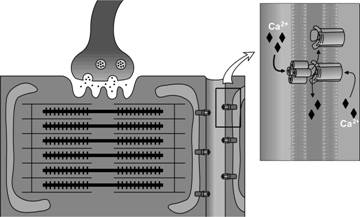
Сарколемма мышечного волокна образует множество узких впячиваний — поперечных трубочек (Т-трубочки). Они проникают внутрь мышечного волокна и, залегая между двумя терминальными цистернами сaркоплазматического ретикулума, вместе с последними формируют триады. В триадах происходит передача возбуждения в виде потенциала действия плазматической мембраны мышечного волокна на мембрану терминальных цистерн — сопряжение возбуждения и сокращения. В мембрану Т-трубочек вмонтированы потенциалозависимые Са2+-каналы L-типа (дигидропиридиновые рецепторы), образующие тетрады. При этом каждая тетрада располагается напротив одного рецептора рианодина (Ca2+ -канала) в мембране терминальных цистерн саркоплазматического ретикулума. Деполяризация мембраны Т-трубочек вызывает в структуре рецепторов дигидропиридина, входящих в состав тетрады, конформационные изменения, которые соответственно передаются на четыре СЕ рецептора рианодина саркоплазматического ретикулума. Активированные таким образом рцепторы рианодина (Ca2+ -каналы в мембране терминальных цистерн) обеспечивают выход Са2+ из полостей саркоплазматического ретикулума в саркоплазму (рис. 7-8).
Рис. 7-8. Сопряжение возбуждения и сокращения в скелетном мышечном волокне. Тетрада Са2+-каналов L-типа в мембране Т-трубочки прямо контактируют с четырьмя СЕ Ca2+ -канала в мембране терминальных цистерн саркоплазматического ретикулума. Потенциалозависимые Са2+-каналы L-типа регистрируют деполяризацию плазмолеммы и активируют Ca2+ -каналы в мембране саркоплазматического ретикулума, обеспечивающие выход Ca2+ в саркоплазму. [114]
Иннервация
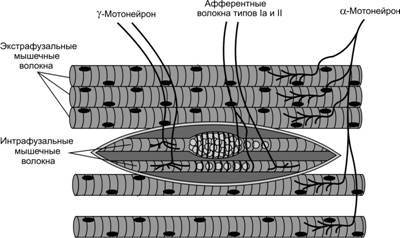
Двигательная соматическая иннервация скелетных мышц (мышечных волокон) осуществляется a- и g-мотонейронами передних рогов спинного мозга и двигательных ядер черепных нервов, а чувствительная соматическая — псевдоуниполярными нейронами чувствительных спинномозговых узлов и нейронами чувствительных ядер черепных нервов. В скелетных мышцах различают два типа мышечных волокон: экстрафузальные и интрафузальные. Каждое экстрафузальное мышечное волокно имеет прямую двигательную иннервацию — нервно-мышечный синапс, образованный терминальным ветвлением аксона a-мотонейрона и специализированным участком плазмолеммы мышечного волокна (концевая пластинка, постсинаптическая мембрана). Интрафузальные мышечные волокна входят в состав чувствительных нервных окончаний скелетной мышцы — мышечных веретён. Интрафузальные мышечные волокна образуют нервно-мышечные синапсы с эфферентными волокнами g-мотонейронов и чувствительные окончания с волокнами псевдоуниполярных нейронов спинномозговых узлов (рис. 7-9). Вегетативная иннервация мышечных волокон не обнаружена, но ГМК стенки кровеносных сосудов скелетных мышц имеют симпатическую адренергическую иннервацию.
Рис. 7-9. Иннервация экстрафузальных и интрафузальных мышечных волокон. Экстрафузальные мышечные волокна скелетных мышц туловища и конечностей получают двигательную иннервацию от a-мотонейронов передних рогов спинного мозга. Интрафузальные мышечные волокна в составе мышечных веретён имеют как двигательную иннервацию от g-мотонейронов, так и чувствительную (афферентные волокна Iа и II типов чувствительных нейронов спинномозгового узла. [74]
Двигательная иннервация
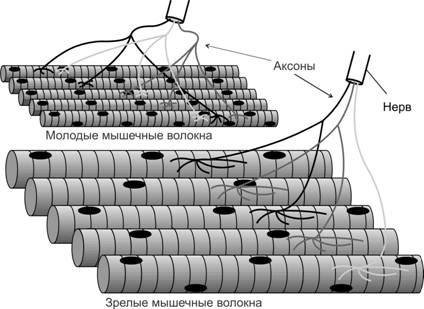
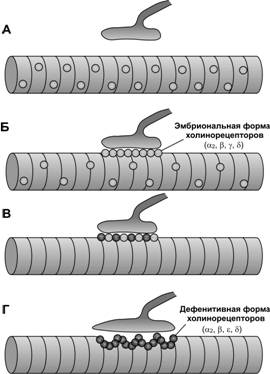
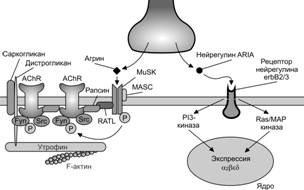
Формирование нервно-мышечного синапса. Мотонейроны направляют свои аксоны в места закладки скелетных мышц приблизительно в то время, когда появляются мышечные трубочки. Несколько аксонов подрастают к месту первого контакта (полинейронная иннервация), однако, только один наиболее активный аксон сформирует дефинитивный нервно-мышечный синапс (Рис. 7-10). В мышечной трубочке до контакта с аксоном мотонейрона экспрессируется эмбриональной формы н-холинорецепторов, состоящих из 2 a–СЕ, 1 b-, 1 g- и 1 d–СЕ. В месте вхождения аксонов в формирующуюся мышцу образуются первые неспециализированные нервно-мышечные контакты. Эмбриональные н-холинорецепторы, диффузно распределённые в мембране мышечной трубочки, концентрируются в области будущего синапса (рис. 7-11). Импульсация мотонейрона, передающаяся на мышечную трубочку, ингибирует экспрессию эмбриональной g–СЕ холинорецептора. При этом из нервной терминали секретируются нейрогенные молекулы агрин и нейрегулины, в том числе ARIA [AChR (acetylcholine receptor) inducing activity — индуцирующий активность холинорецепторов]. ARIA образуется в результате альтернативного сплайсинга первичного транскрипта гена nrg-1, транспортируется по аксону и секретируется в синаптическую щель. В мембране мышечной трубочки ARIA связывается с рецепторными тирозин киназами ErbB3 и ErbB4, принадлежащим к семейству рецепторов эпидермального фактора роста (EGF). Фосфорилированные рецепторы ErbB3 и ErbB4 инициируют фосфатидил инозитол 3-киназный (PI 3-K) и митоген-активированный протеин киназный (MAP-K) сигнальные каскады, активирующие экспрессию гена холинорецептора AChR в ядрах мышечной трубочки. Молекула агрина взаимодействует с мышечно-специфической тирозин киназой MuSK, обеспечивающей кластеризацию рапсина. Одна молекула рапсина связана с одной молекулой холинорецептора, при этом рапсин взаимодействует с белками цитоскелета постсинаптической мембраны, в том числе с утрофином, дистрогликанами, дистробревином, синтрофином, обеспечивая кластеризацию холинорецепторов в постсинаптической мембране (рис. 7-12).
Рис. 7-10. Элиминация полинейронной иннервации. В плодном периоде мышечные волокна иннервируются 2-6 аксонами. В постнатальном периоде конкурентное взаимодействие нервных терминалей (в т.ч. за нейротрофические факторы, продуцируемые мышечными волокнами) устраняет неактивные аксоны и только один наиболее активный аксон сформирует дефинитивный нервно-мышечный синапс. [74]
Рис. 7-11. Образование
нервно-мышечного синапса. А. В
мышечных трубочках ещё до установления контакта с аксоном экспрессируется
эмбриональная форма холинорецепторов (a2bgd), которые равномерно распределены по плазмолемме миотубы. Б. Через
несколько часов после подрастания аксона к мышечной трубочке происходит
агрегация холинорецепторов в месте контакта аксона и миотубы. В. Через
двое суток в результате электрической активности аксона ингибируется экспрессия g СЕ холинорецепторов и начинается синтез e СЕ. Г. В постнатальном периоде под
нервной терминалью образуются складки плазмолеммы и агрегаты из ядер мышечного волокна. [74]
Рис. 7-12. Роль аксона в созревании постсинаптической мембраны. Из нервной терминали в синаптическую щель секретируются нейрогенные молекулы. Нейрегулин (ARIA) стимулирует экспрессию генов дефинитивной формы холинорецепторов (a2bed), а агрин, активируя MuSK, способствует кластеризации рапсина, взаимодействующего с холинорецепторами и белками цитоскелета постсинаптической мембраны. [74]
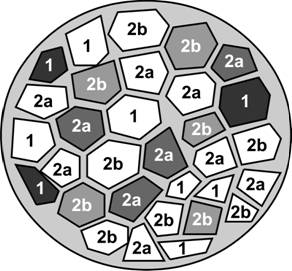
Нейромоторная (двигательная) единица. Одна нейромоторная единица включает один мотонейрон и группу иннервируемых им экстрафузальных мышечных волокон. Количество и размеры двигательных единиц в различных мышцах значительно варьируют. Аксон одного из мотонейронов может иннервировать от одного до нескольких сотен мышечных волокон. Поскольку при сокращении фазные мышечные волокна подчиняются закону всё или ничего, то сила, развиваемая мышцей, зависит от количества активируемых (т.е. участвующих в сокращении мышечных волокон) двигательных единиц. Существует три типа нейромоторных единиц: медленная (S), быстрая неутомляемая (FR) и быстрая утомляемая (FF). Каждая нейромоторная единица образована только медленносокращающимися, быстросокращающимися неутомляемыми или быстросокращающимися утомляемыми мышечными волокнами. Тип нейромоторной единицы зависит от частоты импульсации, генерируемой мотонейроном. Различают медленные (S) и быстрые мотонейроны (F) с частотой импульсации 15-25 Гц и 40-60 Гц, соответственно. S-мотонейроны иннервируют медленносокращающиеся мышечные волокна, а F-мотонейроны — быстросокращающиеся. Мышечные волокна, принадлежащие разным нейромоторным единицам, имеют мозаичное распределение в скелетной мышце (рис. 7-13).
Рис. 7-13. Мозаичное распределение мышечных волокон разных нейромоторных единиц. Мышечные волокна одного типа (1, 2a, 2b), принадлежащие одной нейромоторной единице, находятся между волокон других нейромоторных единиц. [77]
Полинейронная иннервация. В постнатальном периоде фазное мышечное волокно иннервируются только одним мотонейроном, в то же время тонические мышечные волокна, например наружных глазных мышц, получают полинейронную иннервацию.
Сокращение и расслабление
Сокращение мышечного волокна происходит при поступлении по аксонам двигательных нейронов к нервно-мышечным синапсам волны возбуждения в виде нервных импульсов (потенциалы действия нервных волокон). Это непрямое сокращение, оно опосредовано нервно-мышечной синаптической передачей возбуждения. Возможно и прямое сокращение мышцы. Под ним понимают сокращение групп мышечных волокон, происходящее при возбуждении любого звена последовательности событий после секреции нейромедиатора из терминалей аксона в нервно-мышечном синапсе. Прямое сокращение мышцы (например, мышечные подёргивания, или фибрилляции) — всегда патология.
Деполяризация постсинаптической мембраны
Возбуждение мотонейрона приводит к секреции ацетилхолина из терминалей аксона в синаптическую щель. Ацетилхолин связывается с его рецепторами (н-холинорецепторами), вмонтированными в постсинаптическую мембрану мышечного волокна (плазмолемма). Результат взаимодействия — деполяризация мембраны мышечного волокна, т.к. при взаимодействии нейромедиатора с холинорецептором открывается ионный канал в составе рецептора. Взаимодействие рецептора и ацетилхолина кратковременно, т.к. присутствующая в синапсе ацетилхолинэстераза гидролизует нейромедиатор. Нарушения в любом звене нервно-мышечной передачи приводят к искажениям мышечного сокращения.
· Ботулизм — острая бактериальная токсикоинфекция. Возбудитель ботулизма — Clostridium botulinum (анаэробная грамотрицательная спорообразующая палочка, устойчивая во внешней среде) продуцирует термолабильные нейротоксины (7 разновидностей). Симптомы заболевания обусловлен действием на организм нейротоксинов A/E, B, C1, D, F и G, блокирующих секрецию ацетилхолина из нервной терминали. Под действием токсинов через 18-36 ч часто появляются нарушения со стороны вегетативной нервной системы (сухость во рту, раздвоение в глазах), позже развиваются парезы и параличи скелетной и гладкой мускулатуры. Смерть может наступить от паралича дыхательной мускулатуры.
· Столбняк — острое тяжёлое инфекционное заболевание, протекающее с перемежающимися тоническими и клоническими судорогами скелетной мускулатуры, приводящими к асфиксии. Возбудитель — подвижная анаэробная спорообразующая палочка Clostridium tetani. В ране спора прорастает в вегетативную форму и продуцирует столбнячный нейротоксин (тетаноспазмин). Ретроградным аксонным транспортом нейротоксин попадает в перикарионы нейронов спинного мозга. Механизм действия токсина связан с блокированием секреции тормозных нейромедиаторов, в частности, глицина и g-аминомасляной кислоты, вставочными нейронами (интернейронами), которые в норме подавляют импульсную активность мотонейронов, иннервирующих скелетные мышцы. Поэтому импульсация мотонейронов непрерывно передаётся на мышечные волокна, обусловливая тоническое напряжение мышц, переходящее в судороги. Характерно начало заболевания с судорожного сокращения жевательных мышц. К профилактическим мероприятиям столбняка относятся активная вакцинация в детстве, а также вакцинация сразу после полученной травмы.
· Миастения тяжёлая псевдопаралитическая (myasthenia gravis) — аутоиммунное заболевание, при котором образуются АТ к н-холинорецепторам. Циркулирующие в крови АТ связываются с н-холинорецепторами постсинаптической мембраны мышечных волокон и препятствуют взаимодействию холинорецепторов с ацетилхолином и угнетают их функцию, что приводит к нарушению синаптической передачи и развитию мышечной слабости.
· Миорелаксанты периферического действия широко применяются в анестезиологии.
à d-Тубокурарин — классический антагонист холинорецепторов — обратимо связывается с a–СЕ н-холинорецепторов и таким образом препятствует деполяризующему действию ацетилхолина, вызывая миопаралитический эффект.
à Сукцинилхолин — классический агонист холинорецепторов — конкурирует с ацетилхолином за связывание с н-холинорецепторами. Сукцинилхолин обладает устойчивостью к ферменту ацетилхолинэстеразе, гидролизующей ацетилхолин, что приводит к пролонгированной активации холинорецепторов, сопровождающейся деполяризацией мембраны. Первоначально деполяризация приводит к повторяющимся сокращениям скелетной мускулатуры (тремор). Далее в результате инактивации Na+-каналов наступает миопаралитический эффект.
Злокачественная гипертермия. Применение сукцинилхолина и галотана в анестезиологии может стать причиной злокачественной гипертермии — редкое осложнение при наркозе (смертность до 70%). В результате массированного выхода Ca2+ из саркоплазматического ретикулума появляется мышечная ригидность, повышенный гидролиз АТФ усиливает мышечные сокращения, уровень метаболизма и теплообразование. Температура тела быстро поднимается до 43 °C и выше, происходит генерализованный рабдомиолиз. Лечение включает охлаждение тела больного, ингаляция 100% кислорода, введение препаратов, блокирующих выход Са2+ из саркоплазматического ретикулума.
· Ингибиторы ацетихолиэстеразы усиливают амплитуду и продолжительность ответа холинорецепторов при активации ацетилхолином. В нормальных физиологических условиях ацетилхолинэстераза разрушает ацетихолин, прекращая действие нейромедиатора.
à Физостигмин (растительный алкалоид) и его синтетический аналог простигмин (неостигмин) — обратимые ингибиторы ацетихолиэстеразы — применяются при лечении myasthenia gravis.
à Фосфорорганические соединения. Синтетический препарат диизопропилфлуорофосфат (DFP) и нейротоксин [анатоксин-а(s)] сине-зелёных водорослей (Anaebena flos-aquae) необратимо инактивируют ацетилхолинэстеразу. Отравление домашних животных происходит при употреблении воды из контаминированного сине-зелёными водорослями пруда.
à Фасцикулин — токсин яда змеи мамба — высокоспецифический ингибитор ацетихолиэстеразы.
Плазмолемма и потенциал действия
Локальная деполяризация постсинаптической мембраны приводит к генерации потенциала действия, быстро распространяющегося по всей плазмолемме мышечного волокна (включая Т-трубочки).
· Электромиография — важный диагностический метод — позволяет регистрировать характеристики потенциалов действия.
· Ионные каналы, обеспечивающие развитие потенциала действия, рассмотрены в главе 2. m-Конотоксин морской змеи (Conus geographus) ингибирует потенциалозависимый Na+-канал, что блокирует генерацию потенциал действия, несмотря на секреция ацетилхолина из нервной терминали и активацию холинорецепторов.
· Миотония. Уменьшение Cl–-проводимости плазмолеммы ведёт к электрической нестабильности мембраны мышечных волокон и к развитию миотонии (например, болезни Томсена).
Триады и передача сигнала на саркоплазматическую сеть
Волна деполяризации по Т-трубочкам проникает до триад. В области триад мембрана Т-трубочек содержит потенциалозависимые Са2+-каналы L-типа (рецепторы дигидропиридина). Деполяризация мембраны Т-трубочек вызывает в структуре рецепторов дигидропиридина конформационные изменения, передающиеся на рецепторы рианодина (Ca2+-каналы) терминальных цистерн саркоплазматического ретикулума.
· Дефект гена рецептора дигидропиридина CACNL1A3 — причина гипокалиемической формы семейного периодического паралича, характеризующегося генерализованной мышечной слабостью на фоне гипокалиемии.
· Мутации гена рецептора рианодина скелетномышечного типа выявлены при спорадической миопатии (болезнь центрального стержня) и в части случаев злокачественной гипертермии.
Саркоплазматический ретикулум и выброс Ca2+
Активация рецепторов рианодина (Ca2+-канал) приводит к открытию Ca2+-каналов, Ca2+ из Ca2+-депо (саркоплазматическая сеть) поступает в саркоплазму; концентрация Ca2+ в саркоплазме с 10-7 М достигает 10-5 М, что достаточно для связывания этого двухвалентного катиона с тропонином С (TnC) тонких нитей.
Взаимодействие тонких и толстых нитей
Связывание Ca2+ тонкими нитями. В покое взаимодействие тонких и толстых нитей невозможно, т.к. миозинсвязывающие участки молекул актина заблокированы тропомиозином. При высокой концентрации Ca2+ эти ионы связываются с TnC и вызывают конформационные изменения тропомиозина, приводящие к разблокированию миозинсвязывающих участков молекул актина (рис. 7-14). Головки миозина присоединяются к тонкой нити и изменяют свою конформацию, создавая тянущее усилие — тонкие нити начинают скользить между толстыми.
Рис. 7-14. Ca2+-зависимый механизм регуляции взаимодействия актина с миозином. В покое миозинсвязывающие участки тонкой нити заняты тропомиозином. При сокращении ионы Ca2+ связываются с TnC, а тропомиозин открывает миозинсвязывающие участки. Головки миозина присоединяются к тонкой нити и вызывают её смещение относительно толстой нити [17]
Модель скользящих нитей была предложена Хью Хаксли. Скольжение тонких нитей относительно толстых обеспечивает чередование рабочих циклов. Каждый цикл имеет несколько стадий (рис. 7-15).
Рис. 7-15. Цикл скольжения тонких нитей относительно толстых. Тяжёлый меромиозин выступает над поверхностью толстой нити (1). Благодаря шарнирному участку между тяжёлым и лёгким меромиозинами, головка миозина, несущая продукты гидролиза АТФ (АДФ и Pi), прикрепляется к миозин-связывающему участку актина (2), происходит наклон головки миозина с одновременным растягиванием эластического компонента S2 (3). Из головки освобождаются АДФ и Pi, а последующая ретракция эластического компонента S2 вызывает тянущее усилие (4). Затем к головке миозина присоединяется новая молекула АТФ, что приводит к отделению головки миозина от молекулы актина. Гидролиз АТФ возвращает молекулу миозина в исходное положение. [17]
Укорочение саркомера и сокращение мышечного волокна. Головка миозина совершает около пяти циклов в секунду. Когда одни головки миозина толстой нити производят тянущее усилие, другие в это время свободны и готовы вступить в очередной цикл. Следующие друг за другом гребковые движения стягивают тонкие нити к центру сaркомера. Скользящие тонкие нити тянут за собой Z-линии, вызывая укорочение сaркомера (рис. 7-16). Поскольку в процесс сокращения практически одномоментно вовлечены все саркомеры мышечного волокна, происходит его укорочение.
Рис. 7-16. Саркомер расслабленного (I) и сокращённого (II) мышечного волокна. При сокращении саркомера свободные концы тонких нитей приближаются к М-линии, уменьшая ширину Н-зоны. Поскольку противоположные концы тонких нитей прикреплены к Z-линиям, то при скольжении тонких нитей возникает тянущее усилие, Z-линии сближаются, что и приводит к уменьшению ширины I-диска. Длина А-диска, соответствующая расположению толстых нитей, не уменьшается, т.к. длина обоих типов нитей (тонких и толстых) при сокращении не изменяется (нити скользят относительно друг друга при постоянной их длине). [17]
Расслабление
Ca2+-АТФаза (SERCA) сaркоплазматического ретикулума закачивает Ca2+ из сaркоплазмы в цистерны ретикулума, где Ca2+ связывается с кальсеквестрином. При низкой сaркоплазматической концентрации Ca2+ тропомиозин закрывает миозинсвязывающие участки и препятствует их взаимодействию с миозином.
· Фосфоламбан в медленных мышечных волокнах ингибирует Ca2+-АТФазу, поддерживая сокращение. цАМФ-зависимая протеин киназа А путём фосфорилирования фосфоламбана снимает его действие на Ca2+-АТФазу, облегчая таким образом процесс расслабления мышечного волокна.
· Трупное окоченение. После смерти, когда содержание АТФ в мышечных волокнах снижается вследствие прекращения её синтеза, головки миозина оказываются устойчиво прикреплёнными к тонкой нити. Это состояние трупного окоченения (rigor mortis) продолжается, пока не наступит аутолиз, после чего мышцы утрачивают ригидность.
· Миопатия Броди — недостаточность Са2+-АТФазы саркоплазматического ретикулума, проявляющаяся симптомами мышечной усталости при физической нагрузке.
Типы мышечных волокон
Скелетные мышцы и образующие их мышечные волокна различаются по множеству параметров — скорости сокращения, утомляемости, диаметру, цвету и т.д. Например, цвет мышцы может быть обусловлен рядом причин: количеством митохондрий, содержанием миоглобина, плотностью кровеносных капилляров. Традиционно выделяют красные и белые, а также медленные и быстрые мышцы и волокна. Каждая мышца содержит разные типы мышечных волокон. Тип мышцы определяют, исходя из преобладания в ней конкретного типа мышечных волокон. На практике важны следующие классифицирущие критерии типов мышечных волокон: характер сокращения, скорость сокращения, тип окислительного обмена. Типирование мышечных волокон проводится при гистохимическом выявлении активности АТФазы миозина и сукцинатдегидрогеназы (СДГ) (рис. 7-16А).
Рис. 7-16А. Типы волокон скелетной мышцы. Гистохимическое выявление активности АТФазы миозина и сукцинатдегидрогеназы (СДГ). A (слева) — активность АТФазы миозина: тип I — медленносокращающиеся; II — быстросокращающиеся. Б (справа) — активность СДГ: А — белое (гликолитическое); B — промежуточное (окислительно-гликолитическое); C — красное (окислительное).
Фазные и тонические
Экстрафузальные мышечные волокна подразделяют на фазные, осуществляющие энергичные сокращения, и тонические, специализированные на поддержание статического напряжения, или тонусa. Произвольная мускулатура человека практически полностью состоит из фазных мышечных волокон, генерирующих потенциалы действия. В ответ на нервную стимуляцию они отвечают быстрым сокращением. Тонические мышечные волокна встречаются лишь в наружных ушных и наружных глазных мышцах. Тонические мышечные волокна имеют более низкий потенциал покоя (-50–-70 мВ). Степень деполяризации мембраны зависит от частоты стимуляции. Поэтому лишь повторные нервные стимулы вызывают сокращение тонических волокон.
Быстрые и медленные
Скорость сокращения мышечного волокна определяется типом миозина. Изоформа миозина, обеспечивающая высокую скорость сокращения, — быстрый миозин (характерна высокая активность АТФазы), изоформа миозина с меньшей скоростью сокращения — медленный миозин (характерна меньшая активность АТФазы). Следовательно, активность АТФазы миозина отражает скоростные характеристики скелетной мышцы. Мышечные волокна, имеющие высокую активность АТФазы, — быстросокращающиеся волокна (быстрые волокна), для медленносокращающихся волокон (медленные волокна) характерна низкая АТФазная активность. Изоформы тропомиозина, TnС и Са2+-АТФазы (SERCA) также отличаются в быстрых и медленных мышечных волокнах. Гены тропомиозина-1, TnС2 и SERCA1 экспрессируется в быстрых мышечных волокнах. В медленных мышечных волокнах экспрессируются гены тропомиозина-3, TnС1 и SERCA2а. Медленные волокна генерируют медленные, продолжительные сокращения. Быстрые волокна отвечают короткими, энергичными и более сильными сокращениями. У человека нет мышц, состоящих только из быстрых или только из медленных мышечных волокон.
Окислительные и гликолитические
Двигательная функция требует значительных энергетических затрат. Основной источник энергии — гидролиз макроэрга АТФ. Многочисленные митохондрии удлинённой формы располагаются параллельно миофибриллам. Включения гликогена в саркоплазме создают резерв глюкозы для синтеза АТФ. Мышечные волокна используют окислительный либо гликолитический путь образования АТФ. В ходе аэробного окисления из одной молекулы глюкозы образуются 38 молекул АТФ и конечные продукты метаболизма — вода и углекислый газ (этим типом обмена характеризуются красные волокна). При анаэробном типе метаболизма из одной молекулы глюкозы образуется две молекулы АТФ, а также молочная кислота (этим типом обмена характеризуются белые волокна). Быстрый ресинтез АТФ в момент мышечного сокращения обеспечивает креатинфосфокиназа. Этот фермент катализирует перенос фосфата от фосфокреатина на АДФ с образованием креатина и АТФ. Регенерацию фосфокреатина катализирует креатинкиназа при расслаблении мышечного волокна (АТФ + креатин = АДФ + фосфокреатин). Запасы кислорода необходимы для синтеза АТФ при длительной непрерывной работе мышцы. Миоглобин, как и Hb, обратимо связывает кислород.
Креатин. Ген SC6A8 кодирует Na- и Cl-зависимый транспортёр креатина. Преимущественно ген экспрессируется в скелетной мышце и почке, в меньшей степени в ЦНС, сердце, кишечнике, яичках, предстательной железе. Сцепленные с Х-хромосомой дефекты гена транспортёра креатина — причина задержки развития, умственной отсталости, гипотонии.
· Окислительные, или красные мышечные волокна небольшого диаметра, окружены массой капилляров, содержат много миоглобина. Их многочисленные митохондрии имеют высокой уровень активности окислительных ферментов (например, сукцинатдегидрогеназы).
· Гликолитические, или белые мышечные волокна имеют больший диаметр, в саркоплазме содержится значительное количество гликогена, митохондрии немногочисленны. Для них характерны низкая активность окислительных ферментов и высокая активность гликолитических ферментов. В белых мышечных волокнах молочная кислота выводится в межклеточное пространство, тогда как в красных мышечных волокнах молочная кислота служит субстратом для дальнейшего окисления, в результате которого образуется ещё 36 молекул АТФ.
· Окислительно-гликолитические, или промежуточные волокна имеют умеренную активность сукцинатдегидрогеназы.
Утомляемость
Плотность капиллярной сети вокруг мышечных волокон, количество митохондрий, а также активность окислительных и гликолитических ферментов коррелируют со степенью утомления волокна. Белые гликолитические волокна имеют высокую скорость сокращения и относятся к быстроутомляемым. Среди красных волокон по скорости сокращения и утомляемости выделено два подтипа: быстрые неутомляемые и медленные неутомляемые волокна.
Сводная классификация мышечных волокон
Реально мышечные волокна содержат комбинации различных характеристик (табл. 7-1). Различают три типа мышечных волокон — быстросокращающиеся красные, быстросокращающиеся белые и медленносокращающиеся промежуточные. В зависимости от преобладания в мышцах конкретного типа мышечных волокон скелетные мышцы относят к "красным" и "белым" либо "быстрым" и "медленным". Таким образом, каждая мышца уникальна по спектру входящих в её состав типов мышечных волокон. Этот спектр генетически детерминирован (отсюда практика типирования мышечных волокон при отборе спортсменов-бегунов — спринтеров и стайеров). У бегунов-стайеров преобладают медленные волокна, у бегунов-спринтеров, штангистов — быстрые.
Таблица 7-1. Типы мышечных волокон и их свойства
|
Типы мышечных волокон |
Миозин |
Митохондрии |
Содержание миоглобина |
Утомляемость |
Содержание гликогена |
|
Медленные промежуточные I |
Медленный MHC-I |
Много |
высокое |
медленно |
низкое |
|
Быстрые красные IIa |
Быстрый MHC-IIa |
Много |
высокое |
медленно |
высокое |
|
Быстрые белые IIb |
Быстрый MHC-IIb, IIx |
Мало |
низкое |
утомляемые |
высокое |
Контроль фенотипа мышечных волокон
Иннервация, уровень физической активности, гуморальные факторы (в том числе анаболические стероиды) поддерживают унаследованный спектр мышечных волокон, уникальный для каждой мышцы. Этот спектр генетически детерминирован, а выраженность экспрессии того или иного признака зависит от дифференциальной активности специфических генов. Типы мышечных волокон — разные фенотипы одного миогенного клеточного типа. В красных и белых или медленных и быстрых волокнах транскрибируется миогенный спектр генов. Трофическое влияние нерва считается основным фактором, контролирующим экспрессию фенотипа мышечных волокон.
Трофическое влияние нерва
Нервный контроль подразумевает долговременное воздействие двигательных нейронов на мышечные волокна. Через нервно–мышечные синапсы мотонейроны регулируют фенотипическую экспрессию полностью детерминированного миогенного клеточного типа. Мотонейроны не только контролируют реализацию эндогенной программы мышцы и поддерживают её в дифференцированном состоянии, но и модулируют фенотип мышечных волокон в пределах границы нормы клеточного типа. Нервный контроль мышечных волокон со стороны мотонейронов реализуется (1) при помощи нейрогенных трофических веществ (например, агрин, ARIA), секретируемых из нервной терминали в синаптическую щель и (2) частотой импульсации в аксонах.
· Нейрегулины. Среди трофических факторов, синтезируемых в мотонейронах, идентифицировано семейство нейрегулинов — группы полипептидных факторов (ARIA — acetylcholine-receptor-inducing activity, фактор роста глии (GGF), херегулин, NDF — фактор дифференцировки neu), образующихся в результате альтернативного сплайсинга одного гена. Нейрегулины транспортируются по аксону и секретируются в синаптическую щель, где активируют рецепторные тирозин киназы, контролируя экспрессию специфических генов; в частности, ARIA стимулирует транскрипцию гена н-холинорецептора.
· Импульсация мотонейронов передаётся на плазмолемму мышечного волокна и через потенциалозависимые каналы активирует разные внутриклеточные сигнальные каскады, контролирующие экспрессию фенотипа мышечного волокна. В эмбриогенезе активированные импульсацией аксона потенциалозависимые Са2+-каналы в мембране мышечной трубочки отвечают за репрессию гена холинорецептора в ядрах, локализованных в экстрасинаптической области.
Денервационный синдром
Повреждение мотонейронов или их аксонов сопровождается развитием денервационной атрофии скелетной мышцы. В денервированных мышечных волокнах резко снижается количество миофибрилл и митохондрий, происходит значительное увеличение чувствительности мышечных волокон к эффектам ацетилхолина. По всей поверхности мышечного волокна в мембрану встраиваются экстрасинаптические холинорецепторы (a2bgd), наблюдается возврат к так называемому эмбриональному типу распределения холинорецепторов (рис. 7-17). Степень денервационных нарушений мышцы определяется продолжительностью денервации. Возрастание активности протеолитических ферментов и усиление их активности ведёт к распаду белка в мышечных волокнах, уменьшению объёма и массы мышцы. На поздних стадиях денервации происходит разрастание соединительной ткани, возникают застойные явления в сосудах, развивается жировая дегенерация мышечной ткани, утрачивается способность мышцы к регенерации.
Реиннервация
В случае реиннервации аксон растёт к собственному синапсу (>95%). Новые терминали занимают старые постсинаптические складки, восстанавливая геометрию синапса. Прекращается синтез эмбриональной формы холинорецепторов в экстрасинаптических участках, дефинитивные холинорецепторы (a2bgd), аккумулируются в постсинаптической мембране (рис. 7-17). В норме мышечные волокна одной нейромоторной единицы перемешаны с мышечными волокнами других. В результате спраутинга аксона мотонейрон реиннервирует смежные волокна, что приводит к образованию больших групп мышечных волокон, состоящих из одного типа (рис. 7-18). Реиннервация характеризуется формированием больших по размеру нейромоторных единиц. При этом количество нейромоторных единиц в реиннервированной мышце уменьшается. У больных с выраженной перегруппировкой мышечных волокон отмечаются судороги, прогрессирующая мышечная слабость.
Рис. 7-17. Экспрессия холинорецепторов в условиях денервации и реиннервации. А — нормальное мышечное волокно. Дефинитивная форма холинорецептора (a2bed) экспрессируется в синаптической области. Б — ранние денервационные изменения характеризуются ресинтезом и распределением по всей поверхности мышечного волокна эмбриональной формы холинорецепторов (a2bgd). В — реиннервация прекращает синтез a2bgd изоформы холинорецепторов, кластеры a2bed холинорецепторов строго локализуются в синаптической области. [74]
Рис. 7-18. Ветвление аксонов при реиннервации. А — интактная иннервация мышечных волокон. Б — при частичной денервации аксоны ниже места повреждения дегенерируют. В —ветви интактного аксона растут в направлении денервированных мышечных волокон. Г — интактные аксоны реиннервируют находящиеся рядом денервированные мышечные волокна, что приводит к образованию групп мышечных волокон, иннервированных мотонейроном одного типа. [74]
Регенерация
Физиологическая регенерация
В скелетной мышце постоянно происходит физиологическая регенерация — обновление мышечных волокон. При обновлении мышечных волокон клетки-сaтеллиты вступают в циклы пролиферации с последующей дифференцировкой в миобласты и их включением в состав предсуществующих мышечных волокон.
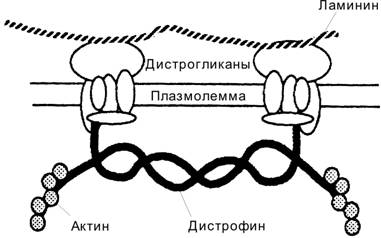
Дистрофин и мышечные дистрофии. Существует ряд наследственных заболеваний, при которых нарушено обновление скелетной мышечной ткани. Мышечная дистрофия Дюшенна — Х-сцепленный дефект (чаще делеция) гена дистрофина. При этом резко уменьшен или отсутствует синтез дистрофина (рис. 7-19), что сопровождается потерей других белков дистрофин-дистрогликанового комплекса, особенно дистрогликанов, и нарушением связей цитоскелета с межклеточным матриксом. Мышечные волокна теряют структурную целостность и при сокращении подвергаются дегенерации. Активированные клетки-сателлиты на месте погибших мышечных волокон образуют новые. Продолжающиеся циклы дегенерации и регенерации мышечной ткани приводят к истощению пула клеток-сателлитов, что сопровождается замещением мышечной ткани жировой. Значительные двигательные расстройства, развивающиеся ко второму десятилетию жизни, ограничивают самостоятельное передвижение больных. Смерть наступает на втором или третьем десятилетии жизни, часто в результате пневмонии.
Рис. 7-19. Дистрофин, дистрогликаны и цитоскелет постсинаптической мембраны. [17]
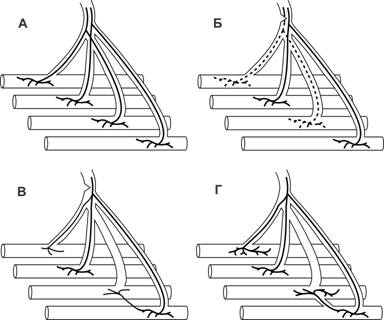
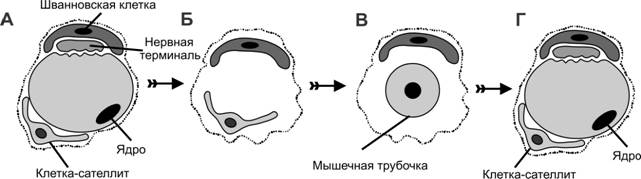
Репаративная регенерация
При гибели симпласта, например после денервации, некротизированный материал подвергается фагоцитозу макрофагами. Под сохранившейся базальной мембраной активированные клетки-сателлиты дифференцируются в миобласты. Далее постмитотические миобласты выстраиваются в цепи и сливаются, образуя мышечные трубочки с характерным для них центральным расположением ядер (рис. 7-20). Синтез сократительных белков начинается в миобластах, а в мышечных трубочках происходят сборка миофибрилл и образование сaркомеров. Миграция ядер на периферию, формирование нервно-мышечного синапса завершают образование зрелых мышечных волокон. Таким образом, в ходе репаративной регенерации происходит повторение событий эмбрионального миогенеза.
Рис. 7-20. Дегенерация и регенерация мышечного волокна. А — иннервированное мышечное волокно. Б — денервация, повлекшая гибель мышечного волокна; участие макрофагов в фагоцитозе некротизированного материала и активация клеток-сателлитов. В — слияние миобластов с образованием мышечной трубочки; подрастание аксона к месту бывшего нервно-мышечного контакта. Г — дифференцировка зрелого мышечного волокна и формирование нервно-мышечного синапса. [74]
Трансплантация
Пересадка мышц. При пересадке мышц используют лоскут из широчайшей мышцы спины. При остеомиелите, ишемической контрактуре и травмах мышечный лоскут, извлечённый из ложа вместе с собственными сосудами и нервом, трансплантируют в место дефекта мышечной ткани.
Перенос камбиальных клеток. При наследственных мышечных дистрофиях применяют введение в дефектные по гену дистрофина мышцы нормальные по этому признаку G0-миобласты. При таком подходе рассчитывают на постепенное обновление дефектных мышечных волокон нормальными.
Сердечная мышечная ткань
Поперечнополосатая мышечная ткань сердечного типа образует мышечную оболочку стенки сердца (миокард). Основной гистологический элемент — кардиомиоцит. Кардиомиоциты присутствуют также в проксимальной части аорты и верхней полой вены.
Кардиомиогенез
Миобласты происходят из клеток спланхнической мезодермы, окружающей эндокардиальную трубку. После ряда митотических делений G1-миобласты начинают синтез сократительных и вспомогательных белков и через стадию G0-миобластов дифференцируются в кардиомиоциты, приобретая вытянутую форму; в сaркоплазме начинается сборка миофибрилл. В отличие от поперечнополосатой мышечной ткани скелетного типа, в кардиомиогенезе не происходит обособления камбиального резерва, а все кардиомиоциты необратимо находятся в фазе G0 клеточного цикла.
Кардиомиоциты
Клетки расположены между элементами рыхлой волокнистой соединительной ткани, содержащей многочисленные кровеносные капилляры бассейна венечных сосудов и терминальные ветвления двигательных аксонов нервных клеток вегетативного отдела нервной системы (рис. 7-21). Каждый миоцит имеет сарколемму (базальная мембрана + плазмолемма). Различают рабочие, атипичные и секреторные кардиомиоциты.
Рис. 7-21. Сердечная мышца в продольном (А) и поперечном (Б) разрезе. [17]
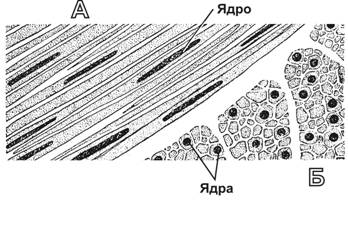
Рис. 7-21А. Сердечная мышца в продольном разрезе. Хорошо заметна сеть ветвящихся поперечнополосатых волокон (1). Вставочные диски (2) в составе мышечных волокон — границы между соседними кардиомиоцитами. Ядра овальной формы (3) ориентированы вдоль продольной оси волокон и занимают центральное положение. Окраска железным гематоксилином.
Рабочие кардиомиоциты
Кардиомиоциты — морфо-функциональные единицы сердечной мышечной ткани, имеют цилиндрическую ветвящуюся форму диаметром около 15 мкм (рис. 7-22). При помощи межклеточных контактов (вставочные диски) рабочие кардиомиоциты объединены в так называемые сердечные мышечные волокна — функциональный синцитий (рис. 7-21А) — совокупность кардиомиоцитов в пределах каждой камеры сердца. Клетки содержат центрально расположенные, вытянутые вдоль оси одно или два ядра, миофибриллы и ассоциированные с ними цистерны саркоплазматического ретикулума (депо Ca2+). Многочисленные митохондрии залегают параллельными рядами между миофибриллами. Их более плотные скопления наблюдают на уровне I-дисков и ядер. Гранулы гликогена сконцентрированы на обоих полюсах ядра. Митохондрии и запасы гликогена поддерживают окислительный метаболизм. Т-трубочки в кардиомиоцитах — в отличие от скелетных мышечных волокон — проходят на уровне Z-линий. В связи с этим Т-трубочка контактирует только с одной терминальной цистерной. В результате вместо триад скелетного мышечного волокна формируются диады.
Рис. 7-22. Рабочий кардиомиоцит — удлинённой формы клетка. Ядро расположено центрально, вблизи ядра находятся комплекс Гольджи и гранулы гликогена. Между миофибриллами лежат многочисленные митохондрии. Вставочные диски (на врезке) служат для скрепления кардиомиоцитов и синхронизации их сокращения. [17]
Сократительный аппарат. Организация миофибрилл и саркомеров в кардиомиоцитах такая же, что и в скелетном мышечном волокне. Одинаков и механизм взаимодействия тонких и толстых нитей при сокращении.
· Сердечные миозины. Существует несколько генов для лёгких и тяжёлых цепей сердечного миозина, различающихся по активности АТФазы. В зрелом миокарде преимущественно синтезируется тяжёлая b-цепь сердечного миозина с низкой АТФазной активностью, в отличие от a-цепи, обладающей высокой АТФазной активностью.
Гипертрофическая кардиомиопатия — гетерогенная группа наследственных заболеваний. Мутации генов тяжёлой b-цепи сердечного миозина (40%), С–белка (42%), TnT, a-тропомиозина сопровождаются гипертрофией кардиомиоцитов и дезорганизацией сердечных мышечных волокон.
· Тропонины. Изоформа тропонина С сходна с TnC1, экспрессирующегося в медленных скелетных мышечных волокнах. TnI характеризуется высокой специфичностью для сердечной мышцы.
Саркоплазматическая сеть. Выход Ca2+ из саркоплазматического ретикулума регулируется через рецепторы рианодина (RyR2). Изменения мембранного потенциала открывают потенциалозависимые Ca2+-каналы, в кардиомиоцитах незначительно повышается концентрация Ca2+. Этот Ca2+ активирует рецепторы рианодина, и Ca2+ из депо выходит в цитозоль (кальций-индуцированная мобилизация Ca2+). В момент расслабления кардиомиоцитов Ca2+-АТФаза SERCA2a закачивает Ca2+ в саркоплазматический ретикулум, где ионы Са2+ связывает сердечная изоформа белка кальсеквестрина. Фосфоламбан регулирует активность SERCA2a. Нефосфорилированная форма фосфоламбана блокирует SERCA2a. Норадреналин через цАМФ-зависимую протеин киназу А путём фосфорилирования фосфоламбана снимает ингибирующий эффект фосфоламбана на Ca2+-АТФазу, облегчая таким образом процесс расслабления мышечного волокна и увеличивая эффективность сокращения. Для предотвращения избыточного депонирования Ca2+ те катионы, которые проникли в клетку через плазмолемму, должны быть выведены во внеклеточное пространство. Натрий-кальциевый анионообменник осуществляет обмен внутриклеточного Ca2+ на внеклеточный Na+.
· Мутация гена фосфоламбана является одной из причин дилатационной кардиомиопатии, характеризующейся диффузным поражением миокарда с дилатацией (расширением) полостей сердца и резким снижением сократительной функции сердца.
· Йодсодержащие гормоны Т3 и Т4 активируют гены, кодирующие Са2+-АТФазу, Na+,K+-АТФазу, b1-адренорецептор, транспортёр глюкозы, предсердный натриуретический пептид. При повышенном содержании в крови Т3 и Т4 в кардиомиоцитах подавляется синтез тяжёлой b-цепи и увеличивается экспрессия гена, кодирующего тяжёлую a-цепь сердечного миозина.
Вставочные диски. На концах контактирующих кардиомиоцитов имеются интердигитации (пальцевидные выпячивания и углубления). Вырост одной клетки плотно входит в углубление другой. На конце такого выступа (поперечный участок вставочного диска) сконцентрированы контакты двух типов: десмосомы и промежуточные. На боковой поверхности выступа (продольный участок вставочного диска) имеется множество щелевых контактов (nexus, нексус), передающих возбуждение от кардиомиоцита к кардиомиоциту.
· Десмосомы обеспечивают механическое сцепление, препятствующее расхождению кардиомиоцитов при сокращении.
· Промежуточные контакты необходимы для прикрепления тонких актиновых нитей ближайшего сaркомера к сарколемме кардиомиоцита.
· Щелевые контакты (nexus) — межклеточные ионные каналы — образуют электрические синапсы, проводящие возбуждение от кардиомиоцита к кардиомиоциту. Это обстоятельство — наряду с проводящей системой сердца — позволяет синхронизировать одновременное сокращение множества кардиомиоцитов в составе функционального синцития.
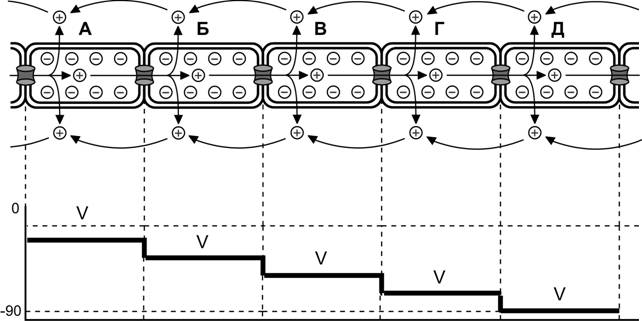
Синхронизация сокращения кардиомиоцитов. Распространение волны деполяризации по сердечным мышечным волокнам обеспечивают электрические синапсы между смежными кардиомиоцитами. Внутриклеточный и внеклеточный потоки ионов, обеспечивающие генерацию потенциала действия и синхронизацию сокращения сердечной мышцы, лежат в основе электромиографического исследования миокарда (рис. 7-23).
Рис. 7-23. Проведение возбуждения между кардиомиоцитами. Положительно заряженные ионы из кардиомиоцита А, в котором возник потенциал действия, через электрические синапсы переходят в смежные клетки (Б, В, Г, Д), вызывая в них деполяризацию (V). Степень деполяризации кардиомиоцитов зависит от расстояния между клетками и приближающейся волной возбуждения. В кардиомиоците (Б) деполяризация активирует потенциалозависимые Na+- и Ca2+-каналы. Поступившие в цитозоль внеклеточные Na+ и Ca2+ приближают деполяризацию мембраны к критическому порогу возникновения потенциала действия и увеличивают внутриклеточный поток положительно заряженных ионов, распространяющийся далее по клеткам (В, Г, Д) впереди волны возбуждения. При этом в результате деполяризации ассоциированные с мембраной положительно заряженные ионы выходят из кардиомиоцитов во внеклеточное пространство и перемещаются в обратном внутриклеточному току направлении. [114]
Предсердные и желудочковые кардиомиоциты. Предсердные и желудочковые кардиомиоциты относятся к разным популяциям рабочих кардиомиоцитов. Предсердные кардиомиоциты относительно мелкие, 10 мкм в диаметре и длиной 20 мкм. В них слабее развита система Т-трубочек, но в зоне вставочных дисков значительно больше щелевых контактов. Желудочковые кардиомиоциты крупнее (25 мкм в диаметре и до 140 мкм в длину), они имеют хорошо развитую систему Т-трубочек. В состав сократительного аппарата миоцитов предсердий и желудочков входят разные изоформы миозина, актина и других контрактильных белков.
Секреторные кардиомиоциты. В части кардиомиоцитов предсердий (особенно правого) у полюсов ядер располагаются хорошо выраженный комплекс Гольджи и секреторные гранулы, содержащие атриопептин — гормон, регулирующий АД. При повышении АД стенка предсердия сильно растягивается, что стимулирует предсердные кардиомиоциты к синтезу и секреции атриопептина, вызывающего снижение АД.
Атипичные кардиомиоциты
Этот устаревший термин относится к миоцитам, формирующим проводящую систему сердца. Среди них различают водители ритма и проводящие миоциты.
Водители ритма (пейсмейкерные клетки, пейсмейкеры, рис. 7-24) — совокупность специализированных кардиомиоцитов в виде тонких волокон, окружённых рыхлой соединительной тканью. По сравнению с рабочими кардиомиоцитами они имеют меньшие размеры. В саркоплазме содержится сравнительно мало гликогена и небольшое количество миофибрилл, лежащих в основном по периферии клеток. Эти клетки имеют богатую васкуляризацию и двигательную вегетативную иннервацию. Так, в синусно-предсердном узле доля соединительнотканных элементов (включая кровеносные капилляры) в 1,5–3 раза, а нервных элементов (нейроны и двигательные нервные окончания) в 2,5–5 раз выше, чем в рабочем миокарде правого предсердия. Главное свойство водителей ритма — спонтанная деполяризация плазматической мембраны. При достижении критического значения возникает потенциал действия, распространяющийся через электрические синапсы по волокнам проводящей системы сердца и достигающий рабочих кардиомиоцитов.
Спонтанная генерация импульсов потенциально присуща не только водителям ритма, но и всем атипичным, а также рабочим кардиомиоцитам. Так, in vitro все кардиомиоциты способны к спонтанному сокращению. В проводящей системе сердца существует иерархия водителей ритма: чем ближе к рабочим миоцитам, тем реже спонтанный ритм.
· Синусно-предсердный узел. Главный водитель ритма — клетки синусно-предсердного узла — локализуется под эпикардом в месте впадения верхней полой вены в правое предсердие, генерирует ритм 60 импульсов в мин. Нормально активность других водителей ритма подавлена. От синусно-предсердного узла импульс распространяется по рабочим кардиомиоцитам правого предсердия, а по переднему, среднему и заднему межузловым трактам достигает предсердно-желудочкового узла. Пучок Бахмана (Bachmann) проводит электрический импульс к рабочим кардиомиоцитам левого предсердия.
· Предсердно-желудочковый узел локализуется в субэндокардиальном слое на правой стороне межпредсердной перегородки около отверстия венечного синуса. В случае нарушения генерации импульсов в синусно-предсердном узле, роль водителя ритма переходит к пейсмекерам предсердно-желудочкового узла, способных генерировать сердечный ритм с частотой 40–50 импульсов в мин.
Рис. 7-24. Атипичные кардиомиоциты. А. Водитель ритма синусно-предсердного узла; Б. Проводящий кардиомиоцит пучка Гиса. [17]
Проводящие кардиомиоциты ¾ Специализированные клетки пучка Гиса и волокон Пуркинье образуют длинные волокна, выполняющие функцию проведения возбуждения от водителей ритма. При нарушении генерации нормального ритма проводящие кардиомиоциты пучка Гиса способны генерировать до 40 импульсов в мин, а волокна Пуркинье — 20 импульсов в мин.
· Пучок Гиса. Кардиомиоциты этого пучка проводят возбуждение от водителей ритма к волокнам Пуркинье, содержат относительно длинные миофибриллы, имеющие спиральный ход; мелкие митохондрии и небольшое количество гликогена. Проводящие кардиомиоциты пучка Гиса входят также в состав синусно-предсердного и предсердно-желудочкового узлов.
· Волокна Пуркинье. Проводящие кардиомиоциты волокон Пуркинье — самые крупные клетки миокарда. В них содержатся редкая неупорядоченная сеть миофибрилл, многочисленные мелкие митохондрии, большое количество гликогена. Кардиомиоциты волокон Пуркинье не имеют Т-трубочек и не образуют вставочных дисков. Они связаны при помощи десмосом и щелевых контактов. Последние занимают значительную площадь контактирующих клеток, что обеспечивает высокую скорость проведения импульса по волокнам Пуркинье.
· Сердечные аритмии — нарушения формирования импульса возбуждения или его проведения.
Иннервация
На деятельность сердца — сложной авторегуляторной и регулируемой системы — оказывает модулирующее влияние множество факторов, в т.ч. двигательная вегетативная иннервация — парасимпатическая и симпатическая. Потенциал действия, запускающий сокращение рабочих кардиомиоцитов, генерируется пейсмейкерами и распространяется через электрические синапсы по волокнам проводящей системы сердца.
Парасимпатическая иннервация осуществляется терминальными варикозными окончаниями аксонов блуждающего нерва, а симпатическая — окончаниями аксонов адренергических нейронов шейного верхнего, шейного среднего и звёздчатого (шейно-грудного) ганглиев. Аксоны парасимпатических и симпатических вегетативных нейронов вместе проходят в составе небольших пучков. Терминальные отделы аксонов вблизи кардиомиоцитов имеют варикозные расширения (варикозности), регулярно расположенные по длине аксона на расстоянии 5–15 мкм друг от друга. Вегетативные нейроны не образуют нервно-мышечных синапсов, характерных для скелетной мышцы. Варикозности содержат нейромедиаторы, откуда и происходит их секреция. Расстояние от варикозностей до кардиомиоцитов в среднем составляет около 1 мкм. Молекулы нейромедиаторов высвобождаются в межклеточное пространство и путём диффузии достигают своих рецепторов в плазмолемме группы кардиомиоцитов. В контексте представления о сердце как о сложной авторегуляторной системе чувствительная иннервация сердца (как вегетативная, так и соматическая) должна рассматриваться как часть системы регуляции кровотока.
Двигательная вегетативная иннервация
Эффекты парасимпатической и симпатической иннервации реализуют соответственно мускариновые холинергические и адренергические рецепторы плазмолеммы разных клеток сердца (кардиомиоциты рабочие и особенно атипические, внутрисердечные нейроны собственного нервного аппарата). Существует множество фармакологических препаратов, имеющих непосредственный эффект на названные рецепторы. Так, норадреналин, адреналин и другие адренергические препараты в зависимости от эффекта на b1-адренорецепторы подразделяют на активирующие (адреномиметики) и блокирующие (адреноблокаторы) агенты. м-Холинорецепторы также имеют аналогичные классы препаратов (холиномиметики и холиноблокаторы).
Парасимпатическая иннервация сердца. Преганглионарные волокна, идущие в составе блуждающего нерва, заканчиваются на нейронах сердечного сплетения и в стенке предсердий. Постганглионарные волокна преимущественно иннервируют синусно-предсердный узел, предсердно-желудочковый узел и предсердные кардиомиоциты. Парасимпатическое влияние вызывает уменьшение частоты генерации импульсов пейсмейкерами (отрицательный хронотропный эффект), снижение скорости проведения импульса через предсердно-желудочковый узел (отрицательный дромотропный эффект) в волокнах Пуркинье, уменьшение силы сокращения рабочих предсердных кардиомиоцитов (отрицательный инотропный эффект).
Ацетилхолин через м2-холинорецепторы, связанные с G–белком, ингибирует аденилатциклазу, уменьшая образование цАМФ и активируя образование цГМФ. цГМФ активирует цГМФ-зависимую киназу, подавляющую активность потенциалозависимых Ca2+-каналов, что вызывает уменьшение частоты сердечных сокращений. Высокий уровень ацетилхолинэстеразы в синусно-предсердном и предсердно-желудочковом узлах обеспечивает кратковременный эффект ацетилхолина при активации парасимпатической системы.
Симпатическая иннервация сердца. Преганглионарные волокна нейронов интермедиолатеральных столбов серого вещества спинного мозга образуют синапсы с нейронами паравертебральных ганглиев. Постганглионарные волокна нейронов среднего шейного и звёздчатого ганглиев иннервируют синусно-предсердный узел, предсердно-желудочковый узел, предсердные и желудочковые кардиомиоциты. Активация симпатических нервов вызывает увеличение частоты спонтанной деполяризации мембран водителей ритма (положительный хронотропный эффект), облегчение проведения импульса через предсердно-желудочковый узел (положительный дромотропный эффект) в волокнах Пуркинье, увеличение силы сокращения предсердных и желудочковых кардиомиоцитов (положительный инотропный эффект).
· МИФ-клетка — малая интенсивно флюоресцирующая клетка — разновидность нейронов, такие клетки найдены практически во всех вегетативных ганглиях. Это небольшая (диаметр 10–20 мкм) и безотростчатая (или с небольшим числом отростков) клетка, содержащая множество крупных гранулярных пузырьков диаметром 50–200 нм с катехоламинами.
· Действие катехоламинов на кардиомиоциты через b1-адренорецепторы обусловлено рядом последующих событий: стимуляция b-адренорецептора адреномиметиком (например, норадреналином) ® через G–белок активируется аденилатциклаза с образованием цАМФ ® активация цАМФ-зависимой протеинкиназы ® фосфорилирование белка р27 сарколеммы ® в саркоплазму увеличивается вход кальция через открытые потенциалозависимые Ca2+-каналы ® усиливается кальций-индуцированная мобилизация Ca2+ в цитозоль через активированные рецепторы рианодина ® в саркоплазме значительно повышается концентрация Ca2+ ® связывание Ca2+ с TnC снимает ингибирующее действие тропомиозина на взаимодействие актина с миозином ® образуется большее количество актомиозиновых связей ® увеличивается сила сокращения.
Регенерация
При ишемической болезни сердца, кардиомиопатиях, миокардитах наблюдаются патологические изменения кардиомиоцитов, включая их гибель, приводящие к сердечной недостаточности (нарушению насосной функции сердца). Репаративная регенерация кардиомиоцитов затруднена, т.к. они находятся в фазе G0 клеточного цикла, а аналогичные скелетно-мышечным клеткам-сателлитам G1-миобласты в миокарде отсутствуют. Однако, кардиомиоциты сохраняют способностть синтезировать ДНК, что не исключает возвращение кардиомиоцитов в клеточный цикл. Инфаркт миокарда — ишемический некроз участка сердечной мышцы, обычно обусловлен окклюзией коронарной артерии. Замещение погибших кардиомиоцитов соединительной тканью приводит к снижению сократительной способности миокарда и развитию сердечной недостаточности.
· Сывороточные маркёры ишемии миокарда:
à Сердечная изоформа тропонина I (TnI) служит надёжным маркёром ишемии миокарда, может быть обнаружена в сыворотке через 4 часа и в течение следующих 7–10 сут после появления характерной боли.
à Креатинкиназа (КК). Скелетно-мышечная форма содержит две М СЕ (КК-ММ), а сердечная КК состоит из М и В СЕ (КК-МВ). При инфаркте миокарда уровень КК-МВ увеличивается в первые 4–8 ч, достигает пика через 24 ч и нормализуется на 2–3 сут после появления характерной боли.
Лактатдегидрогеназа (ЛДГ) состоит из H и M СЕ. ЛДГ-HHHH (или ЛДГ1) и ЛДГ-HHHM (или ЛДГ2) в норме экспрессируются в сердечной мышце. В крови уровень ЛДГ1 увеличивается через 2–3 сут после возникновения боли, когда уровень КК-МВ возвращается к норме. Отношение ЛДГ1/ЛДГ2 > 1.0 подтверждает инфаркт миокарда.
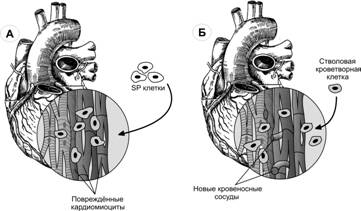
· Клеточная терапия инфаркта миокарда. В эксперименте инъекция стволовых кроветворных клеток человека в хвостовую вену крысы с инфарктом миокарда стимулирует ангиогенез в ишемизированной мышце за счёт трансплантированных клеток (рис. 7-25).
Рис. 7-25. Экспериментальные модели регенерации миокарда. А — SP клетки мыши, трансплантированные в область инфаркта миокарда, дифференцируются в кардиомиоциты. Б — стволовая кроветворная клетка человека индуцирует образование и рост кровеносных сосудов в сердечной мышце крысы при инфаркте миокарда. [143]
Сердечная недостаточность — нарушение способности сердца обеспечивать кровоснабжение органов в соответствии с их метаболическими потребностями — возникает при снижении сократительной способности, увеличении посленагрузки, или изменении преднагрузки.
· Снижение сократительной способности может быть обусловлено следующими причинами:
à Врождённые и приобретённые пороки сердца приводят к перегрузке полостей сердца давлением или объёмом с развитием сердечной недостаточности.
à Артериальная гипертензия. Многие больные с гипертонической болезнью или симптоматическими гипертензиями страдают недостаточностью кровообращения. Снижение сократительной способности миокарда характерно для стойкой тяжёлой гипертензии, быстро приводящей к развитию сердечной недостаточности.
à Кардиомиопатии токсические (алкоголь, кобальт, катехоламины, доксорубицин), инфекционные, при так называемых коллагеновых болезнях, рестриктивные (амилоидоз и саркоидоз, идиопатические).
· Компенсаторные механизмы при сердечной недостаточности. Феномены, вытекающие из закона Франка-Старлинга, в том числе гипертрофия миокарда, дилатация левого желудочка, периферическая вазоконстрикция вследствие выброса катехоламинов, активация системы ренин-ангиотензин-(альдостерон) и вазопрессина, перепрограммирование синтеза миозинов в кардиомиоцитах, увеличение секреции атриопептина, — компенсаторные механизмы, поддерживающие положительный инотропный эффект. Однако, рано или поздно миокард теряет способность обеспечивать нормальный сердечный выброс.
à Гипертрофия кардиомиоцитов в виде увеличения массы клеток (в том числе их полиплоидизация) — компенсаторный механизм, приспосабливающий сердце к функционированию в патологических ситуациях.
à Перепрограммирование синтеза миозинов в кардиомиоцитах происходит при увеличении общего периферического сосудистого сопротивления для поддержания сердечного выброса, а также под влиянием повышенного содержания в крови Т3 и Т4 при тиреотоксикозах. Имеется несколько генов для лёгких и тяжёлых цепей сердечного миозина, различающихся по активности АТФазы, а значит, по длительности рабочего цикла и развиваемому напряжению. Перепрограммирование миозинов (как и других сократительных белков) обеспечивает сердечный выброс на приемлемом уровне до тех пор, пока не будут исчерпаны возможности этого приспособительного механизма. При исчерпании этих возможностей развивается сердечная недостаточность — левосторонняя (гипертрофия левого желудочка с последующей его дилатацией и дистрофическими изменениями), правосторонняя (застой в малом круге кровообращения).
à Ренин-ангиотензин-(альдостерон), вазопрессин — мощная система вазоконстрикции.
à Периферическая вазоконстрикция вследствие выброса катехоламинов.
à Атриопептин — гормон, реализующий вазодилатацию.
Гладкая мышечная ткань
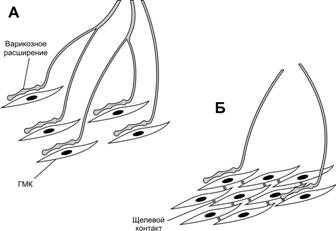
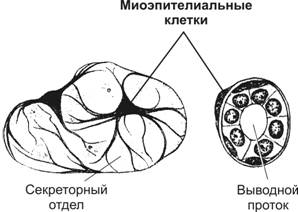
Основной гистологический элемент гладкомышечной ткани — гладкомышечная клетка (ГМК), способная к гипертрофии и регенерации, а также к синтезу и секреции молекул межклеточного матрикса. ГМК в составе гладких мышц формируют мышечную стенку полых и трубчатых органов, контролируя их моторику и величину просвета. Регуляцию сократительной активности ГМК осуществляют двигательная вегетативная иннервация и множество гуморальных факторов. В ГМК отсутствует поперечная исчерченность, т.к. миофиламенты — тонкие (актиновые) и толстые (миозиновые) нити — не образуют миофибрилл.
Развитие
Камбиальные клетки эмбриона и плода (спланхномезодерма, мезенхима, нейроэктодерма) в местах закладки гладкой мускулатуры дифференцируются в миобласты, а затем — в зрелые ГМК, приобретающие вытянутую форму; их сократительные и вспомогательные белки формируют миофиламенты. ГМК в составе гладких мышц находятся в фазе G1 клеточного цикла и способны к пролиферации.
Гладкомышечная клетка
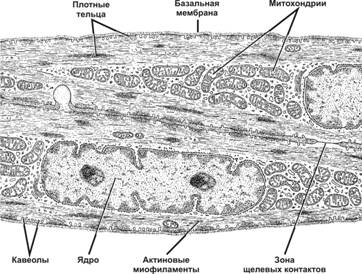
Морфо-функциональная единица гладкой мышечной ткани — ГМК. Заострёнными концами ГМК вклиниваются между соседними клетками и образуют мышечные пучки, в свою очередь формирующие слои гладкой мускулатуры (рис. 7-26, 7-26А). В волокнистой соединительной ткани между миоцитами и мышечными пучками проходят нервы, кровеносные и лимфатические сосуды. Встречаются и единичные ГМК, например, в подэндотелиальном слое сосудов. Форма ГМК — вытянутая веретеновидная, часто отростчатая (рис. 7-27). Длина ГМК от 20 мкм до 1 мм (например, ГМК матки при беременности). Овальное ядро локализовано центрально. В саркоплазме у полюсов ядра расположены хорошо выраженный комплекс Гольджи, многочисленные митохондрии, свободные рибосомы, cаркоплазматический ретикулум. Миофиламенты ориентированы вдоль продольной оси клетки. Базальная мембрана, окружающая ГМК, содержит протеогликаны, коллаген типов III и V. Компоненты базальной мембраны и эластин межклеточного вещества гладких мышц синтезируются как самими ГМК, так и фибробластами соединительной ткани.
Рис. 7-26. Гладкая мышца в продольном (А) и поперечном (Б) разрезе. На поперечном срезе миофиламенты видны как точки в цитоплазме гладкомышечных клеток. [17]
Рис. 7-26А. Гладкая мышца в продольном разрезе. Гладкомышечные клетки (1) имеют веретеновидную форму. В центральной утолщённой части клеток хорошо заметны палочковидные ядра (2). Окраска гематоксилином и эозином.
Рис. 7-27. Гладкомышечная клетка. Центральное положение в ГМК занимает крупное ядро. У полюсов ядра находятся митохондрии, эндоплазматический ретикулум и комплекс Гольджи. Актиновые миофиламенты, ориентированные вдоль продольной оси клетки, прикреплены к плотным тельцам. Миоциты формируют между собой щелевые контакты. [17]
Сократительный аппарат
В ГМК актиновые и миозиновые нити не формируют миофибрилл, характерных для поперечнополосатой мышечной ткани. Молекулы гладкомышечного актина образуют стабильные актиновые нити, прикреплённые к плотным тельцам и ориентированные преимущественно вдоль продольной оси ГМК. Миозиновые нити формируются между стабильными актиновыми миофиламентами при сокращении ГМК. Сборку толстых (миозиновых) нитей и взаимодействие актиновых и миозиновых нитей активируют ионы кальция, поступающие из депо Ca2+. Непременные компоненты сократительного аппарата — кальмодулин (Ca2+-связывающий белок), киназа и фосфатаза лёгкой цепи гладкомышечного миозина.
Депо Ca2+ — совокупность длинных узких трубочек (cаркоплазматический ретикулум) и находящихся под сарколеммой многочисленных мелких пузырьков (кавеолы). Са2+-АТФаза постоянно откачивает Са2+ из цитоплазмы ГМК в цистерны саркоплазматического ретикулума. Через Са2+-каналы кальциевых депо ионы Са2+ поступают в цитоплазму ГМК. Активация Са2+-каналов происходит при изменении мембранного потенциала и при помощи рецепторов рианодина и инозитолтрифосфата.
Плотные тельца (рис. 7-28). В саркоплазме и на внутренней стороне плазмолеммы находятся плотные тельца — аналог Z-линий поперечнополосaтой мышечной ткани. Плотные тельца содержат a–актинин и служат для прикрепления тонких (актиновых) нитей.
Щелевые контакты связывают соседние ГМК и необходимы для проведения возбуждения (ионный ток), запускающего сокращение ГМК.
Рис. 7-28. Сократительный аппарат гладкомышечной клетки. Плотные тельца содержат a–актинин, это аналоги Z-линий поперечнополосaтой мышцы. В саркоплазме они связаны сетью промежуточных филаментов, в местах их прикрепления к плазматической мембране присутствует винкулин. Актиновые нити прикреплены к плотным тельцам, миозиновые миофиламенты формируются при сокращении. [17]
Сокращение
В ГМК, как и в других мышечных тканях, работает актомиозиновый хемомеханический преобразователь, но АТФазная активность миозина в гладкомышечной ткани приблизительно на порядок величины ниже активности АТФазы миозина поперечнополосатой мышцы. Медленное образование и разрушение актин-миозиновых мостиков требуют меньшего количества АТФ. Отсюда, а также из факта лабильности миозиновых нитей (их постоянная сборка и разборка при сокращении и расслаблении соответственно) вытекает важное обстоятельство — в ГМК медленно развивается и длительно поддерживается сокращение. При поступлении сигнала к ГМК сокращение клетки запускают ионы кальция, поступающие из кальциевых депо. Рецептор Ca2+ — кальмодулин. Таким образом, увеличение содержания Ca2+ в миоплазме — ключевое событие для сокращения ГМК.
· Регуляция Ca2+ в миоплазме ГМК — процесс, начинающийся с изменения мембранного потенциала и/или связывания рецепторов плазмолеммы с их лигандами (регистрация сигнала) и заканчивающийся изменением режима работы Ca2+-каналов в депо кальция (открытое или закрытое состояние Ca2+-каналов).
à Изменения мембранного потенциала ГМК происходят при передаче возбуждения от клетки к клетке через щелевые контакты, а также при взаимодействии агонистов (нейромедиаторы, гормоны) с их рецепторами. Изменения мембранного потенциала открывают потенциалозависимые Ca2+-каналы плазмолеммы, и в цитоплазме ГМК повышается концентрация Ca2+. Этот Ca2+ активирует рецепторы рианодина кальциевых депо.
à Лиганд (адреналин, норадреналин, ангиотензин, вазопрессин) через свой рецептор активирует G–белок (Gp), который в свою очередь активирует фосфолипазу С. Фосфолипаза С катализирует образование инозитолтрифосфата. Инозитолтрифосфат активирует рецепторы инозитолтрифосфата, связанные с кальциевыми каналами саркоплазматического ретикулума.
· Активация рецепторов рианодина и инозитолтрифосфата в кальциевых депо открывает их Са2+-каналы, и поступающий в миоплазму Са2+ связывается с кальмодулином.
· Кальмодулин (аналог тропонина С поперечнополосатой мышечной ткани) активирует киназу лёгких цепей миозина, катализирующую фосфорилирование одной из лёгких цепей миозина. Фосфорилирование лёгких цепей миозина служит сигналом для сборки миозиновых нитей и их последующего взаимодействия с тонкими нитями. Фосфорилированный (активный) миозин прикрепляется к актину, головки миозина изменяют свою конформацию, и совершается одно гребковое движение, т.е. втягивание актиновых миофиламентов между миозиновыми. В результате гидролиза АТФ разрушаются актин-миозиновые связи, головки миозина восстанавливают свою конформацию и готовы к образованию новых поперечных мостиков. Продолжающаяся стимуляция ГМК поддерживает формирование новых миозиновых миофиламентов и вызывает дальнейшее сокращение клетки. Таким образом, сила и продолжительность сокращения ГМК определяется концентрацией свободного Са2+, окружающего миофиламенты.
Расслабление
Лиганд (атриопептин, брадикинин, гистамин, VIP) связывается с рецептором и активирует G–белок (Gs), который в свою очередь активирует аденилатциклазу, катализирующую образование цАМФ. Последний активирует работу кальциевых насосов, откачивающих Са2+ из саркоплазмы в полость саркоплазматического ретикулума. При низкой концентрации Са2+ в саркоплазме фосфатаза лёгких цепей миозина осуществляет дефосфорилирование лёгкой цепи миозина, что приводит к инактивации молекулы миозина. Дефосфорилированный миозин теряет сродство к актину, что предотвращает образование поперечных мостиков. Расслабление ГМК заканчивается разборкой миозиновых нитей.
Иннервация
Симпатические (адренергические) и отчасти парасимпатические (холинергические) нервные волокна иннервируют ГМК. Нейромедиаторы диффундируют из варикозных терминальных расширений нервных волокон в межклеточное пространство. Последующее взаимодействие нейромедиаторов с их рецепторами в плазмолемме вызывает сокращение либо расслабление ГМК. Существенно, что в составе многих гладких мышц, как правило, иннервированы (точнее находятся рядом с варикозными терминалями аксонов) далеко не все ГМК. Возбуждение ГМК, не имеющих иннервации, происходит двояко: в меньшей степени — при медленной диффузии нейромедиаторов, в большей степени — посредством щелевых контактов между ГМК.
Гуморальная регуляция
Рецепторы плазмолеммы ГМК многочисленны. В мембрану ГМК встроены рецепторы ацетилхолина, гистамина, атриопептина, ангиотензина, адреналина, норадреналина, вазопрессина и множество других. Агонисты, связываясь со своими рецепторами в мембране ГМК, вызывают сокращение или расслабление ГМК. ГМК разных органов различно реагируют (сокращением либо расслаблением) на одни и те же лиганды. Это обстоятельство объясняется тем, что существуют разные подтипы конкретных рецепторов с характерным распределением в разных органах.
· Гистамин действует на ГМК через рецепторы двух типов: Н1 и Н2.
à Бронхиальная астма. Взаимодействие комплекса Аг-АТ с тучной клеткой приводит к их дегрануляции и выбросу гистамина. Гистамин через рецепторы типа Н1 плазмолеммы ГМК бронхов активирует Gp-белок, который в свою очередь активирует фосфолипазу С. Фосфолипаза С катализирует образование инозитолтрифосфата, стимулирующего высвобождение Са2+ из его депо. Повышение концентрации Са2+ в саркоплазме вызывает сокращение ГМК и как следствие сужение просвета бронхиального дерева — бронхоспазм.
à Анафилактический шок. Выделяющийся в ответ на аллерген из базофилов гистамин активирует рецепторы типа Н1 в ГМК артериол. Через Gs-белок активируется аденилатциклаза, катализирующая образование цАМФ. цАМФ усиливает работу кальциевого насоса в мембране саркоплазматического ретикулума. Уменьшение концентрации Ca2+ в саркоплазме ГМК вызывает их расслабление, что сопровождается резким падением АД (коллапс).
· Норадреналин, выделяющийся из симпатических нервных волокон, взаимодействует с ГМК через адренорецепторы двух типов: a и b.
à Вазоконстрикция. Норадреналин взаимодействует с a-адренорецепторами ГМК стенки артериол, что приводит к сокращению ГМК, вазоконстрикции и повышению АД.
à Перистальтика кишечника. Адреналин и норадреналин подавляют перистальтику кишечника, вызывая расслабление ГМК через a-адренорецепторы.
Типы миоцитов
В основе классификации ГМК находятся различия в их происхождении, локализации, иннервации, функциональных и биохимических свойствах. По характеру иннервации гладкие мышцы делятся на единично и множественно иннервированные (рис. 7-29). По функциональным свойствам различают тонические и фазные ГМК.
Единично иннервированные гладкие мышцы
Гладкие мышцы желудочно-кишечного тракта, матки, мочеточника, мочевого пузыря состоят из ГМК, образующих многочисленные щелевые контакты друг с другом, формируя большие функциональные единицы для синхронизации сокращения. При этом прямую двигательную иннервацию получают лишь отдельные ГМК функционального синцития. Такие ГМК относятся к тоническим. Агонисты в тонических ГМК вызывает постепенную деполяризацию мембраны.
Множественно иннервированные гладкие мышцы
Каждая ГМК мышцы радужки (расширяющие и суживающие зрачок) и семявыносящего протока получает двигательную иннервацию, что позволяет осуществлять тонкую регуляцию сокращения мышц. Такие ГМК относятся к фазным. Они генерируют потенциал действия и имеют относительно быстрые скоростные характеристики.
ГМК радужной оболочки. Имеют нейроэктодермальное происхождение. Они формируют мышцы, расширяющие и суживающие зрачок. Мышцы получают вегетативную иннервацию. Двигательные нервные окончания подходят к каждой ГМК. Мышца, расширяющая зрачок, получает симпатическую иннервацию из пещеристого сплетения, волокна которого транзитом проходят через ресничный ганглий. Мышца, суживающая зрачок, иннервирована постганглионарными парасимпатическими нейронами ресничного ганглия. На этих нейронах оканчиваются преганглионарные парасимпатические волокна, проходящие в составе глазодвигательного нерва.
Рис. 7-29. Иннервация гладкомышечной ткани. А. Множественно иннервированная гладкая мышца. Каждая ГМК получает двигательную иннервацию, щелевые контакты между ГМК отсутствуют. Б. Единично иннервированная гладкая мышца. Иннервированы лишь отдельные ГМК. Смежные клетки связаны многочисленными щелевыми контактами, образующими электрические синапсы. [114]
Висцеральные ГМК
Происходят из мезенхимных клеток спланхнической мезодермы и присутствуют в стенке полых органов пищеварительной, дыхательной, выделительной и половой систем. Многочисленные щелевые контакты компенсируют сравнительно бедную иннервацию висцеральных ГМК, обеспечивая вовлечение всех ГМК в процесс сокращения. Сокращение ГМК медленное, волнообразное. Промежуточные филаменты образованы десмином.
ГМК кровеносных сосудов
Развиваются из мезенхимы кровяных островков. ГМК образуют единично иннервированную гладкую мышцу, но функциональные единицы не такие большие как в висцеральной мускулатуре. Сокращение ГМК сосудистой стенки опосредуют иннервация и гуморальные факторы. Промежуточные филаменты содержат виментин.
Регенерация
Вероятно, среди зрелых ГМК присутствуют недифференцированные предшественники, способные к пролиферации и дифференцировке в дефинитивные ГМК. Более того, дефинитивные ГМК потенциально способны к пролиферации. Новые ГМК возникают при репаративной и физиологической регенерации. Так, при беременности в миометрии происходит не только гипертрофия ГМК, но и значительно увеличивается их общее количество.
Немышечные сокращающиеся клетки
Миоэпителиальные клетки
Миоэпителиальные клетки имеют эктодермальный генез и экспрессируют белки, характерные и для эктодермального эпителия (цитокератины 5, 14, 17), и для ГМК (гладкомышечные актин, a–актинин). Миоэпителиальные клетки окружают секреторные отделы и выводные протоки слюнных, слёзных, потовых, молочных желёз, прикрепляясь при помощи полудесмосом к базальной мембране. От тела клетки отходят отростки, охватывающие эпителиальные клетки желёз (рис. 7-30). Стабильные актиновые миофиламенты, прикреплённые к плотным тельцам, и нестабильные миозиновые, формирующиеся в процессе сокращения, — сократительный аппарат миоэпителиальных клеток. Сходное строение актомиозинового хемомеханического преобразователя в миоэпителиальных клетках и в ГМК указывает на идентичный механизм сокращения этих клеток. Сокращаясь, миоэпителиальные клетки способствуют продвижению секрета из концевых отделов по выводным протокам желёз. Ацетилхолин стимулирует сокращение миоэпителиальных клеток слёзных и потовых желёз, норадреналин — слюнных желёз, окситоцин — лактирующих молочных желёз.
Рис. 7-30. Миоэпителиальная клетка. Корзинчатой формы клетка окружает секреторные отделы и выводные протоки желёз. Клетка способна к сокращению, обеспечивает выведение секрета из концевого отдела. [17]
Миофибробласты
Миофибробласты проявляют свойства фибробластов и ГМК. При заживлении раны часть фибробластов начинает синтезировать гладкомышечные актины и миозины. Дифференцирующиеся миофибробласты способствуют сближению раневых поверхностей. Миофибробласты также встречаются при фиброматозах, фиброзах лёгких, печени, почек.
Движение немышечных клеток
Способность клеток к движению наблюдается уже в раннем эмбриогенезе (гаструляция, направленная миграция клеток в места закладки будущих органов). Во взрослом организме часть клеток утрачивает подвижность, формируя клеточные пласты, сети, ансамбли (эпителиальные клетки, нейроны, кардиомиоциты), другие клетки должны активно перемещаться для выполнения своих функций (лейкоциты, камбиальные клетки при регенерации, сперматозоиды). Перемещение клеток осуществляется при помощи жгутика и/или посредством амебоидных движений.
Движение клетки при помощи жгутика
Жгутик содержит аксонему — мотор с тубулин-динеиновым хемомеханическим преобразователем. Подвижность сперматозоидов обеспечивает аксонема, расположенная в хвостовой нити.
Амебоидное движение
Подвижность различных клеток (например, нейтрофилов, фибробластов, макрофагов) обеспечивает актомиозиновый хемомеханический преобразователь, в том числе циклы полимеризации и деполимеризации актина. Немышечные формы актина и миозина создают тянущее усилие, обеспечивающее миграцию клеток. Само перемещение клеток включает адгезию мигрирующих клеток к субстрату (межклеточному матриксу), образование цитоплазматических выростов (псевдоподий) по ходу движения и ретракцию заднего края клетки.
Адгезия. Амебоидное движение невозможно без адгезии клетки к субстрату. Молекулы точечной адгезии (интегрины) обеспечивают прикрепление клетки к молекулам межклеточного матрикса.
· Клетки нервного гребня имеют несколько интегриновых рецепторов к различным молекулам межклеточного матрикса. In vitro АТ к СЕ b2 молекулы интегрина блокируют прикрепление клеток к фибронектину, ламинину, коллагенам.
· Миграция нейтрофилов в зону воспаления начинается с адгезии к эндотелию. Интегрины (a4b7) в мембране нейтрофилов взаимодействуют с молекулами адгезии гликокаликса эндотелия, и нейтрофилы проникают между эндотелиальными клетками (хоминг). Адгезия нейтрофилов к витронектину и фибронектину обеспечивает движение клеток через соединительную ткань к месту воспаления.
Образование псевдоподий. Стимуляция клетки вызывает полимеризацию актина — ключевой момент для образования псевдоподии. Актин формирует тонкую сеть из коротких филаментов, соединённых при помощи актинсвязывающих белков (филамин, фимбрин, a–актинин, профилин). Различные классы молекул влияют на архитектуру и динамику актина (например, актин-связывающие белки, вторые посредники).
Ретракция. Вслед за образованием псевдоподии совершается ретракция заднего края клетки. Развитие сократительной реакции начинается со сборки биполярных миозиновых нитей. Образующиеся короткие толстые нити миозина взаимодействуют с актиновыми филаментами, вызывая скольжение нитей относительно друг друга. Актомиозиновый преобразователь развивает силу, разрывающую адгезионные контакты и приводящую к ретракции заднего края клетки. Формирование и разрушение адгезионных контактов, полимеризация и деполимеризация актина, образование псевдоподий и ретракция — следующие друг за другом события амебоидного перемещения клетки.